 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Les parties 1 et 2 sont indépendantes. Les documents utiles à la résolution sont rassemblés en fin d'exercice. Données : ? Masses molaires atomiques : Élément.
 Chapitre 23 – Contrôle de qualité : dosages par titrage direct Sirius
Chapitre 23 – Contrôle de qualité : dosages par titrage direct Sirius
–(aq)) de concentration c = 50 10 3 molL 1
 Exercice n°2 : ANALYSE DUN LAIT 65 pts
Exercice n°2 : ANALYSE DUN LAIT 65 pts
On se propose de déterminer les masses en ions chlorure et en acide lactique présents dans un lait. 1. DOSAGE PAR CONDUCTIMÉTRIE.
 Chapitre 3 Conductimétrie
Chapitre 3 Conductimétrie
conductivité en S.m-1 ?i : conductivité molaire ionique de l'ion Xi en S.m2.mol-1. Exemple : solution aqueuse de chlorure de potassium de concentration c.
 Chapitre 5 : Dosage par titrage
Chapitre 5 : Dosage par titrage
?i la conductivité molaire ionique de l'ion Xi (en S.m2.mol?1) Lors d'un titrage conductimétrique on mesure l'évolution de la conductivité ? de la ...
 Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Justifier l'évolution de la conductivité. On dose par titrage conductimétrique
 Exercice III: titrage des ions dans une eau minérale (4 points
Exercice III: titrage des ions dans une eau minérale (4 points
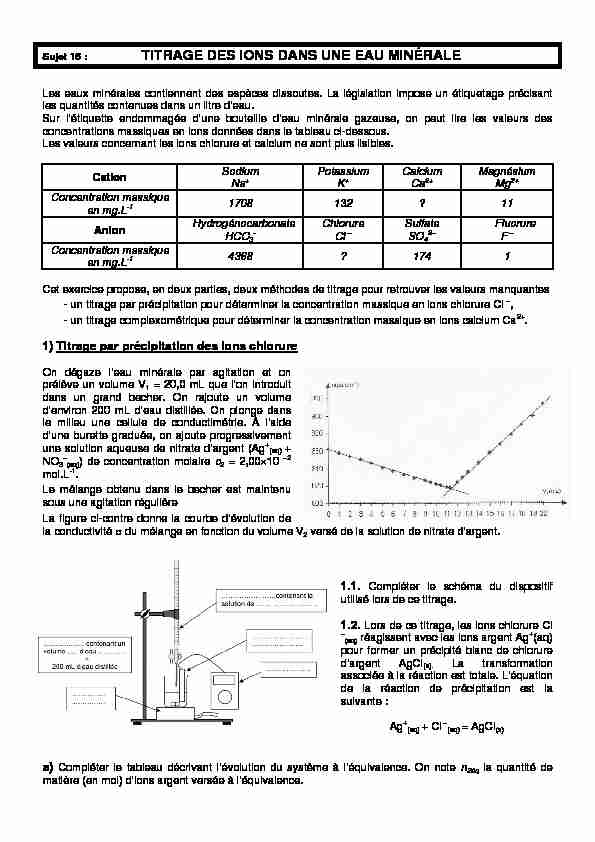
mol.L-1. Le mélange obtenu dans le becher est maintenu sous une agitation régulière. La figure ci-contre donne la courbe d'évolution de la conductivité ? du
 Les titrages acido-basiques en Terminale S.
Les titrages acido-basiques en Terminale S.
3 mai 2007 5.4.1 Exemple 1 : titrage d'un acide. ... Les exercices ayant pour thème un titrage acido-basique sont très classiques ... ionique de l'eau.
 Devoir surveillé N°3
Devoir surveillé N°3
19 déc. 2018 Exercice 1 : Le paracétamol (7 points) ... La ferroïne est un indicateur coloré de titrage d'oxydoréduction. Le titrage est réalisé par une ...
 Exercices p 59 Ch 3 méthode chimique danalyse qcm n° 1 1. Aet C
Exercices p 59 Ch 3 méthode chimique danalyse qcm n° 1 1. Aet C
La grandeur mesurée est donc la conductivité de 1. Réaction de titrage. 2. Les ions oxonium versés sont tous consommés et il reste encore des ions.
 Sujet 16 : TITRAGE DES IONS DANS UNE EAU MINÉRALE
Sujet 16 : TITRAGE DES IONS DANS UNE EAU MINÉRALE Les eaux minérales contiennent des espèces dissoutes. La législation impose un étiquetage précisant
les quantités contenues dans un litre d'eau.Sur l'étiquette endommagée d'une bouteille d'eau minérale gazeuse, on peut lire les valeurs des
concentrations massiques en ions données dans le tableau ci-dessous. Les valeurs concernant les ions chlorure et calcium ne sont plus lisibles.Cation Sodium
NaPotassium
KCalcium
Ca 2+Magnésium
Mg2+ Concentration massique
en mg.L -11708 132 ? 11
Anion Hydrogénocarbonate
HCO 3-Chlorure
ClSulfate
SO42- Fluorure
FConcentration massique
en mg.L -1 4368? 174 1 Cet exercice propose, en deux parties, deux méthodes de titrage pour retrouver les valeurs manquantes
- un titrage par précipitation pour déterminer la concentration massique en ions chlorure Cl - un titrage complexométrique pour déterminer la concentration massique en ions calcium Ca 2+1) Titrage par précipitation des ions chlorure
On dégaze l'eau min
érale par agitation et on
prélève un volume V1 = 20,0 mL que l'on introduit dans un grand becher. On rajoute un volume d'environ 200 mL d'eau distillée. On plonge dans le milieu une cellule de conductimétrie. À l'aide d'une burette graduée, on ajoute progressivement une solution aqueuse de nitrate d'argent (Ag (aq) NO 3- (aq) ) de concentration molaire c 2 = 2,00 10 -2 mol.L -1Le mélange obtenu dans le becher est maintenu
sous une agitation régulière La figure ci-contre donne la courbe d"évolution de la conductivité du mélange en fonction du volume V2 versé de la solution de nitrate d'argent.1.1. Compléter le schéma du dispositif
utilisé lors de ce titrage.1.2. Lors de ce titrage, les ions chlorure Cl
-(aq) réagissent avec les ions argent Ag (aq) pour former un précipité blanc de chlorure d'argent AgCI (s). La transformation associée à la réaction est totale. L'équation de la réaction de précipitation est la suivante : Ag (aq) + Cl (aq) = AgCI (s) a) Compléter le tableau décrivant l'évolution du système à l'équivalence. On note n2éq
la quantité de matière (en mol) d'ions argent versée à l'équivalence. b) En déduire la relation entre la quantité initiale n 1 en mol des ions chlorure et la quantité de matière n2éq
(en mol) d'ions argent versée à l'équivalence.1.3. Déterminer la valeur du volume V
2éq
de la solution de nitrate d'argent versé à l'équivalence.1.4. En utilisant les questions précédentes, calculer la concentration molaire c
1 des ions chlorure dans l'eau minérale étudiée.1.5. La concentration massique C
m (exprimée en g.L -1 ) d'une espèce chimique X en solution est le produit de sa concentration molaire (exprimée en mol.L -1 ) par sa masse molaire moléculaire (exprimée en g.mol -1 - Calculer la concentration massique notée C m des ions chlorure dans cette eau minérale. On donnera le résultat en mg.L -1 Donnée : masse molaire atomique du chlore M(Cl) = 35,5 g.mol -12) Titrage complexométrique des ions calcium
On utilise comme solution titrante, une solution d'acide ÉthylèneDiamineTétraAcétique connue aussi
sous le nom d'EDTA. Ce titrage se fait en présence d'un indicateur coloré de fin de réaction et d'une
solution tampon permettant de maintenir le pH de la solution entre 9 et 10.On réalise le titrage d'un volume V'
1 = 20,0 mL d'eau minérale par la solution d'EDTA de concentration molaire c' 2 = 5,0x10 -3 mol.L -1 . À l'équivalence, le volume versé d'EDTA est V'2éq
= 10,8 mL.2.1. En milieu basique, l'EDTA contient des ions notés Y
4- qui réagissent avec les ions calcium (Ca 2+ ) et magnésium (Mg 2+ ) contenus dans l'eau minérale pour former des complexes très stables selon les équations : Ca 2+ (aq) + Y 4- (aq) = [CaY] 2- (aq) Mg 2+ (aq) + Y 4- (aq) = [MgY] 2- (aq)Soient n
i (Ca 2+ ) et n i (Mg 2+ ) les quantités de matière initiales d'ions calcium et magnésium présents dans le volume V 1 d'eau minérale, n'2Éq
désigne la quantité de matière d'ions Y 4- versée pour atteindre l'équivalence. - Quelle relation lie ces trois quantités de matière ?2.2. Montrer que la somme des concentrations molaires des ions calcium et magnésium est donnée par
la relation : [Ca 2+ ] + [Mg 2+ 22Eq1 cV V
2.3. À l'aide de la valeur (donnée dans le tableau de l'introduction) de la concentration massique
des ions magnésium contenus dans l'eau minérale étudiée, en déduire la valeur de la concentration massique (en mg.L -1 ) des ions calcium dans cette eau.Données
: Masses molaires atomiques M(Ca) = 40,1 g.mol -1M(Mg) = 24,3 g.mol
-1quotesdbs_dbs29.pdfusesText_35[PDF] Quelques notions de conductimétrie 1 Principe de la - Joel Houzet
[PDF] Dosage de l 'acide lactique dans le lait
[PDF] TP 3: Acides et Bases - ASSO-ETUD
[PDF] Courbes de titrages acide-base, par precipitation, par - Eduscol
[PDF] TP 16 : Equilibres acide-base - ASSO-ETUD
[PDF] Dosage triacide faible
[PDF] Evaluation par spectrophotométrie des teneurs en chlorophylle a
[PDF] Titrages acidobasiques de mélanges contenant une espèce forte et
[PDF] I - Dosage acido-basique de la solution d 'acide ascorbique
[PDF] TP1 : Dosage de l 'acidité d 'un vinaigre Nécessité de l 'étalonnage d
[PDF] Dosage de l 'acide ascorbique contenu dans un comprimé de
[PDF] dosage d 'une solution contenant de l 'acide oxalique et de - Eduscol
[PDF] sujet : dosage de l 'acidite d 'un lait - sbeccompanyfr
[PDF] Fiche 3 : Titrage - Studyrama
