 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
2.5. Cas d'un mélange d'un acide fort et d'un acide faible. Titrages acide-base. ... Soit à préparer un volume V d'une solution contenant l'espèce X de.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Savoir choisir un indicateur coloré adapté à un titrage acido-basique. détermination de la concentration d'une espèce à l'aide d'un titrage direct (voir ...
 VI..Etude sommaire des mélanges
VI..Etude sommaire des mélanges
Titrages acido-basiques Dans ce cas on mélange la solution initiale avec une autre solution: ... 2) Titrage d'un acide faible par une base forte:.
 § 7 (suite) Titrages acide-base
§ 7 (suite) Titrages acide-base
= 1 et pH = pKa. – pour ! = 1 la neutralisation est terminée. On a une solution contenant ca· "a du sel de la base conjuguée
 Cours de Chimie - Informatique Titrage acide/base
Cours de Chimie - Informatique Titrage acide/base
17?/04?/2013 Dans le cas du titrage d'un acide fort par une base forte ... volume total du mélange réactionnel
 Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Cas d'un mélange d'un acide fort et d'un acide faible. Soit à préparer un volume V d'une solution contenant l'espèce X de masse molaire M(X)
 Transformations chimiques en solution aqueuse
Transformations chimiques en solution aqueuse
LES ACIDES FORTS ET LES BASES FORTES VI – LES TITRAGES ACIDO-BASIQUES ... Un acide est un donneur de proton (ou une espèce capable.
 République Algérienne Démocratique et Populaire COURS DE
République Algérienne Démocratique et Populaire COURS DE
4) pH de divers mélanges d'acides et de bases a) Mélange d'une base forte et d'un acide faible b) Mélange de deux acides faibles. II.8 Titrages acido?
 Devoir Maison n°7
Devoir Maison n°7
12?/06?/2018 est notée gamma ) d'une solution aqueuse contenant un mélange ... ? Indiquer les espèces acido-basiques présentes dans la solution (S).
 Dosages acidobasiques
Dosages acidobasiques
09?/02?/2018 chera par exemple la concentration d'un acide (fort ou faible) ... tant dans la solution contenant l'espèce à doser un indicateur coloré ...
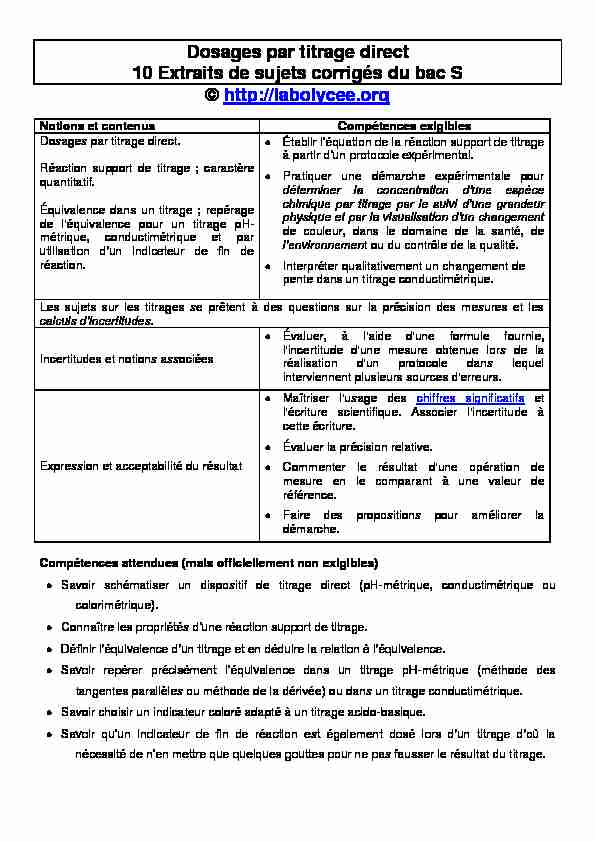
Dosages par titrage direct
10 Extraits de sujets corrigés du bac S
© http://labolycee.org
Notions et contenus Compétences exigibles
Dosages par titrage direct.
Réaction support de titrage ; caractère
quantitatif.Équivalence dans un titrage ; repérage
de l'équivalence pour un titrage pH- métrique, conductimétrique et par réaction.à part
Pratiquer une démarche expérimentale pour de couleur, dans le domaine de la santé, de t ou du contrôle de la qualité.Interpréter qualitativement un changement de
pente dans un titrage conductimétrique. Les sujets sur les titrages se prêtent à des questions sur la précision des mesures et lesIncertitudes et notions associées
Évaluer, à l'aide d'une formule fournie, l'incertitude d'une mesure obtenue lors de la réalisation d'un protocole dans lequel interviennent plusieurs sources d'erreurs.Expression et acceptabilité du résultat
Maîtriser l'usage des chiffres significatifs et l'écriture scientifique. Associer l'incertitude à cette écriture.Évaluer la précision relative.
Commenter le résultat d'une opération de mesure en le comparant à une valeur de référence.Faire des propositions pour améliorer la
démarche. Compétences attendues (mais officiellement non exigibles)Savoir schématiser un dispositif de titrage direct (pH-métrique, conductimétrique ou
colorimétrique).Connaître l
-métrique (méthode des tangentes parallèles ou méthode de la dérivée) ou dans un titrage conductimétrique. Savoir choisir un indicateur coloré adapté à un titrage acido-basique. usser le résultat du titrage. en autonomie, les étapes nécessaires à la par exemple).MÉTHODE :
- (placée dans la burette).- différencier le volume titré (prélèvement) du volume de la solution dont on cherche la
on !)- noter si la solution a été diluée avant le titrage : la concentration trouvée sera donc celle
de la solution fille et il faudra la multiplier par le facteur de dilution pour trouver la concentration
de la solution mère. étape indispensable à la résolution du problème)Mettre des indices aux grandeurs utilisées dans les relations (Vtitré, VE, V1, Vsolution, n(A)titré,
n(B)versé, CA mais pas V, n ou C tout court) Comme toujours, vérifier la cohérence de vos résultats. Les corrigés sont rédigés par les professeurs Ces corrigés sont accessibles gratuitement et sans inscription sur http://labolycee.org Contacts : https://twitter.com/Labolycee ; https://www.facebook.com/labolycee/ ; labolycee@labolycee.org Extrait 1 Bac S Antilles Guyane Session de remplacement 09/2013 http://labolycee.org EXERCICE 2 UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE LIBUPROFÈNEACCÈS CORRECTION
Troisième partie
ibuprofène 400 mg » : - on sépare la molécule active des excipients pa - ntenant une solution aqueuse +(aq) + HO(aq)) de concentration molaire apportée cb = 0,20 mol.L-1. Letitrage est suivi par pH-métrie (les courbes obtenues sont tracées dans le document 3 ci-après).
3.1. Réaliser un schéma du mont
3.3. On rentre dans un tableur-grapheur les différentes valeurs du pH mesurées en fonction du
volume Vb tés du tableur- grapheur pour dériver le pH par rapport à Vb, la grandeur obtenue est notée b dpH dV . Les courbes tracées suite au titrage pH-métrique sont pH = f(Vb) et b dpH dV = g(Vb) (document 8).3.3.1. Parmi les courbes 1 et 2, quelle est celle qui représente pH = f(Vb) et celle qui
représente b dpH dV = g(Vb) ? Justifier.3.3.2. Déterminer la valeur du volume équivalent VE par une méthode de votre choix.
COOH. ACCÈS CORRECTION
3.6. Quelles caractéristiques doit posséder une réaction chimique
titrage ? nE(HOi3.10. Déduire des résulta
à la valeur attendue.
3.12. Parmi les indicateurs colorés acido-basiques proposés dans le tableau ci-après, quel est
celui qui est le mieux adapté au titrage précédent ? Justifier. Indicateur coloré Couleur acide Zone de virage Couleur basiqueVert de bromocrésol jaune 3,8 5,4 bleu
Phénolphtaléine incolore 8,2 10 rose
jaune 10,1 12,0 rouge-orangéDonnées :
: M(C13H18O2) = 206 g.mol-1.ACCÈS CORRECTION
Extrait 2 : Bac S 2013 Polynésie http://labolycee.orgEXERCICE I.
ACCÈS CORRECTION
européenne. Celle- tartrique dans le vin.Dans cet exercice,
Les parties 1 et 2 sont indépendantes.
Données :
Masses molaires atomiques :
Élément H C O N S
M (g/mol) 1,00 12,0 16,0 14,0 32,1
2A : M(H2A) = 150 g.mol-1.
foncé. Les ions iodure I, les ions sulfate SO42 et le dioxyde de soufre en solution sont incolores.1. Dosage du dioxyde de soufre dans le vin.
SO2(aq)
diiode aqueux I2(aq). Pour cela, il introduit dans un erlenmeyer, un volume V1 = (20,000,05) mL de vin blanc
également incolore.
La solution titrante, de concentration en diiode C2 = (1,000,01)×102 mol.L-1 est ensuite
E = (6,28
0,05) mL de solution de
diiode. I2(aq) + SO2(aq) + 2H2O(l) 2I(aq) + SO42(aq) + 4H+(aq) ivalence.1.2. Déterminer la concentration molaire C1 en dioxyde de soufre de ce vin et en déduire que sa
concentration massique Cmexp en dioxyde de soufre est égale à 0,201 g.L-1. mexp mexp C dont on admet que, dans les conditions de 222mexpE2 mexp E 2
ǻquotesdbs_dbs29.pdfusesText_35
[PDF] TP1 : Dosage de l 'acidité d 'un vinaigre Nécessité de l 'étalonnage d
[PDF] Dosage de l 'acide ascorbique contenu dans un comprimé de
[PDF] dosage d 'une solution contenant de l 'acide oxalique et de - Eduscol
[PDF] sujet : dosage de l 'acidite d 'un lait - sbeccompanyfr
[PDF] Fiche 3 : Titrage - Studyrama
[PDF] 1 tp oo: dosage de l 'eau oxygenee par une solution de - lycée laroche
[PDF] Analyse du sang par la méthode chimique de Cordebard - E-EDUC
[PDF] La détermination de la teneur en matière grasse des laits - Hal
[PDF] Dosage iodométrique de la vitamine C Dosage - Étienne Thibierge
[PDF] tp n°6-prof : dosage en retour de la vitamine c - Physagreg
[PDF] dosage de la vitamine c - JF Noblet
[PDF] Dosage des carotenoides de la macrofaune - Archimer - Ifremer
[PDF] Epr TP 07 corrigé - Olympiades de chimie
[PDF] application au miel d 'une méthode de dosage par voie - Hal
