 3C1.D1.I1.2.CH7 Lion H+ un soleil sans planètes
3C1.D1.I1.2.CH7 Lion H+ un soleil sans planètes
Par exemple l'ion chlorure possède un noyau (avec 17 charges électriques positives)
 Atome de chlore (Cl) Ion chlorure (Cl-)
Atome de chlore (Cl) Ion chlorure (Cl-)
Combien y a-t-il d'électrons dans l'atome de chlore ? 17 b. En déduire la charge totale du Quelle est la charge du noyau de l'ion chlorure ? Pourquoi ?
 Partie Mécanique Thème 2 : Mouvement et interactions
Partie Mécanique Thème 2 : Mouvement et interactions
Comme Z = 17 l'atome de chlore possède 17 protons dans son noyau. 2 – Quel est le nombre de charges positives dans l'atome de chlore ? Comme les protons sont.
 Chapitre 3 : Les ions
Chapitre 3 : Les ions
L'atome de chlore de symbole Cl est comme tous les atomes électriquement neutre : c'est à dire que les charges positives de son noyau sont exactement
 Exercice 1. On considère un atome dont le noyau est caractérisé par
Exercice 1. On considère un atome dont le noyau est caractérisé par
Un atome est électriquement neutre ; nombre d'électrons (chargé -e ) Cet atome peut gagner assez facilement un électron pour donner un ion chlorure.
 La constitution de la matière – Latome et lion Atome de Fluor Ion
La constitution de la matière – Latome et lion Atome de Fluor Ion
que le nombre de charges positives (protons dans le noyau) soit égal au nombre d'électrons. On en déduit que 3 électrons gravitent autour du noyau. ? L'ion
 Sans titre
Sans titre
noyau de l'atome est chargé positivement alors que les électrons sont chargés négativement. chlorure et d'ions positifs
 Diapositive 1
Diapositive 1
centre un noyau chargé positivement
 ACTIVITE N°3 ions -tests caractéristiques
ACTIVITE N°3 ions -tests caractéristiques
1°> Le nombre de charges positives dans le noyau de l'atome (protons) d'une part et l'ion. Faire de même pour l'ion chlorure. 3°> Les solutions ioniques ...
 Chapitre 4 : le modèle de latome
Chapitre 4 : le modèle de latome
Le nombre de protons du noyau s'appelle nombre de charge ou numéro atomique et se note Z. Exemple :l'ion chlorure Cl-
 [PDF] Atomes et ions - Tribu
[PDF] Atomes et ions - Tribu
Comme les protons sont chargés positivement il y a donc 17 charges positives : (17+) 3 – La formule de l'ion chlorure est ? Quel est le nombre d'
 [PDF] Le noyau comporte 8 protons numéro atomique
[PDF] Le noyau comporte 8 protons numéro atomique
f) Le numéro atomique d'un atome est égale au nombre de protons du noyau Pour devenir l'ion Chlorure Cl- l'atome de Chlore doit gagner une charge
 [PDF] Atome de chlore (Cl) Ion chlorure (Cl-)
[PDF] Atome de chlore (Cl) Ion chlorure (Cl-)
Au bilan la charge totale de l'atome est de 0e (il est neutre) d- Combien y a-t-il d'électrons dans l'ion chlorure ? En déduire la charge totale du nuage
 [PDF] Les atomes et les ions - Cours 1 - AlloSchool
[PDF] Les atomes et les ions - Cours 1 - AlloSchool
Le nombre charge positives du noyau est représenté par la lettre Z appelé le Exemple : atome de chlore Cl (Z = 17) gagne un électron et devient l'ion
 [PDF] 4) Charge de lion - AlloSchool
[PDF] 4) Charge de lion - AlloSchool
La charge de l'ion est la somme de la charge de son noyau et de la charge de ses électrons l'ion est donc toujours chargé électriquement Page 2 PROF : SAID
 [PDF] 2-Ch3SDpdf - Seconde Scientifique
[PDF] 2-Ch3SDpdf - Seconde Scientifique
des ions chlorure Cl- et des ions sodium Cu2+ Comme il faut deux ions chlorure pour compenser la charge d'un ion cuivre la formule s'écrit : CuCl
 Les nombres A et Z
Les nombres A et Z
Les nombres A et Z identifient chaque espèce d'atomes symbolisé par X Exemple : le chlore le chlore (Cl) est identifié par un numéro atomique égale à 17
 [PDF] 1 Latome de chlore 11 Structure électronique Les orbitales 3d
[PDF] 1 Latome de chlore 11 Structure électronique Les orbitales 3d
Par contre son électroaffinité est négative : l'ion chlorure (non solvaté) est stable par rapport à l'atome On obtient la structure de l'argon avec apparition
 [PDF] Leçon 2 : atomes et ions Physique chimie
[PDF] Leçon 2 : atomes et ions Physique chimie
1) Combien de protons le noyau de l'ion bromure contient-il ? 2) Faites la somme algébrique des charges pour cet ion Combien d'électrons contient-il ?
Comment calculer le nombre de charge du noyau ?
Ainsi, pour un atome noté Z A X , contenant donc Z protons et Z électrons, la charge totale de son noyau vaut Q n o y a u = Z × e et la charge totale de son nuage électronique vaut Q n u a g e = Z × ? e .Quelles sont les charges des ions magnésium et chlorure ?
Un solide ionique étant neutre : MgCl2, il faut 2 ions Cl? pour compenser la charge 2+ de l'ion Mg2+.Quelle est la valeur de la charge électrique portée par un ion chlorure ?
L'ion chlorure Cl– porte une charge négative élémentaire q = –1,60 × 10–19 C et l'ion sodium porte une charge positive élémentaire q = 1,60 × 10–19 C.- La masse des électrons étant négligeable par rapport à celle du noyau, la masse d'un ion est donc égale à celle de son noyau. La charge électrique Q de l'ion plomb se calcule avec la formule Q = +2 × e car ce cation a deux charges positives. Soit Q = +2 × 1,6 × 10–19 = +3,2 × 10–19 C.
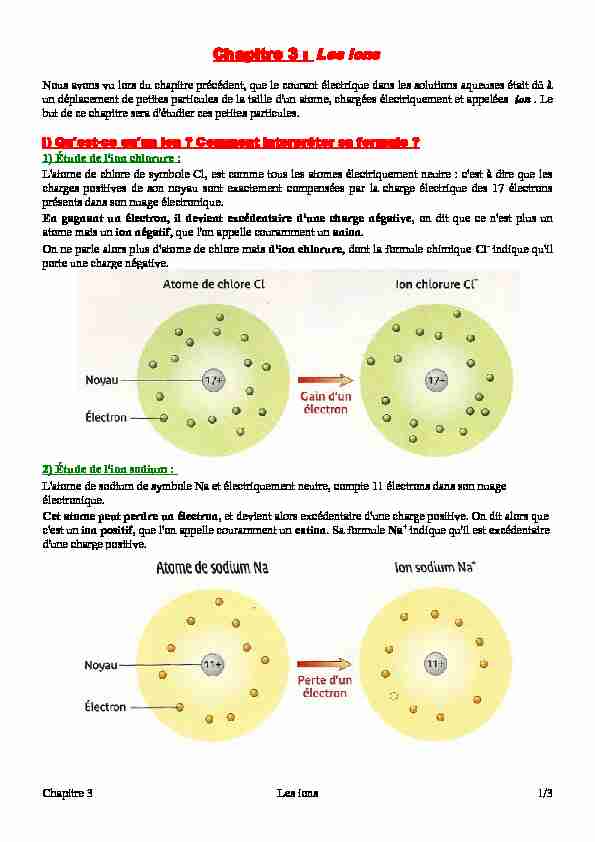
Chapitre 3 : Les ionsNous avons vu lors du chapitre précédent, que le courant électrique dans les solutions aqueuses était dû à
un déplacement de petites particules de la taille d'un atome, chargées électriquement et appelées ion . Le
but de ce chapitre sera d'étudier ces petites particules. I) Qu'est-ce qu'un ion ? Comment interpréter sa formule ?1) Étude de l'ion chlorure :
L'atome de chlore de symbole Cl, est comme tous les atomes électriquement neutre : c'est à dire que les
charges positives de son noyau sont exactement compensées par la charge électrique des 17 électrons
présents dans son nuage électronique.En gagnant un électron, il devient excédentaire d'une charge négative, on dit que ce n'est plus un
atome mais un ion négatif, que l'on appelle couramment un anion.On ne parle alors plus d'atome de chlore mais d'ion chlorure, dont la formule chimique Cl- indique qu'il
porte une charge négative.2) Étude de l'ion sodium :
L'atome de sodium de symbole Na et électriquement neutre, compte 11 électrons dans son nuageélectronique.
Cet atome peut perdre un électron, et devient alors excédentaire d'une charge positive. On dit alors que
c'est un ion positif, que l'on appelle couramment un cation. Sa formule Na+ indique qu'il est excédentaire
d'une charge positive.Chapitre 3Les ions1/3
Exemples :
A partir de leurs modèles schématisés ci-dessous, donne la formule chimique des ions cuivre, fer II et fer
fer III. On donne les formules des atomes : atome de cuivre : Cu ; atome de fer : FeL'ion cuivre possède 27 électronsL'ion fer II possède 24 électronsL'ion fer III possède 23 électrons
L'ion cuivre possède 29 charges positives dans son noyau et 27 électrons dans son nuage électronique. Il
est donc excédentaire de 2 charges positives, sa formule est donc Cu2+. L'ion fer II est également excédentaire de deux charges positives, sa formule est Fe2+. L'ion fer III est lui excédentaire de trois charges positives, sa formule est Fe3+.A retenir :
Les atomes et molécules sont électriquement neutres, mais en gagnant un ou plusieurs électrons ils se
chargent négativement et deviennent des ions négatifs ou anions.De même en perdant un ou plusieurs électrons ils se chargent positivement et deviennent alors des ions
positifs ou cations.La formule chimique de l'ion, est constituée du symbole de l'atome dont il dérive suivi en exposant du
nombre de charges positives (+) ou négatives (-) qu'il a en excès.Ainsi l'ion cuivre est un cation qui possède deux charges positives en excès : sa formule est Cu2+.
L'ion chlorure est un anion possédant un électron en excès : sa formule est Cl-.3) Quels sont les ions à connaître ?
Les ions suivants et leurs formules sont a mémoriserNom de
l'ionIon chlorureIon sulfate Ion sodiumIon cuivreIon zincIon fer IIIon fer IIIFormule Cl- SO42-Na+Cu2+Zn2+Fe2+Fe3+
II) Les ions en solutions aqueuses :
1) Ou trouve-t-on des ions ?
Étude du document 1
Réponses aux questions :
1- Pour être stable, la matière doit être neutre. C'est pour cela que les ions n'existent pas seuls dans la
nature. Il s'associent entre eux pour former des solides ioniques neutres.2- On ne peut alors trouver des ions que dans les solutions ioniques, ou les ions sont alors dissout dans un
solvant.3- a) Une solution aqueuse de chlorure de fer III, contient des ions chlorure (Cl-) et des ions fer III (Fe3+).
3- b) Sachant que les solutions aqueuses doivent respecter le principe d'électroneutralité, on en déduit
qu'il doit y avoir trois fois plus d'ions chlorure que d'ions fer III dans la solution aqueuse de chlorure de
fer III.Chapitre 3Les ions2/3
2) Que nous indiquent le nom et la formule d'une solution aqueuse ?
Étude du document 2
Réponses aux questions :
1- Le nom d'une solution aqueuse nous indique les ions présents dans la solution.
2- La formule chimique de la solution, en plus de nous indiquer les ions présents dans la solution, nous
informe sur la proportion des ions présents en solution.3- a) La formule de la solution de chlorure de sodium est (Na+ + Cl-)
3-b) La formule de la solution de sulfate de fer II est (Fe2+ + SO42-)
3-c) La formule de la solution de chlorure de fer III est (Fe3+ + 3Cl-)
III) Comment reconnaître la présence des ions dans les solutions aqueuses ?1) Par leur couleur en solution aqueuse :
Certaines solutions aqueuses ioniques sont colorées. Ce sont les ions qui sont responsables de la coloration des solutions. Ainsi les ions Cu2+ sont bleus en solution aqueuse, et les ions Fe3+ orangés.La couleur de la solution permet donc bien souvent de se faire une bonne idée sur l'ion qu'elle contient.
2) A l'aide de tests caractéristiques :
Voir TP chimie n°2 + le corrigé
Certains tests chimiques permettent de reconnaître la présence de certains ions en solution aqueuse.
Les tests suivants et leurs résultats sont à mémoriser. Une animation pour s'entraîner sur les tests de reconnaissance : cliquer ICIChapitre 3Les ions3/3
quotesdbs_dbs29.pdfusesText_35[PDF] atome de chlore composition
[PDF] charge de l'ion chlorure
[PDF] structure électronique de l'ion chlorure
[PDF] ion chlorure cl-
[PDF] composition des atomes
[PDF] nombre de nucléons dans le cuivre
[PDF] nombre de protons dans le chlore
[PDF] atome de cuivre nombre d'électrons
[PDF] charge électrique d'un noyau
[PDF] force électrique f=qe
[PDF] force de coulomb formule
[PDF] loi de coulomb formule
[PDF] q=n*e
[PDF] régularisation des rattachements
