 TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE
TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE
Zone de virage (pH approximatif). Couleur. (base). Bleu de bromothymol BBT. (1° virage) rose-rouge. ≈0
 Indicateur TA
Indicateur TA
L'indicateur TA est un indicateur de pH dont les caractéristiques sont similaires à celles de la phénolphtaléine en effet les zones de virages des deux
 Phénolphtaléine. Laboratoire de chimie
Phénolphtaléine. Laboratoire de chimie
9 janv. 2014 Il vire du jaune (dans sa forme acide) au bleu. (dans sa forme basique) la zone de virage colorée en vert se situant entre pH 8 à 9
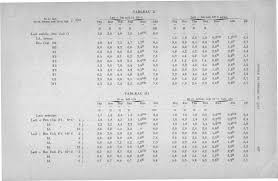 par Dr Alb. J.-J. VAND~VELDE Ladétermination de lindice de la
par Dr Alb. J.-J. VAND~VELDE Ladétermination de lindice de la
titrée avec cette phénolphtaléine; la thymolphtaléine dont la zone de virage (pH 95 à 10;5)se rapproche de celle de la phénolphtaléine donne. Page 8. TABLEAU.
 CHIMIE GÉNÉRALE TITRE DE LA LEÇON : DOSAGE ACIDO
CHIMIE GÉNÉRALE TITRE DE LA LEÇON : DOSAGE ACIDO
zone de virage de la phénolphtaléine se situe entre 82 et 10. On constate que : 8
 Rapport de stage M58
Rapport de stage M58
Il vire de l'incolore au rose et sa zone de virage se situe dans l'intervalle de pH [8 ;. 10]. De formule brute C20H14O4 la phénolphtaléine est un composé
 TP alcalinité
TP alcalinité
(zone de virage de la. Phénolphtaléine) on utilise ensuite l'erlenmeyer dont le incolore. Ajouter 4-5 gouttes d'hélianthine l'eau devient jaune ite l
 -bulletin
-bulletin
▫ Zone de virage à environ pH 8.3-10. ▫ Changement de couleur clairement visible. ▫ Mesurable par analyse d'image assistée par ordinateur. ▫ Convient à la
 INDICATEUR TA 1 L
INDICATEUR TA 1 L
L'indicateur TA est un indicateur de pH dont les caractéristiques sont similaires à celles de la phénolphtaléine en effet les zones de virages des deux
 Untitled
Untitled
On réalisera un dosage acido-basique en choisissant parmi les indicateurs colorés suivants : hélianthine phénolphtaléine
 TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE
TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE
TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES Zone de virage (pH approximatif). Couleur ... virage) jaune. 80-9
 Rapport de stage M58
Rapport de stage M58
Thème du stage: Substitution de la phénolphtaléine par un autre indicateur Il vire de l'incolore au rose et sa zone de virage se situe dans l'intervalle ...
 MESURE DE LA PROFONDEUR DE CARBONATATION
MESURE DE LA PROFONDEUR DE CARBONATATION
Mesure de la zone décolorée où le pH passe de 13 (initialement) à environ 9 différents l'un à base de phénolphtaléine (virage pH~9)
 Phénolphtaléine. Laboratoire de chimie
Phénolphtaléine. Laboratoire de chimie
9 janv. 2014 Cet indicateur coloré présente une zone de virage se situant entre 8 et 96. Il vire du jaune en milieu acide au bleu en milieu basique. Bleu de ...
 TP - Spé
TP - Spé
15 avr. 2013 zone de virage violet - rose. Molécule de Phénolphtaléine l'hexacyanoferrate de potassium. •. Le ferrocyanure de potassium aussi appelé ...
 Correction des exercices du chapitre 8
Correction des exercices du chapitre 8
Pour la phénolphtaléine : zone de virage : 8.2 – 10. Ainsi il faut choisir la phénolphtaléine comme indicateur coloré pour ce titrage.
 CORRIGE
CORRIGE
8 nov. 2019 la moindre trace d'eau. Caractéristiques de la phénolphtaléine : Phénolphtaléine. Forme acide incolore. Zone de virage. pH = 82 à pH = 10
 Ch.4 IdentIfIcatIon dIons
Ch.4 IdentIfIcatIon dIons
virage du bleu de bromothymol qui sera alors entre le bleu et le jaune c'est-à-dire vert. Indicateur coloré. Couleur. Intervalle de pH de la zone de virage.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
L'équivalence est détectée pour 128 mL de solution d'hydroxyde de sodium. Données : Phénolphtaléine : incolore pour pH < 8
 TP de Chimie no 5 Zone de virage dun indicateur coloré 1 Leffet
TP de Chimie no 5 Zone de virage dun indicateur coloré 1 Leffet
Zone de virage d'un indicateur coloré. 1 L'effet tampon. 1.1 Définition. Une solution tampon est une solution dont le pH varie très peu lorsque l'on ajoute
 [PDF] indicateurspdf
[PDF] indicateurspdf
TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE QUELQUES INDICATEURS COLORÉS DE pH Indicateur Couleur (acide) Zone de virage (pH approximatif) Couleur
 [PDF] Phénolphtaléine Laboratoire de chimie - MSLP - Dijon
[PDF] Phénolphtaléine Laboratoire de chimie - MSLP - Dijon
9 jan 2014 · (dans sa forme basique) la zone de virage colorée en vert se situant entre pH 8 à 96 Rouge de phénol Cet indicateur coloré permet de
 [PDF] Liste dindicateurs colorés - Fun MOOC
[PDF] Liste dindicateurs colorés - Fun MOOC
Liste d'indicateurs colorés Indicateur coloré Zone de virage Phénolphtaléine 82 – 98 incolore - rose 94 Jaune d'alizarine R 102 – 120
 [PDF] Rapport de stage M58 - Physique Chimie
[PDF] Rapport de stage M58 - Physique Chimie
Il vire de l'incolore au rose et sa zone de virage se situe dans l'intervalle de pH [8 ; 10] De formule brute C20H14O4 la phénolphtaléine est un composé
 Préparations Indicateurs colorants acides etc - AC Nancy Metz
Préparations Indicateurs colorants acides etc - AC Nancy Metz
Zone de virage des indicateurs acide-base Potentiel de virage des indicateurs redox Coloration des indicateurs complexométriques en fonction du pH
 [PDF] TP de Chimie no 5 Zone de virage dun indicateur coloré 1 Leffet
[PDF] TP de Chimie no 5 Zone de virage dun indicateur coloré 1 Leffet
Zone de virage d'un indicateur coloré 1 L'effet tampon 1 1 Définition Une solution tampon est une solution dont le pH varie très peu lorsque l'on ajoute
 Phénolphtaléine - Wikipédia
Phénolphtaléine - Wikipédia
Sa zone de virage est située entre un de pH = 82 (passage de l'incolore au rose) et 100 Autrement dit la phénolphtaléine est un marqueur pour les solutions
 [PDF] Chimie des couleurs
[PDF] Chimie des couleurs
ine Bleu de bromothymol Phénolphtaléine) ont ymol Phénolphtaléine) ont Zone de virage : 62 - 76 Hélianthine : Bleu de bromothymol:
 [PDF] Expériences portant sur la notion dindicateur coloré
[PDF] Expériences portant sur la notion dindicateur coloré
p Les indicateurs unicolores deviennent colorés pour un pH de virage : pHv Par exemple avec la phénolphtaléine ( ) pKa = 9 6 la forme basique est
Quelle est la zone de virage de la pHénolphtaléine ?
Sa zone de virage est située entre un de pH = 8,2 (passage de l'incolore au rose) et 10,0. Autrement dit, la phénolphtaléine est un marqueur pour les solutions basiques, c'est-à-dire ayant un pH > 7.Quel est le rôle de l'indicateur coloré pHénolphtaléine ?
Exemple de la phénolphtaléine
Cet indicateur coloré a servi à repérer l'équivalence au cours d'un dosage acido-basique car sa couleur varie en fonction du pH. Le tournesol contient un acide (l'azolitmine) dont les molécules (forme acide) sont de couleur rouge et les anions (forme basique) sont bleus.Pourquoi la pHénolphtaléine change de couleur ?
La phénolphtaléine est un indicateur coloré servant à estimer le pH dans les dosages d'acide faible ou de base forte. Il change de couleur selon la valeur du pH de la solution. Il vire de l'incolore en milieu acide au rose pour un pH supérieur à 8.9 jan. 2014- La forme acide et sa base conjuguée ont des couleurs différentes. La solution prendra la couleur de la forme qui prédomine, déterminée par le pH de la solution. si pH = pKln alors [HIn]=[In-] et on a un mélange des 2 couleurs A et B , c'est la zone de virage de l'indicateur .
TP de Chimie n
o5Zone de virage d"un indicateur coloré1L"effet tamp on 1.1 Définition Une solution tampon est une solution dont le pH varie très peu lorsque l"on ajoute des quantités modérées d"acide et de base, ou par dilution modérée. Une solution tampon contient un acide faible et sa base conjuguée en concentrations du même ordre de grandeur. Autrement dit, les deux espèces conjuguées sont dans leur domaine de coexistence : Le pH est proche dupKAdu couple acide/base présent dans la solution.pHpKAAHA pH1.5Où l"on retro uveles p ositionsdes limites des domaines de prédominance
[AH][A]Signifie que[AH]>10[A]: la forme acide est en concentration plus que dix fois plus forte, donc elle prédomine sur la forme basique. À la limite (inférieure) entre domaine de prédomi- nance de l"acide et coexistence des deux formes acide/base, on a l"égalité : [AH] = 10[A],[A][AH] =110OrpH = pKA+ log[A][AH]
donc : pH = pKA+ log110 = pKA1c.q.f.d.[AH][A]Signifie que10[AH]6[A]: la forme basique est
en concentration plus que dix fois plus forte, donc elle prédomine sur la forme acide. À la limite (supérieure) du domaine de prédomi- nance de la base et de coexistence des deux formes acide/base, on a l"égalité :10[AH] = [A],[A][AH]
= 10OrpH = pKA+ log[A][AH]
donc : pH = pKA+ log(10) = pKA+ 1c.q.f.d.2Les diagrammes de distribution Un diagramme de distribution permet de représenter les pourcentages relatifs d"espèce acide ou basique d"un couple, en fonction du pH. Il ne faut pas confondre dia- gramme de distribution et diagramme de prédominance (au Bac on demande rarement à tracer un diagramme de distribution, mais très couramment le diagramme de prédominance est demandé!).Par exemple, voici le diagramme de distribution
pour le couple A/B acide éthanoïque/ion éthanoate (CH3COOH=CH3COO). À 50%, à l"intersection des courbes, on effectue la lecture graphique de : pKA= pH(50%) = 4;8[CH3COOH][CH
3COO]pH0%50%100%
0%50%100%
03,5710,514acidebase
3Les indicateurs colorés acido-basiques
3.1Définition
Les indicateurs colorés acido-basiques sont
constitués par des couples acide/base dont les espèces conjuguées ont des teintes diffé- rentes.Exemple : le jus de fram-
boise, rouge en milieu acide et vert en milieu basique, peut être utilisé comme in- dicateur coloré. Ce change- ment de teinte est dû à la présence de cyanidine. Un indicateur coloré acido-basique doit être ajouté en quantité minime (une ou deux gouttes!) afin de ne pas perturber le milieu réactionnel.3.2Réaction sur l"eau Un indicateur coloré, constitué du couple acide/base (HInd=Ind), est caractérisé par sa constante d"aciditéKi correspondant à son équation de dissociation sur l"eau : HInd (aq)+ H2O(`)Ind (aq)+ H3O+ (aq) K i=[Ind]f[H3O+]f[HInd] f ,pH = pKi+ log[Ind]f[HInd] f La teinte de l"indicateur dépend de l"espèce qui prédomine et donc du pH de la solution.P.-M.ChaurandTP de Chimie no5 Page 2 sur 43.3Quelques indicateurs couran ts
Voici quelques exemples d"indicateurs colorés acido-basiques courants :Teinte Zone de Teinte Indicateurs acide virage basiqueHélianthine jaune 3,1!4,4 rougeRouge de méthyle jaune 4,2!6,2 rouge
Bleu de bromothymol jaune 6,0!7,6 bleu
Phénolphtaléine incolore 8,2!10,0 rose4Étude exp érimentale On considère le bleu de bromothymol (BBT), un indica- teur coloré acido-basique. 4.1 Mo deop ératoireOn va préparer 16 solutions de même volume, mais de pH différents. Dans chaque, on va mettre la même quantité de bleu de bromothymol. On va alors mesurer le pH et l"absorbanceAde chaque solution. Dans des béchers de taille normale (garder ceux de forme haute pour la suite), numérotés de 1 à 16, verser à la pipette jaugée 25,0 mL d"une solution S constituée d"un mélange de plusieurs acides (12,5 mL d"acide phos- phorique à 1,0 mol/L + 12,5 mL d"acide éthanoïque à 1,0 mol/L + 12,5 mL d"acide borique à 1,0 mol/L, complété à 1,0 L d"eau distillée).Se répartir le travail sur les 8 groupes!
Ajouter à la burette le volumeVde solution de soude à 0,10 mol/L tel qu"indiqué dans le tableau et agiter.N o1 2 3 4 5 6V(mL)12,5 11,9 11,3 10,6 10,0 9,4N o7 8 9 10 11 12V(mL)8,8 8,1 7,5 6,9 6,3 5,6N o13 14 15 16V(mL)5,0 4,4 3,8 3,1 Prélever à la pipette jaugée25,0 mLde chaque mélange obtenu. Bien sécher la pipette préalablement rincée à l"eau distillée, entre chaque prélèvement. Verser chaque prélèvement dans un bécher de forme haute portant le même numéro. Rincer les autres bé- chers. Ajouter 5 gouttes de solution de bleu de bromothymol, puis agiter le mélange (barreau aimanté dans chaque prélèvement + agitateur magnétique).Étalonner le pH-mètre.Mesurer le pH des solutions.
Effectuer le réglage du zéro de l"absorbance du spectro- photomètre, pour la radiationB= 620 nm. Transvaser quelques millilitres de chaque solution dans une cuve à spectrophotométrie. Mesurer leurs absor- bancesA, pour la radiationB=620 nm. Regrouper les résultats dans un tableau sur le modèle suivant :N o1 2 3 ... ... ... 15 16pH A %Ind %HInd4.2Sp ectresd"absorption Tracer les spectres d"absorption des solutions no1 et no16, ainsi que d"un autre échantillon à choisir libre- ment, dont on notera le numéro. 4.3Exploitation
Pour la plus grande valeur du pH, l"indicateur coloré (Hind/Ind) est uniquement sous sa forme basique, que l"on note Ind. On note la concentration de cette forme[Ind].a. Expliquer à l"aide des spectres la couleur des solu- tions no1 et no16.b.Pourquoi avoir fait le choix deB=620 nmpour
les mesures d"absorbance des solutions?c. À cette longueur d"onde, donner l"expression de l"ab- sorbanceAen fonction de la concentration de la forme basique[Ind].d. En déduire les pourcentages d"espèces Indet HInddans les différentes solutions. Compléter le tableau.P.-M.ChaurandTP de Chimie no5 Page 3 sur 4
e.Tracer lesdiagrammes de distributiondes espècesIndet HInd en fonction du pH.f .
Déterminer alors les domaines de prédominance des formes basiques et acides, ainsi que le pH exact de coexistence des deux formes à égalité (50% de chaque), que l"on noterapKAi.Donnée :Étoile chromatique :rouge cyan680 nm500 nmmagenta
vert400 nm540 nmjaune
bleu580 nm470 nm
5Év aluationpar comp étences
Voici les compétences qui vont être évaluées au cours de cette séance, dans l"ordre d"évaluation : Réaliser, manipuler, appliquer des consignes.Auto-évaluationÉvaluation professeur Rechercher, extraire et organiser de l"information utile.Auto-évaluationÉvaluation professeur Savoir s"évaluer.Auto-évaluationÉvaluation professeur Manifester curiosité, motivation à travers des activités conduites ou reconnues par l"établissement.Auto-évaluationÉvaluation professeur Voici le mode d"évaluation retenu pour ces compétences :J"ai réussi tout seul;J"ai compris mais j"ai fait quelques erreurs;
J"ai encore besoin de m"entrainer;
Je n"ai pas compris, il faut que je recommence.
Grille TPC 5
TableauA633,A470et pHAmaximum // précision + nécessité absorber seulAutoévaluationCompétences
Note .../4P.-M.ChaurandTP de Chimie no5 Page 4 sur 4quotesdbs_dbs44.pdfusesText_44[PDF] acide sulfanilique
[PDF] pourquoi peut-on affirmer qu'une mcv est une maladie sociale
[PDF] bleu de bromothymol
[PDF] maladie incidence sociale définition
[PDF] maladies sociales
[PDF] bbt
[PDF] liste maladie rare
[PDF] interpretation graphique d'une equation
[PDF] rouge de crésol zone de virage
[PDF] zone de virage rouge de méthyle
[PDF] zone de virage alizarine
[PDF] zone de virage bleu de thymol
[PDF] zone de virage pka
[PDF] zone de virage bbt
