 TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE
TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE
Zone de virage (pH approximatif). Couleur. (base). Bleu de bromothymol BBT. (1° virage) rose-rouge. ≈0
 Indicateur TA
Indicateur TA
L'indicateur TA est un indicateur de pH dont les caractéristiques sont similaires à celles de la phénolphtaléine en effet les zones de virages des deux
 Phénolphtaléine. Laboratoire de chimie
Phénolphtaléine. Laboratoire de chimie
9 janv. 2014 Il vire du jaune (dans sa forme acide) au bleu. (dans sa forme basique) la zone de virage colorée en vert se situant entre pH 8 à 9
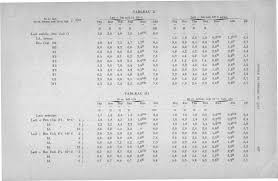 par Dr Alb. J.-J. VAND~VELDE Ladétermination de lindice de la
par Dr Alb. J.-J. VAND~VELDE Ladétermination de lindice de la
titrée avec cette phénolphtaléine; la thymolphtaléine dont la zone de virage (pH 95 à 10;5)se rapproche de celle de la phénolphtaléine donne. Page 8. TABLEAU.
 CHIMIE GÉNÉRALE TITRE DE LA LEÇON : DOSAGE ACIDO
CHIMIE GÉNÉRALE TITRE DE LA LEÇON : DOSAGE ACIDO
zone de virage de la phénolphtaléine se situe entre 82 et 10. On constate que : 8
 Rapport de stage M58
Rapport de stage M58
Il vire de l'incolore au rose et sa zone de virage se situe dans l'intervalle de pH [8 ;. 10]. De formule brute C20H14O4 la phénolphtaléine est un composé
 TP alcalinité
TP alcalinité
(zone de virage de la. Phénolphtaléine) on utilise ensuite l'erlenmeyer dont le incolore. Ajouter 4-5 gouttes d'hélianthine l'eau devient jaune ite l
 -bulletin
-bulletin
▫ Zone de virage à environ pH 8.3-10. ▫ Changement de couleur clairement visible. ▫ Mesurable par analyse d'image assistée par ordinateur. ▫ Convient à la
 INDICATEUR TA 1 L
INDICATEUR TA 1 L
L'indicateur TA est un indicateur de pH dont les caractéristiques sont similaires à celles de la phénolphtaléine en effet les zones de virages des deux
 Untitled
Untitled
On réalisera un dosage acido-basique en choisissant parmi les indicateurs colorés suivants : hélianthine phénolphtaléine
 TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE
TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE
TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES Zone de virage (pH approximatif). Couleur ... virage) jaune. 80-9
 Rapport de stage M58
Rapport de stage M58
Thème du stage: Substitution de la phénolphtaléine par un autre indicateur Il vire de l'incolore au rose et sa zone de virage se situe dans l'intervalle ...
 MESURE DE LA PROFONDEUR DE CARBONATATION
MESURE DE LA PROFONDEUR DE CARBONATATION
Mesure de la zone décolorée où le pH passe de 13 (initialement) à environ 9 différents l'un à base de phénolphtaléine (virage pH~9)
 Phénolphtaléine. Laboratoire de chimie
Phénolphtaléine. Laboratoire de chimie
9 janv. 2014 Cet indicateur coloré présente une zone de virage se situant entre 8 et 96. Il vire du jaune en milieu acide au bleu en milieu basique. Bleu de ...
 TP - Spé
TP - Spé
15 avr. 2013 zone de virage violet - rose. Molécule de Phénolphtaléine l'hexacyanoferrate de potassium. •. Le ferrocyanure de potassium aussi appelé ...
 Correction des exercices du chapitre 8
Correction des exercices du chapitre 8
Pour la phénolphtaléine : zone de virage : 8.2 – 10. Ainsi il faut choisir la phénolphtaléine comme indicateur coloré pour ce titrage.
 CORRIGE
CORRIGE
8 nov. 2019 la moindre trace d'eau. Caractéristiques de la phénolphtaléine : Phénolphtaléine. Forme acide incolore. Zone de virage. pH = 82 à pH = 10
 Ch.4 IdentIfIcatIon dIons
Ch.4 IdentIfIcatIon dIons
virage du bleu de bromothymol qui sera alors entre le bleu et le jaune c'est-à-dire vert. Indicateur coloré. Couleur. Intervalle de pH de la zone de virage.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
L'équivalence est détectée pour 128 mL de solution d'hydroxyde de sodium. Données : Phénolphtaléine : incolore pour pH < 8
 TP de Chimie no 5 Zone de virage dun indicateur coloré 1 Leffet
TP de Chimie no 5 Zone de virage dun indicateur coloré 1 Leffet
Zone de virage d'un indicateur coloré. 1 L'effet tampon. 1.1 Définition. Une solution tampon est une solution dont le pH varie très peu lorsque l'on ajoute
 [PDF] indicateurspdf
[PDF] indicateurspdf
TABLEAU RÉCAPITULATIF DES ZONES DE VIRAGES DE QUELQUES INDICATEURS COLORÉS DE pH Indicateur Couleur (acide) Zone de virage (pH approximatif) Couleur
 [PDF] Phénolphtaléine Laboratoire de chimie - MSLP - Dijon
[PDF] Phénolphtaléine Laboratoire de chimie - MSLP - Dijon
9 jan 2014 · (dans sa forme basique) la zone de virage colorée en vert se situant entre pH 8 à 96 Rouge de phénol Cet indicateur coloré permet de
 [PDF] Liste dindicateurs colorés - Fun MOOC
[PDF] Liste dindicateurs colorés - Fun MOOC
Liste d'indicateurs colorés Indicateur coloré Zone de virage Phénolphtaléine 82 – 98 incolore - rose 94 Jaune d'alizarine R 102 – 120
 [PDF] Rapport de stage M58 - Physique Chimie
[PDF] Rapport de stage M58 - Physique Chimie
Il vire de l'incolore au rose et sa zone de virage se situe dans l'intervalle de pH [8 ; 10] De formule brute C20H14O4 la phénolphtaléine est un composé
 Préparations Indicateurs colorants acides etc - AC Nancy Metz
Préparations Indicateurs colorants acides etc - AC Nancy Metz
Zone de virage des indicateurs acide-base Potentiel de virage des indicateurs redox Coloration des indicateurs complexométriques en fonction du pH
 [PDF] TP de Chimie no 5 Zone de virage dun indicateur coloré 1 Leffet
[PDF] TP de Chimie no 5 Zone de virage dun indicateur coloré 1 Leffet
Zone de virage d'un indicateur coloré 1 L'effet tampon 1 1 Définition Une solution tampon est une solution dont le pH varie très peu lorsque l'on ajoute
 Phénolphtaléine - Wikipédia
Phénolphtaléine - Wikipédia
Sa zone de virage est située entre un de pH = 82 (passage de l'incolore au rose) et 100 Autrement dit la phénolphtaléine est un marqueur pour les solutions
 [PDF] Chimie des couleurs
[PDF] Chimie des couleurs
ine Bleu de bromothymol Phénolphtaléine) ont ymol Phénolphtaléine) ont Zone de virage : 62 - 76 Hélianthine : Bleu de bromothymol:
 [PDF] Expériences portant sur la notion dindicateur coloré
[PDF] Expériences portant sur la notion dindicateur coloré
p Les indicateurs unicolores deviennent colorés pour un pH de virage : pHv Par exemple avec la phénolphtaléine ( ) pKa = 9 6 la forme basique est
Quelle est la zone de virage de la pHénolphtaléine ?
Sa zone de virage est située entre un de pH = 8,2 (passage de l'incolore au rose) et 10,0. Autrement dit, la phénolphtaléine est un marqueur pour les solutions basiques, c'est-à-dire ayant un pH > 7.Quel est le rôle de l'indicateur coloré pHénolphtaléine ?
Exemple de la phénolphtaléine
Cet indicateur coloré a servi à repérer l'équivalence au cours d'un dosage acido-basique car sa couleur varie en fonction du pH. Le tournesol contient un acide (l'azolitmine) dont les molécules (forme acide) sont de couleur rouge et les anions (forme basique) sont bleus.Pourquoi la pHénolphtaléine change de couleur ?
La phénolphtaléine est un indicateur coloré servant à estimer le pH dans les dosages d'acide faible ou de base forte. Il change de couleur selon la valeur du pH de la solution. Il vire de l'incolore en milieu acide au rose pour un pH supérieur à 8.9 jan. 2014- La forme acide et sa base conjuguée ont des couleurs différentes. La solution prendra la couleur de la forme qui prédomine, déterminée par le pH de la solution. si pH = pKln alors [HIn]=[In-] et on a un mélange des 2 couleurs A et B , c'est la zone de virage de l'indicateur .
Aide pour les exercices 1 et 2 :
n Le professeur a donné à Gertrude une solution inconnue X, deux tubes à essai, de la soude (Na+ HO-)
HP GX QLPUMPH G·MUJHQP $J+ NO3). Elle réalise des expériences et obtient les résultats suivants :
9 Un précipité orange dans le tube où elle a versé la solution X et la soude,
9 8Q SUpŃLSLPp NOMQŃ TXL QRLUŃLP j OM OXPLqUH RZ HOOH M YHUVp OM VROXPLRQ ; HP OH QLPUMPH G·MUJHQPB
9a) 4XHO HVP O·LRQ positif contenu dans la solution ? Justifier. I / 2
Je sais que lfer III, Fe3+
ions fer III dans la solution X.b) 4XHO HVP O·MXPUH LRQ ŃRQPHQX GMQV OM VRlution ? Justifier I / 2
Chlorure Cl- Chlorure Cl- dans la solution X.
c) Trouvez le nom de la solution X Ń·HVP du chlorure de fer III. Ra / 1o Jean-Edouard a devant lui deux tubes à essai O·XQ ŃRQPLHQP GX ŃOORUXUH G·MOXPLQLXP HP O·MXPUH GX
chlorure de fer II. Schématiser et légender les expériences TX·Ll doit réaliser pour distinguer ces deux
solutions ainsi que ses observations. Ch.4 CD D 0C ]0C4 ² évaluation
Ra / 4 Ré / 2
Ion Chlorure
Cl-Cuivre
Cu2+Fer II
Fe2+Fer III
Fe3+ Zinc Zn2+Aluminium
Al3+Réactif
Solution de nitrate
(Ag+ et NO3)Précipité
Hydroxyde de sodium (soude)
(Na+ HO-) Blanc qui noircit à la lumière Blanc Blanc Bleu Vert Orangé SoudeSolution
à tester
Je sais que la soude forme un précipité blanc avec les ions aluminium et un précipité vert avec les ions fer II. Si Jean-Edouard observe un précipité blanc, il pourra conclure qu·LO \ M des ions aluminium dans la solution testée ; ce sera donc la solution de ŃOORUXUH G·MOXPLQLXPB 6·LO RNVHUYH XQ SUpŃLSLPp YHUP LO SRXUUM ŃRQŃOXUH TX·LO \ M GHV LRQV IHU HH GMQV OM VROXPLRQ PHVPpH ; ce sera donc la solution de chlorure de fer II. IO HVP LQXPLOH GH UpMOLVHU OH PHVP MX QLPUMPH G·MUJHQP SXLVTXH GMQV OHV GHX[ solutions il y a des ions chlorure ; dans les deux cas, il se formera un précipité blanc qui ne nous permettra pas de différencier les deux solutions. p Aide pour les exercices 3 et 4 :p 2Q YHXP GpPHUPLQHU OH S+ GH O·HMX GH -MYHOB 2Q VMLP TXH ORUVTXH O·RQ YHUVH TXHOTXHV JRXPPHV GH
phénolphtaléine dans uQH VROXPLRQ G·HMX GH -MYHO ŃHPPH GHUQLqUH SUHQG XQH ŃRXOHXU IXVOLMB
a) Quelle information pouvez-vous en déduire à propos de son pH ? Justifiez ? I / 1
G·MSUqV OH PMNOHMX ŃL-dessus, je sais que la phénolphtaléine vire au fushia lorsque le pH de la
solution testée est supéULHXU j 10B -·HQ GpGXLV TXH OH S+ GH O·eau de Javel est supérieur à 10.
b) Cette solution est-elle acide, basique ou neutre ? Justifiez ? MCo / 2
-H VMLV TX·XQH VROXPLRQ HVP NMVLTXH ORUVque son pH est supérieur à 7 Ó·HQ GpGXLV TXH O·HMX GH
javel qui a un pH supérieur à 10 est une solution basique.c) Que faudrait-il utiliser pour déterminer précisément la valeur du pH ? MCo / 1
Pour plus de précision, il faudrait utiliser un pH-mètre.q On veut déterminer le pH O·HMX GH 3HUULHUB 2Q VMLP TXH ORUVTXH O·RQ YHUVH TXHOTXHV JRXPPHV GH vert de
bromocrésol dans cette eau de Perrier, elle prend une couleur bleue et que O·RQ \ YHUVH
quelques gouttes de rouge de phénol, elle prend alors une couleur jaune.a) Quelle information pouvez-vous en déduire à propos de son pH ? Justifiez ? Ra / 3
G·MSUqV OH PMNOHMX ŃL-dessus, je sais que le vert de bromocrésol vire au bleu lorsque le pH de la
solution testée est supérieur à 5,4B -·Hn GpGXLV TXH OH S+ GH O·HMX 3HUULHU est supérieur à 5,4.
G·MSUqV OH PMNOHMX ŃL-dessus, je sais que le rouge de phénol vire au jaune lorsque le pH de la
solution testée est inférieur à 6,8B -·HQ GpGXLV TXH OH S+ GH O·HMX 3HUULHU HVP LQIpULHXU j 68B
G·MSUqV ces deux observations Ó·HQ GpGXLV TXH OH S+ GH O·eau de Perrier est compris entre 5,4
et 6,8.b) Cette solution est-elle acide, basique ou neutre ? MCo / 0,5
-H VMLV TX·XQH VROXPLRQ HVP acide lorsque son pH est inférieur à 7 Ó·HQ GpGXLV TXH O·HMX GH
Perrier qui a un pH inférieur à 6,8 est une solution acide.r IH S+ G·XQ ÓXV GH SRPPH YMXP 4,2B 2Q \ MÓRXPH XQH JUMQGH TXMQPLPp G·HMX SRXU OH GLOXHUB
a) Comment va évoluer son pH ? MCo / 1,5
IRUVTX·RQ GLOXH XQH VROXPLRQ VRQ S+ VH UMSSURŃOH GH 7 ; le pH du jus de pomme va donc augmenter. b) Question bonus : si on verse quelques gouttes de bleu de bromothymol dans le jus avant etMSUqV GLOXPLRQ ŃRPPHQP YM pYROXHU OM ŃRXOHXU GH O·LQGLŃMPHXU ŃRORUpB Ra / 2
G·MSUqV OH PMNOHMX ŃL-dessus, je sais que le bleu de bromothymol vire au jaune lorsque le pH de
la solution testée est inférieur à 6. Le pH dX ÓXV GH SRPPH HVP GH 4B2 MYMQP OM GLOXPLRQ Ó·HQ
déduis que le bleu de bromothymol sera jaune. Après une grande dilution, le pH du jus de pomme sera de 7 ce qui correspond à la zone de virage du bleu de bromothymol qui sera alors entre le bleu et le jaune c'est-à-dire vert. Indicateur coloré Couleur Intervalle de pH de la zone de virage CouleurHélianthine rouge 3,10 - 4,40 jaune
Vert de bromocrésol jaune 3,80 - 5,40 bleu
Bleu de bromothymol jaune 6,00 ² 7,60 bleu
Rouge de phénol jaune 6,80 ² 8,40 rouge
Phénolphtaléine incolore 8,30 ² 10,00 fuchsia sujet B - CorrectioNAide pour les exercices 1 et 2 :
n Le professeur a donné à Berthe une solution inconnue Y, deux tubes à essai, de la soude (Na+
HO- HP GX QLPUMPH G·MUJHQP $J+ NO3). Elle réalise des expériences et obtient les résultats
suivants :9 Un précipité vert dans le tube où elle a versé la solution Y et la soude,
9 Un précipité blanc qui noircit à la lumière où elle a versé la solution Y HP OH QLPUMPH G·MUJHQPB
a) 4XHO HVP O·LRQ négatif contenu dans la solution ? Justifier. I / 2
b) 4XHO HVP O·MXPUH LRQ ŃRQPHQX GMQV OM VROXPLRQ ? Justifier I / 2
Je sais que lvert fer II, Fe2+
des ions fer II dans la solution Y. c) Trouvez le nom de la solution Y Ń·HVP du chlorure de fer II. Ra / 1o Alfred a devant lui deux tubes à essai O·XQ ŃRQPLHQP GX ŃOORUXUH GH ŃXLYUH HP O·MXPUH GX
chlorure de fer IIHB 6ŃOpPMPLVHU HP OpJHQGHU OHV H[SpULHQŃHV TX·Ll doit réaliser pour différencier
ces deux solutions ainsi que ses observations.Ra / 4 Ré / 2
Ch.4 CD D 0C ]0C4 ² évaluation
Ion Chlorure
Cl-Cuivre
Cu2+Fer II
Fe2+Fer III
Fe3+ Zinc Zn2+Aluminium
Al3+Réactif
Solution de nitrate
(Ag+ et NO3)Précipité
Hydroxyde de sodium (soude)
(Na+ HO-) Blanc qui noircit à la lumière Blanc Blanc Bleu Vert Orangé SoudeSolution
à tester
Je sais que la soude forme un précipité bleu avec les ions cuivre et un précipité orange avec les ions fer III. Si Alfred observe un précipité bleu LO SRXUUM ŃRQŃOXUH TX·il y a des ions cuivre dans la solution testée ; ce sera donc la solution de chlorure de cuivreB 6·LO RNVHUYH XQ SUpŃLSLPp orange LO SRXUUM ŃRQŃOXUH TX·LO \ M GHV ions fer III dans la solution testée ; ce sera donc la solution de chlorure de fer III. HO HVP LQXPLOH GH UpMOLVHU OH PHVP MX QLPUMPH G·MUJHQP SXLVTXH GMQV OHV GHX[ solutions il y a des ions chlorure ; dans les deux cas, il se formera un précipité blanc qui ne nous permettra pas de différencier les deux solutions.Aide pour les exercices 3 et 4 :
p On veut déterminer le pH du SchweppesB 2Q VMLP TXH ORUVTXH O·RQ YHUVH TXHOTXHV JRXPPHV Gquotesdbs_dbs44.pdfusesText_44
[PDF] acide sulfanilique
[PDF] pourquoi peut-on affirmer qu'une mcv est une maladie sociale
[PDF] bleu de bromothymol
[PDF] maladie incidence sociale définition
[PDF] maladies sociales
[PDF] bbt
[PDF] liste maladie rare
[PDF] interpretation graphique d'une equation
[PDF] rouge de crésol zone de virage
[PDF] zone de virage rouge de méthyle
[PDF] zone de virage alizarine
[PDF] zone de virage bleu de thymol
[PDF] zone de virage pka
[PDF] zone de virage bbt
