 AE 10 : Test didentification de leau et du CO2
AE 10 : Test didentification de leau et du CO2
Il s'agit d'une solution saturée de chaux. De nature incolore ete limpide. Toutefois la solution se trouble en présence de dioxyde de carbone
 Tests didentification de certaines espèces chimiques
Tests didentification de certaines espèces chimiques
Tests d'identification de certaines espèces chimiques Protocole du test ... Il se forme des goutellettes d'eau dans le tube. Dioxyde de carbone.
 2.1.Les boissons pétillantes contiennent du dioxyde de carbone
2.1.Les boissons pétillantes contiennent du dioxyde de carbone
2.1.Les boissons pétillantes contiennent du dioxyde de carbone. (voir aussi le test d'identification du dioxyde de carbone leçon 6 paragraphe 2.2).
 Traiter les quatre exercices suivants.
Traiter les quatre exercices suivants.
Des échanges gazeux de dioxygène (O2) et de dioxyde de carbone (CO2) ont lieu entre l'air alvéolaire Le test de Fehling permet d'identifier les sucres.
 Physique Chimie
Physique Chimie
Feb 8 2017 Identification d'une espèce chimique . 118. Chapitre 11. ... doc.3 Test d'identi ication du dioxyde de carbone tube à essai.
 ANNEXES : TEST DIDENTIFICATION DES GAZ ET DES IONS
ANNEXES : TEST DIDENTIFICATION DES GAZ ET DES IONS
Gaz. Dioxyde de carbone dioxygène dihydrogène réactifs. Eau de chaux allumette flamme. Observations. Eau de chaux se trouble en blanc.
 Reconnaître la présence dune substance chimique
Reconnaître la présence dune substance chimique
est du dioxyde de carbone. Dihydrogène. H2. Test à la flamme. Rapprocher une allumette enflammée de l'ouverture du récipient contenant le gaz à tester.
 Test didentification
Test didentification
Test d'identification des ions fer II : En présence d'ions hydroxyde HO - Test d'identification du dioxyde de carbone : Le dioxyde de carbone (CO2) ...
 La combustion du méthane
La combustion du méthane
Le butane est composé de quatre atomes de carbone et de dix atomes d'hydrogène. 2. Formule: C4H10 . 3. Les produits sont l'eau et le dioxyde de carbone. 4. Test
 Partie 1 : On souhaite identifier le gaz diffusé et expliquer lintérêt
Partie 1 : On souhaite identifier le gaz diffusé et expliquer lintérêt
En chimie on réalise des tests qui permettent d'identifier des gaz inodores une consommation de dioxyde de carbone (CO2) et un rejet de dioxygène (O2).
 Le test de reconnaissance du dioxyde de carbone
Le test de reconnaissance du dioxyde de carbone
C'est un test qui permet de déterminer si un gaz est constitué de dioxyde de carbone Ce test est aussi appelé test à l'eau de chaux
 [PDF] AE 10 : Test didentification de leau et du CO2
[PDF] AE 10 : Test didentification de leau et du CO2
– test à l'eau de chaux qui se trouble en présence de dioxyde de carbone – Test au sulfate de cuivre anhydre qui se colore en bleu en présence d'eau
 [PDF] Tests didentification de certaines espèces chimiques
[PDF] Tests didentification de certaines espèces chimiques
Tests d'identification de certaines espèces chimiques Protocole du test Il se forme des goutellettes d'eau dans le tube Dioxyde de carbone
 [PDF] Annexe 1 : Test didentification des gaz - Collège Les Hautes Rayes
[PDF] Annexe 1 : Test didentification des gaz - Collège Les Hautes Rayes
Gaz Dioxyde de carbone dioxygène dihydrogène réactifs Eau de chaux allumette flamme Observations Eau de chaux se trouble en blanc
 [PDF] utiliser les tests de reconnaissance - Physique-Chimie
[PDF] utiliser les tests de reconnaissance - Physique-Chimie
2) Pour le dioxyde de carbone: Quel est le détecteur pour identifier le dioxyde de carbone? Que se passe-t-il si on met ce détecteur en présence de dioxyde de
 [PDF] Les tests de reconnaissance
[PDF] Les tests de reconnaissance
1) Le test de reconnaissance du dioxyde de carbone Pour identifier le dioxyde de carbone on utilise l'eau de chaux Protocole : A l'aide d'un tuyau
 [PDF] FICHE METHODE test didentification des 3 gaz connu en 3ème
[PDF] FICHE METHODE test didentification des 3 gaz connu en 3ème
5 Identifier des gaz Test d'identification du dioxyde de carbone Verser de l'eau de chaux dans le flacon contenant le gaz à identifier
 [PDF] TP C2 Tests chimiques - Labo TP
[PDF] TP C2 Tests chimiques - Labo TP
dioxyde de carbone Document 2 : Informations sur les espèces chimiques utilisées lors de ce TP - solution d'acide chlorhydrique
 [PDF] Dioxyde de carbone
[PDF] Dioxyde de carbone
dioxyde de carbone est un gaz incolore inodo- La carboglace utilisée dans un test d'ir- Numéro d'identification de la matière : 1013
 [PDF] Partie 1 : On souhaite identifier le gaz diffusé et expliquer lintérêt
[PDF] Partie 1 : On souhaite identifier le gaz diffusé et expliquer lintérêt
En chimie on réalise des tests qui permettent d'identifier des gaz inodores une consommation de dioxyde de carbone (CO2) et un rejet de dioxygène (O2)
Quels sont les tests d'identification du dioxyde de carbone ?
Le test de l'eau de chaux permet d'identifier la présence de dioxyde de carbone (CO2) dans un récipient.Comment détecter la présence de dioxyde de ?
On plonge la buchette incandescente dans le tube à essai contenant le gaz à tester. Si la flamme de la buchette se ravive, alors le gaz contient du dioxygène. Si elle ne se ravive pas, alors il n'y a pas de dioxygène ou trop peu pour raviver la flamme.Comment Peut-on mettre en évidence la présence de dioxyde de carbone ?
2.1.
Une personne souffle à l'aide d'une paille dans l'eau de chaux contenue dans dans le premier verre. On introduit, dans un autre verre contenant de l'eau de chaux, un glaçon de carboglace, afin de dégager rapidement une grande quantité de dioxyde de carbone.- dioxygène On place au contact du gaz à tester un bâtonnet avec un point incandescent. Si le gaz est du dioxygène, alors le bâtonnet s'enflamme. incolore appelé « eau de chaux » Si le gaz est du dioxyde de carbone, alors l'eau de chaux se trouble.
 Groupe Collège 2009 Ȃ 2010 Académie de Créteil Page 1
Groupe Collège 2009 Ȃ 2010 Académie de Créteil Page 1 La combustion du méthane
Je me souviens
Le réactif
Le produit
Les formules du dioxygène : O2 , dioxyde de carbone : CO2, eau : H2O et méthane : CH4. Une transformation chimique peut être traduite par une équation de réaction où apparaissent réactifs et produits.Du test de reconnaissance du dio
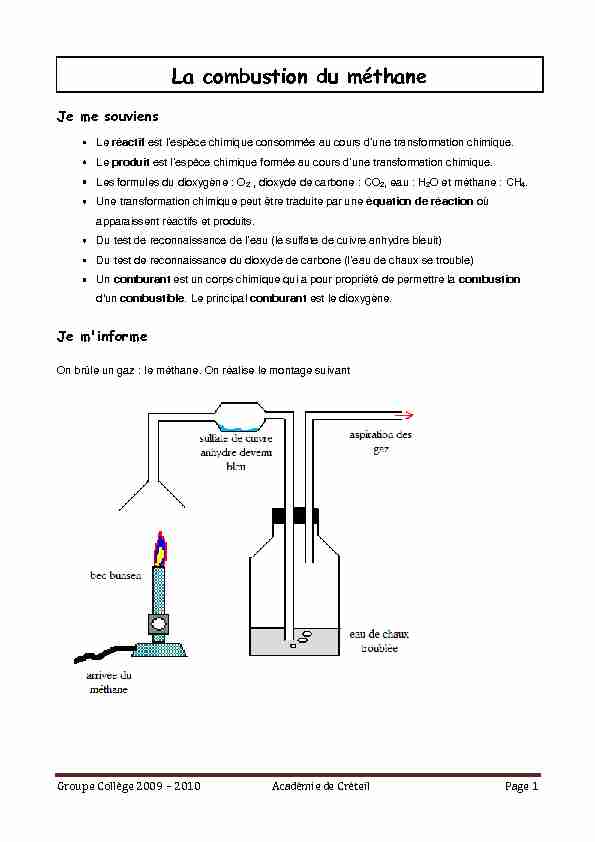
Un comburant est un corps chimique qui a pour propriété de permettre la combustion d'un combustible. Le principal comburant est le dioxygène.Je m'informe
On brûle un gaz : le méthane. On réalise le montage suivant Groupe Collège 2009 Ȃ 2010 Académie de Créteil Page 2Je réponds aux questions
1. Dans cette combustion, quel est le combustible ?
2. Dans cette combustion, quel est le comburant ?
3. ? cette question utiliser les mots ou groupe de mots5. Compléter :
Les réactifs sont le _______________ et le ___________________Les produits sont
6. Compléter en toutes lettres:
________________ + ________________ AE ___________ __ _________ + _______7. Consulter votre livre ou le site http://rihetperez.free.fr/dmenu4.html puis compléter le
tableau ci-dessous en représentant les atomes de carbone C, H et O avec le modèle moléculaire (sphères colorées) correspondant:Atome Modèle Atome Modèle Atome Modèle
C H O Faire de même pour les molécules de dioxygène O2, de dioxyde de carbone CO2,H2O et de méthane CH4.
Molécule Modèle Molécule Modèle Molécule Modèle Molécule ModèleO2 CO2 H2O CH4
Groupe Collège 2009 Ȃ 2010 Académie de Créteil Page 3 Lavoisier a dit " Rien ne se perd, rien ne se crée, tout se transforme8. Ecrire le bilan avec les modèles moléculaires (question 8) en respectant la conservation
des atomes. + """"B AE """"B Ą """"B """"B9. Combien faut-il de molécules de dioxygène
méthane?10. Combien faut-il de moléc
méthane?11. Ajuster chimique de la combustion du méthane en complétant les pointillés par
le nombre correct.CH4 + "" O2 AE CO2 Ą ""H2O
Je vérifie
1. Le combustible est le méthane.
2. Le co
3. 4.5. Les réactifs sont le méthane et le dioxygène
Les6. méthane + dioxygène AE dioxyde de carbone + eau
7. Modèle moléculaire de quelques atomes :
Atome Modèle Atome Modèle Atome Modèle
C H O
Groupe Collège 2009 Ȃ 2010 Académie de Créteil Page 48. Modèle moléculaire de quelques molécules :
Molécule Modèle Molécule Modèle Molécule Modèle Molécule ModèleO2 CO2 H2O CH4
9. : + AE +Justification :
- Il y a un atome de carbone dans les réactifs, et un dans les produits. La conservation en atome de carbone est respectée. - le dioxyde de de dioxygène (2×2=4).10. Il faut donc 2 molécules de dioxygène
11.12. :
CH4 + 2 O2 AE CO2 + 2 H2O
Je retiens
Cette partie est à recopier / imprimer sur le cahier / classeurLorsque du méthane brûle, deux corps sont consommés : le méthane (combustible) et le
dioxygène (comburant). Deux corps nouveaux se forment : le dioxyde de carbone, mis en uivre anhydre. Les réactifs sont : le méthane et le dioxygène méthane + dioxygène AE dioxyde de carbone + eauCH4 + 2 O2 AE CO2 + 2 H2O
Groupe Collège 2009 Ȃ 2010 Académie de Créteil Page 5Je m'entraîne
Exercice 1 : Combustion du butane
1. utane.
2. Proposer une formule pour représenter la molécule de butane.
3. La combustion du butane donne les mêmes produits que la combustion du méthane. Quels
sont ces produits ? 4.5. Ecrire le bilan de la réaction en toute lettre.
6. chimique de cette réaction et
Exercice 2 : Combustion du butène
Soit la combustion du but-2-ène :
C4H8 + 6 O2 AE 4CO2 + 4 H2O
1. Quels sont les réactifs (noms) ?
2. Quels sont les produits (noms) ?
3. Combien y a-t-atomes de carbone dans les réactifs ydrogène ?
4. Combien y a-t-atomes de carbone dans les produits ? gène
5. Que constatez-vous ?
Groupe Collège 2009 Ȃ 2010 Académie de Créteil Page 6Correction
Exercice 1 : Combustion du butane
1. Le butane est composé de quatre atomes de carbone et de dix atomes d'hydrogène.
2. Formule: C4H10 .
3. Les produits sont l'eau et le dioxyde de carbone.
4. Test de reconnaissance de l'eau: le sulfate de cuivre anhydre bleuit.
Test de reconnaissance du dioxyde de carbone: L'eau de chaux se trouble.5. Butane + Dioxygène AE Eau + Dioxyde de carbone.
6. combustion du butane:
C5H10 + 8 O2 AE 5 CO2 + 6 H2O
Exercice 2 : Combustion du butène
1. Les réactifs sont le but-2-ène et le dioxygène.
2. Les produits sont l'eau et le dioxygène.
3. Il y a 4 atomes de carbone, 8 atomes d'hydrogène et 12 atomes d'oxygène dans
les réactifs.4. Il y a 4 atomes de carbone, 8 atomes d'hydrogène et 12 atomes d'oxygène dans
les produits.5. L'équation de réaction respecte la conservation des atomes.
quotesdbs_dbs30.pdfusesText_36[PDF] décomposition de l'eau oxygénée corrigé
[PDF] decomposition de l'eau oxygénée chimie
[PDF] l'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène
[PDF] tp etude cinétique de la décomposition de l'eau oxygénée
[PDF] équation de la réaction chimique qui modélise la décomposition de l'eau oxygénée
[PDF] cinétique de décomposition de l'eau oxygénée
[PDF] concentration eau oxygénée 10 volumes
[PDF] eau oxygénée permanganate de potassium
[PDF] modélisation de la transformation chimique
[PDF] exercice de chimie des solutions
[PDF] chimie analytique 2eme annee pharmacie
[PDF] cours chimie analytique pdf
[PDF] exercices de chimie analytique livre gratuit
[PDF] exercice chimie analytique pharmacie
