 Chimie 2009 sujet2
Chimie 2009 sujet2
Masse molaire de l'acide salicylique : MHA = 138 g.mol. – 1. Masse volumique de la solution pharmaceutique : ?S = 950 kg.m.
 Exercice 1 (7 points) Etude cinétique de loxydation dun alcool
Exercice 1 (7 points) Etude cinétique de loxydation dun alcool
Données : Masse volumique du propan-2-ol : ?(C3H8O) = 079 g.mL-1. Masse molaire de l'acide salicylique est M = 138 g.mol-1. 1. Comportement de l'acide ...
 Procédure expérimentale
Procédure expérimentale
Le choix des composés organiques a été orienté sur des acides aromatiques Masse molaire = 126.11. Acide gallique ... Acide salicylique. Masse molaire = ...
 RENSEIGNEMENTS STATISTIQUES
RENSEIGNEMENTS STATISTIQUES
L'acide salicylique (ou acide 2-hydroxybenzoïque) Sa masse molaire est de 138 g.mol-1 . ... Masse molaire de l'acide salicylique M = 138 g.mol-1.
 Synthèse et analyse
Synthèse et analyse
Température d'ébullition sous pression normale : 1364°C. • Soluble dans l'eau et l'éthanol. Acide salicylique. • Masse molaire : 138 g.mol-1.
 1. Spectroscopie UV-visible Chapitre 04 Analyse spectrale
1. Spectroscopie UV-visible Chapitre 04 Analyse spectrale
chimique est proportionnelle à sa concentration molaire à condition que la solution Acide salicylique. • Masse molaire : 138 g.mol-1. • Solide blanc.
 BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
Masse molaire Masse volumique Formule développée. Acide L'acide salicylique réagit avec le méthanol pour former du salicylate de méthyle et un.
 TP21 La chimie de la synthèse de laspirine
TP21 La chimie de la synthèse de laspirine
Acide salicylique. Anhydride éthanoïque. (ou anhydride acétique). Aspect. Solide blanc. Liquide incolore d'odeur piquante. Formule brute. Masse molaire.
 DS_4_Quantité de matière
DS_4_Quantité de matière
Calculer la masse molaire moléculaire de la molécule d'acide lactique. La dose maximale recommandée est de 25x10-2 mol d'acide salicylique par jour.
 ASPIRINE ET PREVENTION CARDIOVASCULAIRE
ASPIRINE ET PREVENTION CARDIOVASCULAIRE
Acide salicylique. • Masse molaire : 138 g.mol-1. • Solide blanc L'aspirine peut être synthétisée à partir d'acide salicylique et d'anhydride éthanoïque ...
 Acide salicylique - Wikipédia
Acide salicylique - Wikipédia
Masse volumique 1443 g·cm-3 (20 °C /4 °C ) ; T° d'auto-inflammation 540 °C ; Point d'éclair 157 °C (coupelle fermée) ; Pression de vapeur saturante 00 Pa (20
 Acide salicylique CAS 69-72-7 100631 - Merck Millipore
Acide salicylique CAS 69-72-7 100631 - Merck Millipore
MDA_CHEM-100631.pdf
 [PDF] ACIDE SALICYLIQUE - SORDALAB
[PDF] ACIDE SALICYLIQUE - SORDALAB
ACIDE SALICYLIQUE / 151045 ACIDE SALICYLIQUE Poids moléculaire : 138 12 g/mol N° CAS: 69-72-7 Masse volumique apparente 800 kg/m3
 [PDF] Fiche de Données de Sécurité: Acide salicylique - Carl Roth
[PDF] Fiche de Données de Sécurité: Acide salicylique - Carl Roth
RUBRIQUE 3: Composition/informations sur les composants 3 1 Substances Nom de la substance Acide salicylique Formule moléculaire C?H?O? Masse molaire
 Acide salicylique - scienceamusantenet
Acide salicylique - scienceamusantenet
27 mai 2014 · Masse molaire : 13812 g/mol · Température d'ébullition : 211°C · Température de fusion : 158-161°C · Point éclair en coupelle fermée : 157°C
 [PDF] TP – Un bonbon à laspirine - Physique Chimie Dijon
[PDF] TP – Un bonbon à laspirine - Physique Chimie Dijon
COMPETENCES ATTENDUES : Calculer une masse molaire moléculaire à partir des masses Pour synthétiser l'aspirine il faut de l'acide salicylique et de
 [PDF] Lacide salicylique prévient la liaison de lendothéline-i - Papyrus
[PDF] Lacide salicylique prévient la liaison de lendothéline-i - Papyrus
Ces cellules constituent de 70 à 80 de la masse du coeur adulte Les myocytes du ventricule adulte ont été utilisées pour délinéer la signalisation des
 [PDF] Chimie 2009 sujet2
[PDF] Chimie 2009 sujet2
Formule brute de l'acide salicylique : C7H6O3 = HA Masse molaire de l'acide salicylique : MHA = 138 g mol – 1 Masse volumique de la solution
 [PDF] Chimie DS n°5
[PDF] Chimie DS n°5
Dosage de l'acide salicylique dans le Synthol ® 2 1 La masse d'acide salicylique contenue dans 100 g de solution est m = 00105 g La masse d'acide
 153
153152
Les espèces chimiques interagissent avec les rayonnements électromagnétiques. Ils les absorbent ou les émettent de façon plus ou moins intense selon leur longueur d'onde. L'analyse spectrale consiste en l'étude de l'intensité du rayonnement absorbé ou émis en fonction de sa longueur d'onde. La courbe (?gure 1) qui représente l'intensité du rayonnement absorbé en fonction de sa longueur d'onde s'appelle spectre d'absorption. La technique qui nous permet d'eectuer cette étude s'appelle spectroscopie et elle est réalisée avec un appareil qui s'appelle spectrophotomètre.
6600,20,40,60,81,0
2003004006005007001000m en nmm
A m max = 660 nm A Fig. 1 Spectre d'absorption d'une solution de bleu de méthylène.1. Spectroscopie UV-visible1.1. Principe
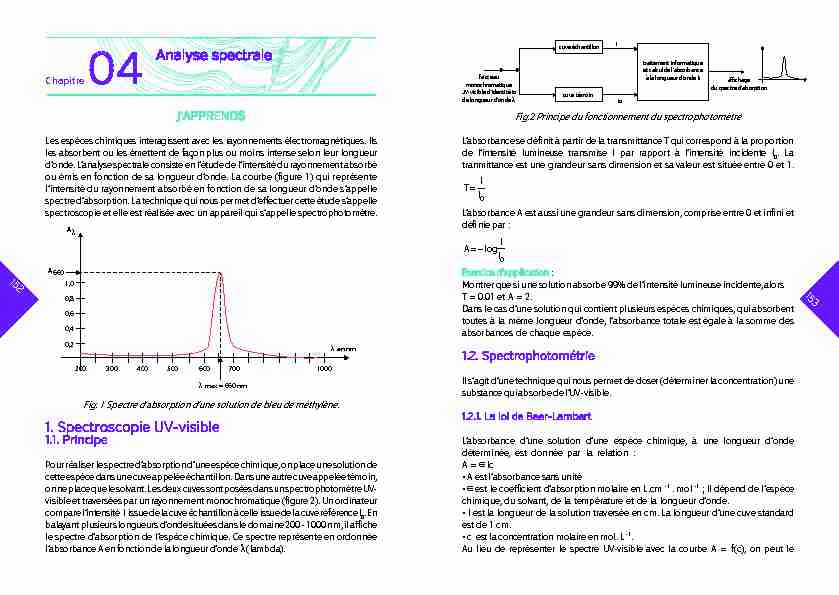
Pour réaliser le spectre d'absorption d'une espèce chimique, on place une solution de cette espèce dans une cuve appelée échantillon. Dans une autre cuve appelée témoin, on ne place que le solvant. Les deux cuves sont posées dans un spectrophotomètre UV- visible et traversées par un rayonnement monochromatique (?gure 2). Un ordinateurcompare l'intensité I issue de la cuve échantillon à celle issue de la cuve référence I
0 . En balayant plusieurs longueurs d'onde situées dans le domaine 200 - 1000 nm, il ache le spectre d'absorption de l'espèce chimique. Ce spectre représente en ordonnée l'absorbance A en fonction de la longueur d'onde (lambda).J'APPRENDSChapitre 04
Analyse spectralecuve échantillon
cuve témoin faisceau monochromatiqueUV-visible d'identité I
o de longueur d'onde mtraitement informatique et calculde l'absorbanceà la longueur d'onde
m achage du spectre d'aborption I I o Fig.2 Principe du fonctionnement du spectrophotomètre L'absorbance se dé?nit à partir de la transmittance T qui correspond à la proportion de l'intensité lumineuse transmise I par rapport à l'intensité incidente I 0 . La tranmittance est une grandeur sans dimension et sa valeur est située entre 0 et 1. T= I I 0 L'absorbance A est aussi une grandeur sans dimension, comprise entre 0 et infini et dé?nie par : A=log I I0Exercice d'application :
Montrer que si une solution absorbe 99% de l'intensité lumineuse incidente, alorsT = 0.01 et A = 2.
Dans le cas d'une solution qui contient plusieurs espèces chimiques, qui absorbent toutes à la même longueur d'onde, l'absorbance totale est égale à la somme des absorbances de chaque espèce.1.2. SpectrophotométrieIl s'agit d'une technique qui nous permet de doser (déterminer la concentration) une
substance qui absorbe de l'UV-visible.1.2.1. La loi de Beer-LambertL'absorbance d'une solution d'une espèce chimique, à une longueur d'onde
déterminée, est donnée par la relation : A =lc A est l'absorbance sans unité
est le coe?cient d'absorption molaire en L.cm
-1 . mol -1 ; Il dépend de l'espèce chimique, du solvant, de la température et de la longueur d'onde. l est la longueur de la solution traversée en cm. La longueur d'une cuve standard est de 1 cm. c est la concentration molaire en mol. L
-1 Au lieu de représenter le spectre UV-visible avec la courbe A = f(c), on peut le 155154
représenter aussi avec la courbe qui illustre les variations du coe?cient d'absorption molaire en fonction de la longueur d'onde.
1.2.2. Dosage d'une solution par étalonnage
La loi de Beer-Lambert nous montre que l'absorbance d'une solution d'une espèce chimique est proportionnelle à sa concentration molaire à condition que la solution soit susamment diluée.A = lc ou A = kc ou k =
Le coecient de proportionnalitquotesdbs_dbs29.pdfusesText_35[PDF] tp de chimie minérale 2eme année sm
[PDF] tp de chimie 1er année st
[PDF] compte rendu de tp chimie preparation des solutions pdf
[PDF] telecharger livre chimie organique gratuit pdf
[PDF] paul arnaud chimie organique 18e edition
[PDF] paul arnaud chimie organique exercices résolus
[PDF] telecharger paul arnaud chimie organique pdf
[PDF] chimie générale exercices corrigés
[PDF] chimie minérale exercices corrigés s3
[PDF] chimie inorganique cours l2
[PDF] chimie minérale 1ère année
[PDF] chimie inorganique exercices corrigés
[PDF] electroneutralité formule
[PDF] comment verifier l'electroneutralité d'une solution
