 V Etude rigoureuse des solutions acides et basiques
V Etude rigoureuse des solutions acides et basiques
Equation 38 : Condition d'électroneutralité d'une solution Compte tenu de la précision des mesures vérifier
 THÈME : CHIMIE GÉNÉRALE TITRE DE LA LEÇON : SOLUTIONS
THÈME : CHIMIE GÉNÉRALE TITRE DE LA LEÇON : SOLUTIONS
connaître quelques propriétés de l'eau de vérifier l'électroneutralité d'une solution aqueuse
 Université de MSila 9/01/2021 Faculté des sciences. Département
Université de MSila 9/01/2021 Faculté des sciences. Département
Jan 9 2021 de perchlorate de magnésium. Calculer la concentration de chaque ion dans la solution finale. Vérifier l'électroneutralité de la solution.
 Chimie CLASSE DE 1ère S Vers la Terminale S
Chimie CLASSE DE 1ère S Vers la Terminale S
Calculer la concentration molaire effective de chacun des ions présents dans la solution. c. Vérifier l'électro neutralité de la solution. Exercice 5
 PHYSIQUE-CHIMIE
PHYSIQUE-CHIMIE
Electroneutralité de la solution : 2 [ . 2+] = 2 × 18 = 3
 UNIVERSITE P
UNIVERSITE P
c) Calculer le pH d'une solution de fluorure de sodium (NaF) de concentration. C2 = 10-1 mol L-1. Vérifier les approximations utilisées. pH=½ (pKa +pKe + log C2)
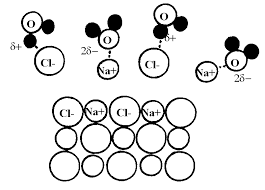 Fiche 4 : Les composés ioniques
Fiche 4 : Les composés ioniques
Pour respecter l'électroneutralité : 1 ion chlorure (charge (-)) s'associe avec 1 ion sodium (charge (+)) : 1(-) + 1(+) = 0. Cela forme le solide ionique : NaCl
 UNIVERSITE P
UNIVERSITE P
c) Calculer le pH d'une solution de fluorure de sodium (NaF) de concentration. C2 = 10-1 mol L-1. Vérifier les approximations utilisées. pH=½ (pKa +pKe + log C2)
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
Feb 6 2010 1.2 Voir §4.1 du chapitre 12. ... On complète ensuite au trait de jauge avec de l'eau distillée. Exercice 5 : Électroneutralité et écriture d'une ...
 Interprétation dune gazométrie
Interprétation dune gazométrie
Nov 22 2011 La loi de l'électro-neutralité des solutions. 22. 6ème journée SIAMU ... une solution aqueuse exposée à. ❑ Pa Co. 2 constante. ❑ Ions fortement ...
 V Etude rigoureuse des solutions acides et basiques
V Etude rigoureuse des solutions acides et basiques
Equation 38 : Condition d'électroneutralité d'une solution de la précision des mesures vérifier
 Solutions tampons
Solutions tampons
solutions telles que la relation classiquement établie est vérifiée le pH ne dépend d'ailleurs pas d'électroneutralité
 L1 SVST réaction chim TD sept 2021
L1 SVST réaction chim TD sept 2021
Rappeler la définition de l'électro-neutralité d'une solution aqueuse ionique. 4. Vérifier l'électro-neutralité de la solution préparée.
 35 1. Les différents sels sont : NaCl KCl et MgCl2 . Donc
35 1. Les différents sels sont : NaCl KCl et MgCl2 . Donc
https://lycee.editions-bordas.fr/9782047336786/assets/chapitre-3-corrige-de-lexercice-35-2/preview
 ENSEIGNEMENT SCIENTIFIQUE PREMIERE PARTIE 1 UNE
ENSEIGNEMENT SCIENTIFIQUE PREMIERE PARTIE 1 UNE
Vérifier l'électro neutralité du cristal. Les entités sont des ions. Il y a autant d'ions sodium que d'ions Chlorure : le cristal est électriquement.
 Module CHIM 102A : DS n°1 (durée : 1 heure)
Module CHIM 102A : DS n°1 (durée : 1 heure)
3) Rappeler la définition de l'électroneutralité d'une solution aqueuse 4) Pour les ions de cette eau minérale l'électroneutralité est-elle vérifiée ?
 pH et équilibres acido-basiques en solution aqueuse
pH et équilibres acido-basiques en solution aqueuse
d'exprimer et de vérifier les équations de conservation de matière (des espèces) et d'électroneutralité pour ces solutions ;.
 Cours et exercices de chimie des solutions
Cours et exercices de chimie des solutions
L'éléctroneutralité d'un mélange de composés ioniques en solution traduit le Vérifier que la réaction de l'acide éthanoïque sur l'eau n'est pas totale.
 SOLUTIONS AQUEUSES IONIQUES
SOLUTIONS AQUEUSES IONIQUES
Électro neutralité d'une solution aqueuse C'est l'équation de l'électroneutralité de la solution ... 2.3-Vérifie l'électroneutralité du mélange.
 [PDF] V Etude rigoureuse des solutions acides et basiques
[PDF] V Etude rigoureuse des solutions acides et basiques
Compte tenu de la précision des mesures vérifier si l'électroneutralité de cette solution est vérifiée (condition de conservation de la matière) 5 4 Ecrire
 solution
solution
Remarque : dans la solution ily a des ions Ca2+ et des ions Cl- venant du La solution est neutre l'équation d'électro-neutralité qui traduit ce fait
 Solutions
Solutions
On voit qu'il y a autant de H3O+ que de OH- ce qui traduit l'électroneutralité de la solution Ainsi à 25 °C : [H3O+] = [OH-]= 10-7 mol l-1
 [PDF] SOLUTIONS AQUEUSES NOTION DE pH
[PDF] SOLUTIONS AQUEUSES NOTION DE pH
quelques propriétés de l'eau de vérifier l'électroneutralité d'une solution aqueuse de déterminer le pH de solutions aqueuses et de les classer
 [PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
[PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Comment prélève t on le volume V0 de la solution mère b Quelle est la concentration de la solution fille ? c Calculer le facteur de dilution F effectué
 [PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
[PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
Force des acides et des bases 1 5 Constantes d'acidité et de basicité 1 6 Coefficient de dissociation d'un acide faible : 2 CALCUL DE PH DES SOLUTIONS
 [PDF] pH et équilibres acido-basiques en solution aqueuse
[PDF] pH et équilibres acido-basiques en solution aqueuse
d'exprimer et de vérifier les équations de conservation de matière (des espèces) et d'électroneutralité pour ces solutions ;
 [PDF] Stéphane Mathé - Dunod
[PDF] Stéphane Mathé - Dunod
L'électroneutralité de la solution 25 5 Le bilan matière 26 6 La résolution d'un problème de chimie des solutions 28 6 1 Identifier les inconnues du
 [PDF] Lélectroneutralité des solutions
[PDF] Lélectroneutralité des solutions
L'électroneutralité des solutions Comment les solutions ioniques sont-elles toujours fournit en solution aqueuse des ions sodium Na+ et des ions
 [PDF] chimie-des-solutions-examens-corrigés-06pdf - F2School
[PDF] chimie-des-solutions-examens-corrigés-06pdf - F2School
4- Si les approximations sont vérifiées comment s'exprimera le pH de la solution en fonction du pKa pKe et de Co? 16-1- Une solution (A) contient 85 g
Comment vérifier l Electroneutralité de la solution ?
On parle d'électroneutralité pour la matière lorsque la somme des concentrations des esp?s chargées positivement est égale à la somme des concentrations des esp?s chargées négativement.Qu'est-ce que l Électroneutralité d'une solution ?
Il faut que le nombre de charges positives soit identique au nombre de charges négatives. Quelques exemples : Chlorure de fer II : +2 (l'ion fer II possédant 2 charges +, il faut prendre 2 ions chlorure, chaque ion chlorure ayant 1 seule charge -).Comment calculer la neutralité d'une solution ?
Si le pH est compris entre 0 et 7, on a une solution acide. Si le pH vaut 7, on a une solution neutre. Si le pH est compris entre 7 et 14, on a une solution basique ou alcaline.
Chapitre V 67
V Etude rigoureuse des solutions acides et basiquesSir Isaac Newton ( 1642 - 1727 )
a. Condition d"électroneutralité .... 68 b. Condition de conservation de la matière .... 69 c. Exemples de traitement mathématique et informatique .... 70 d, Exercices .... 73Acides et bases
Chapitre V 68
Etude rigoureuse des solutions
acides et basiques a) La condition d"électroneutralité On peut se rendre compte (par exemple à l"aide d"un électroscope) que toute solution estélectriquement neutre: Dans un litre de solution, le nombre de moles de charges élémentaires
positives est donc égal au nombre de moles de charges élémentaires négatives :Exemples:
1) Solution de chlorure de sodium:
charges + portées par Na + et H3O+ (provenant de l"autoprotonation de l"eau ) charges - portées par Cl - et OH- (provenant de l"autoprotonation de l"eau )Condition d"électroneutralité: [Na
+] + [H3O+] = [Cl-] + [OH-]2) Solution d"acide chlorhydrique:
charges + portées par H3O+ (provenant de l"autoprotonation de l"eau et de l"ionisation de l"acide)
charges - portées par Cl - (provenant de l"ionisation de HCl) et OH- (provenant de l"autoprotonation de l"eau)Condition d"électroneutralité: [H
3O+] = [Cl-] + [OH-]
3) Solution de chlorure de calcium:
charges + provenant de Ca2+ (chaque mole apporte deux moles de charges élémentaires + !!) et de H3O+ (provenant de
l"autoprotolyse de l"eau) charges - provenant de Cl - et de OH-Condition d"électroneutralité: 2 [Ca
2+] + [H3O+] = [Cl-] + [OH-]
Attention au dernier exemple! Chaque mole d"ions calcium porte deux moles de charges élémentaires
positives. Le nombre de charges élémentaires positives dans un volume donné est donc le double du nombre
de moles d"ions calcium !Comparaison:
Deux personnes constatent qu"elles ont dans leur porte-monnaie la même somme d"argent, l"une en pièces
de 5 et 1 francs, l"autre en pièces de 20 et 50 francs. Somme d"argent de la première = Somme d"argent de la deuxième(Nombre de pièces de 5) fois 5 + (nombre de pièces de 1) fois 1 = (nombre de pièces de 20) fois 20 +
(nombre de pièces de 50) fois 50 . En appelant n(z) le nombre de pièces de z francs, on a:5 n(5) + 1 n(1) = 20 n(20) + 50 n(50)
Molarité des charges positives = Molarité des charges négatives Equation 38 : Condition d©électroneutralité d©une solution Etude rigoureuse des solutions acides et basiques.Chapitre V 69
b) La condition de conservation de la matière.Nous savons qu"en introduisant un acide ou une base dans l"eau, nous donnons naissance, à côté
H3O+ et OH- , à un mélange de plusieurs espèces chimiques.
On introduit par exemple un acide faible HB dans l"eau. A l"équilibre, il restera l"espèce HB (un
reste important, si l"acide est faible) et il se sera formé B - (peu)On distinguera donc entre:
[]1)HBnombredemolesHBintroduits(totaux, initiaux) volumesolutionenlitreso= (concentration formelle, stoechiométrique, formalité de HB) volumesolutionenlitres= (concentration de l"acide HB à l"équilibre) []3)BnombredemolesBàl©équilibre volumesolutionenlitres (concentration de B - à l"équilibre) Pour chaque mol HB ionisée, il se forme une mole B -: Dans chaque litre de la solution, le nombre de moles HB initial est égal au nombre de moles B - + le nombre de moles HB à l"équilibre. On aura en général:Exemple:
Dans le cas d"un monoacide faible HB, on a:
[HB] o = [HB] + [B-] Molarité initiale = SSSS molarités résultantes à l"équilibre Equation 39 : Condition de conservation de la matièreAcides et bases
Chapitre V 70
c) Exemples de traitement mathématique et informatique1) pH d"un acide fort: H Cl 0,1 mol/l
-Mise en équation: (1) E.n. [Cl-] + [OH-] = [H3O+] (2) C.m. 0,1 = [Cl (3) P.i.e. [H3O+][OH-] = 10-14
Système de trois équations à trois inconnues: (2) et (3) dans (1): [H3O+]2 - 0,1[H3O+] - 10-14 = 0
-Résolution de l"équation du 2e degré: []HO0,10,014.1020,10moll314+-=±+@dans la limite des erreurs de mesure, la solution négative étant évidemment à rejeter, on obtient
ainsi: pH = 1,002) pH d"un acide faible: CH3COOH 0,1 mol/l, pKa = 4,75
-Mise en équation: (1)E.n.CHCOOOHHO (2)C.m.0,1CHCOOHCHCOO (3)P.i.e.HOOH10 (4)Eq.CHCOOHOCHCOOH1033
333 14 33
34,75--+
Système de 4 équations à 4 inconnues:
Etude rigoureuse des solutions acides et basiques.Chapitre V 71
(3)dans(1):CHCOOHO10 HO(5) (5)dans(4):CHCOOH(HO10 HO)HO 10(6) (5)et(6)dans(2):(HO10HO)(1HO
10)0,1
10HOHO(0,110)HO100(7)3314
3 331433
4,75 3 14 33
4,75 4,75 33
32
9,25
314-+-
Equation du 3e degré qu"un bon programme mathématique sur ordinateur (p.ex. Mathematica)résoudra sans peine . Pour ceux qui savent programmer, voici la méthode pour trouver la solution
de (7) dans n"importe quelle langue de programmation structurée:Le procédé de Newton pour la résolution d"équations d"un degré supérieur au 2ième:
Il s"agit de trouver les racines d"une équation f(x) = 0 , c.à.d. les intersections de la courbe
représentative de f avec l"axe des abscisses. 1 Pour cela, nous procédons de la manière suivante:1) Nous choisissons une première
valeur approchée pour x, à savoir x o22) Nous cherchons f(x
o), puis f"(xo), f"étant la dérivée de f
3) L"équation de la tangente menée à la
courbe représentative de f au point A(x o,f(xo)) de cette courbe s"écrit: y - f(x o) = f"(xo) (x - xo) (T)4) Cette droite coupe l"axe des
abscisses en un point B(x1,y1) avec
y1=0, c.à.d. à l"abscisse
x1=xo - f(xo)/f"(xo).
Nous voyons sur le diagramme que x1
se trouve plus près de la solution cherchée que x o.1Dans notre cas, on a évidemment :
x =[H3O+] et f(x) = f([H3O+]) = 104,75 [H3O+]3 + [H3O+]2 + (-0,1-10-9,25) [H3O+] - 10-14
2Dans notre cas, on pourra par exemple choisir xo = 1/2 pKa - 1/2 log[HB]o = 2,875 (formule approximative vue
dans le chapitre précédent ) y=f(x) xox1x2 A B solutionchercheAcides et bases
Chapitre V 72
5) En prenant maintenant x
1 comme nouvelle valeur approchée, nous recommençons les étapes 1),
2), 3) et 4) et nous trouvons encore une meilleure approximation de la valeur cherchée x
2. Les
valeurs successives trouvées se rapprochent de plus en plus de la solution correcte. Il suffirad"arrêter les calculs dès que l"écart entre deux valeurs successives tombera en-dessous des erreurs
de mesure du pH-mètre (environ 1%) 3 - L"algorithme du calculInitialisation: nouvelle valeur estimée := xo
ancienne valeur estimée := 0Boucle : Tant que
nouvellevaleurestim.anciennevaleurestim. nouvellevaleur0,01->estim.4 [ CalculerF := f(nouvelle valeur estimée)
D := f"(nouvelle valeur estimée)
Ancienne valeur estimée := nouvelle valeur estimée Nouvelle valeur estimée := ancienne valeur estimée - F/DSortie du résultat:
Imprimer nouvelle valeur estimée
L"implémentation
est maintenant facile dans une langue de programmation structurée (p.ex TURBO PASCAL): program acacétique01; var xi: real;{ancienne valeur estimée} xf: real;{ nouvelle valeur estimée} F: real;( f(xf)} D: real;( f"(xf)}3Il faut bien nous rendre compte que nous ne trouvons ici qu"une seule solution de l"équation proposée. En choisissant
une valeur approchée déjà fort convenable, nous multiplions nos chances de tomber immédiatement sur la bonne
solution!4La nouvelle valeur estimée peut très bien être plus petite que l"ancienne, d"où le choix de la valeur absolue dans cette
condition de terminaison . Etude rigoureuse des solutions acides et basiques.Chapitre V 73
begin xi:=0; xf:=1.33352e-3 while abs((xf-xi)/xf)>0.01 do begin xi:=xf; xf:=xi-F/D end; writeln(" pH=" ;-LN(xf)/LN(10)) end. - résultat : On trouve ici: pH = 2,878 , la méthode approximative donne 2,875!Le programme pourra être généralisé facilement au calcul du pH d"un acide faible quelconque de
constante d"acidé K a et de concentration formelle [HB]o données. d) Exercices (condition d"électroneutralité )5.1 Ecrire la condition d"électroneutralité pour les solutions aqueuses suivantes tout en tenant
compte des ions résultants de l"autoprotonation de l"eau: a) Solution de chlorure de potassium b) Solution de bromure de magnésium c) Solution de sulfate de lithium d) Ammoniaque e) Solution de chlorure d"ammonium f) Solution d"oxyde de potassium g) Acide sulfurique dilué (décompositions successives!) h) Solution d"hydroxyde de calcium.5.2 Ecrire la condition d"électroneutralité pour les mélanges de solutions aqueuses suivants tout en
tenant compte des ions résultants de l"autoprotonation de l"eau: a) Solution de chlorure de sodium et de chlorure de calcium b) Solution de bromure de sodium et d"acide bromhydrique c) Solution d"ammoniac et d"iodure d"ammonium d) Solution d"acide phosphorique et d"acide iodhydrique e) Solution d"acide sulfurique et de sulfate d"ammonium.Acides et bases
Chapitre V 74
5.3 L"étiquette d"une eau minérale indique les concentrations massiques ( en mg/l) des principaux
ions présents:Cations Anions
Calcium
Magnésium
Sodium
Potasssium
10,4 6,0 8,0 5,4 chlorure nitrate sulfate hydrogénocarbonate 7,5 4,0 6,7 64,0Compte tenu de la précision des mesures, vérifier, si l"électroneutralité de cette solution est vérifiée.
(condition de conservation de la matière)5.4 Ecrire la condition de conservation de la matière pour les solutions aqueuses suivantes:
a) Ammoniaque 0,1 M b) Acide cyanhydrique 0,27 g/l c) Acide sulfurique à 46,33% ( r=1,360 g/ml) d) Lessive de potasse5 à 12,08% (r=1,110 g/ml) e) Acide chlorhydrique 0,01 M (traitement mathématique)5.5 Trouver un système de N équations avec N inconnues pour les solutions aqueuses suivantes:
a) Acide perchlorique 0,5 M b) Lessive de soude6 à 1,045% (d=1,010)
c) Ammoniaque 0,1 M d) Solution de cyanure de sodium 0,98 g/l5.6 Résoudre le système obtenu en 5.4 a) par rapport à [H3O+], celui en 5.4 b) par rapport à
[OH -]. Trouver les équations en [OH-] obtenues en éliminant toutes les autres variables des systèmes 5.4 c) et d).5.6 Pour ceux qui savent programmer ou qui possèdent une calculatrice équipée ad hoc: Trouver
les pH corrects des solutions 5.4 c) et d) .Les premières valeurs d"approche nécessaires pour aborder
le procédé de Newton seront évidemment fournies par les formules approximatives du chapitre précédent..5Solution d"hydroxyde de potassium
6Solution d"hydroxyde de sodium
Etude rigoureuse des solutions acides et basiques.Chapitre V 75
Solutions:
5.1) a) [K+] + [H3O+] = [Cl-] + [OH-]
b) 2[Mg2+] + [H3O+] = [Br-] + [OH-]
c) [Li +] + [H3O+] = 2 [SO42-] + [OH-] d) [NH4+] + [H3O+] = [OH-]
e) [NH4+] + [H3O+] = [Cl-] + [OH-]
f) [K +] + [H3O+] = [OH-] g) [H3O+] = 2 [SO42-] + [HSO4-] + [OH-]
h) 2 [Ca2+] + [H3O+] = [OH-]
5.2) a) [Na
+] +2 [Ca2+] + [H3O+] = [Cl ] + [OH-] b) [Na +] + [H3O+] = [Br-] + [OH-] c) [NH4+] + [H3O+] = [I-] + [OH-]
d) [H3O+] = [I-] + [H2PO4-] + 2 [HPO42-] + 3 [PO43-] + [OH-]
e) [NH4+] + [H3O+] = 2 [SO42-] + [OH-] + [HSO4-]
5.3) [Ca
2+ ] = 0,259 mmol/l, [Mg2+] = 0,25 mmol/l, [Na+] = 0,34 mmol/l, [K+] = 0,14 mmol/l,
[Cl -] = 0,21 mmol/l, [NO3-] = 0,064 mmol/l, [SO42-] = 0,070 mmol/l, [HCO3-] = 1,05 mmol/l,Vérification: 2 0,259 + 2 0,25 + 0,34 + 0,14
» 0,21 + 0,064 + 2 0,070 + 1,05
5.4) a) [NH
4+] + [NH3] = 0,1
b) [HCN] + [CN -] = 1,0 10-2 c) [HSO4-] + [SO42-] = 6,425
d) [K +] = 2,390 e) [Cl -] = 0,01 5.5) a)E.n. [H
3O+] = [ClO4-] + [OH-] (1)
C.m. [ClO
4-] = 0,5 (2)
P.i.e. [H
3O+] [OH-] = 10-14 (3)
b)E.n. [Na
+] + [H3O+] = [OH-] (1)C.m. [Na
+] = 2,639 10-1 (2)P.i.e. [H
3O+] [OH-] = 10-14 (3)
c)E.n. [NH
4+] + [H3O+] = [OH-] (1)
C.m. [NH
4+] + [NH3] = 0,1 (2)
P.i.e. [H
3O+] [OH-] = 10-14 (3)
K.a. ([NH
3][H3O+])/[NH4+] = 10-9,20 (4)
Acides et bases
Chapitre V 76
d)E.n. [Na
+] + [H3O+] = [OH-] + [CN-] (1)C.m. [Na
+] = 2,00 10-2 (2)C.m. [HCN] + [CN
-] = 2,00 10-2 (3)P.i.e. [H
3O+] [OH-] = 10-14 (4)
K.a. ([CN
-][H3O+])/[HCN] = 10-9,31 (5) 5.6) a) [H3O+] = 5 10-1
b) [OH -] = 2,639 10-1 c) [][][]10OHOH100,110OH04,8029,2014----
d)0,0210
OHOH0,0210OH
110OH0
144,69
4,69quotesdbs_dbs23.pdfusesText_29[PDF] chimie inorganique exercices corrigés pdf
[PDF] chimie de coordination exercices corrigés
[PDF] chimie descriptive exercices corrigés
[PDF] exercices corrigés de chimie minérale descriptive
[PDF] chimie descriptive s3 pdf
[PDF] exercice corrigé de chimie minerale pdf
[PDF] cours de chimie descriptive pdf s4
[PDF] chimie descriptive s6
[PDF] nomenclature chimie minérale exercices corrigés
[PDF] nomenclature des sels
[PDF] nomenclature des composés inorganiques + exercices corrigés
[PDF] nomenclature chimie inorganique pdf
[PDF] chimie minérale pdf
[PDF] chimie nomenclature tableau
