 V Etude rigoureuse des solutions acides et basiques
V Etude rigoureuse des solutions acides et basiques
Equation 38 : Condition d'électroneutralité d'une solution Compte tenu de la précision des mesures vérifier
 THÈME : CHIMIE GÉNÉRALE TITRE DE LA LEÇON : SOLUTIONS
THÈME : CHIMIE GÉNÉRALE TITRE DE LA LEÇON : SOLUTIONS
connaître quelques propriétés de l'eau de vérifier l'électroneutralité d'une solution aqueuse
 Université de MSila 9/01/2021 Faculté des sciences. Département
Université de MSila 9/01/2021 Faculté des sciences. Département
Jan 9 2021 de perchlorate de magnésium. Calculer la concentration de chaque ion dans la solution finale. Vérifier l'électroneutralité de la solution.
 Chimie CLASSE DE 1ère S Vers la Terminale S
Chimie CLASSE DE 1ère S Vers la Terminale S
Calculer la concentration molaire effective de chacun des ions présents dans la solution. c. Vérifier l'électro neutralité de la solution. Exercice 5
 PHYSIQUE-CHIMIE
PHYSIQUE-CHIMIE
Electroneutralité de la solution : 2 [ . 2+] = 2 × 18 = 3
 UNIVERSITE P
UNIVERSITE P
c) Calculer le pH d'une solution de fluorure de sodium (NaF) de concentration. C2 = 10-1 mol L-1. Vérifier les approximations utilisées. pH=½ (pKa +pKe + log C2)
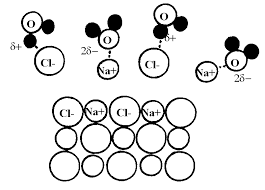 Fiche 4 : Les composés ioniques
Fiche 4 : Les composés ioniques
Pour respecter l'électroneutralité : 1 ion chlorure (charge (-)) s'associe avec 1 ion sodium (charge (+)) : 1(-) + 1(+) = 0. Cela forme le solide ionique : NaCl
 UNIVERSITE P
UNIVERSITE P
c) Calculer le pH d'une solution de fluorure de sodium (NaF) de concentration. C2 = 10-1 mol L-1. Vérifier les approximations utilisées. pH=½ (pKa +pKe + log C2)
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
Feb 6 2010 1.2 Voir §4.1 du chapitre 12. ... On complète ensuite au trait de jauge avec de l'eau distillée. Exercice 5 : Électroneutralité et écriture d'une ...
 Interprétation dune gazométrie
Interprétation dune gazométrie
Nov 22 2011 La loi de l'électro-neutralité des solutions. 22. 6ème journée SIAMU ... une solution aqueuse exposée à. ❑ Pa Co. 2 constante. ❑ Ions fortement ...
 V Etude rigoureuse des solutions acides et basiques
V Etude rigoureuse des solutions acides et basiques
Equation 38 : Condition d'électroneutralité d'une solution de la précision des mesures vérifier
 Solutions tampons
Solutions tampons
solutions telles que la relation classiquement établie est vérifiée le pH ne dépend d'ailleurs pas d'électroneutralité
 L1 SVST réaction chim TD sept 2021
L1 SVST réaction chim TD sept 2021
Rappeler la définition de l'électro-neutralité d'une solution aqueuse ionique. 4. Vérifier l'électro-neutralité de la solution préparée.
 35 1. Les différents sels sont : NaCl KCl et MgCl2 . Donc
35 1. Les différents sels sont : NaCl KCl et MgCl2 . Donc
https://lycee.editions-bordas.fr/9782047336786/assets/chapitre-3-corrige-de-lexercice-35-2/preview
 ENSEIGNEMENT SCIENTIFIQUE PREMIERE PARTIE 1 UNE
ENSEIGNEMENT SCIENTIFIQUE PREMIERE PARTIE 1 UNE
Vérifier l'électro neutralité du cristal. Les entités sont des ions. Il y a autant d'ions sodium que d'ions Chlorure : le cristal est électriquement.
 Module CHIM 102A : DS n°1 (durée : 1 heure)
Module CHIM 102A : DS n°1 (durée : 1 heure)
3) Rappeler la définition de l'électroneutralité d'une solution aqueuse 4) Pour les ions de cette eau minérale l'électroneutralité est-elle vérifiée ?
 pH et équilibres acido-basiques en solution aqueuse
pH et équilibres acido-basiques en solution aqueuse
d'exprimer et de vérifier les équations de conservation de matière (des espèces) et d'électroneutralité pour ces solutions ;.
 Cours et exercices de chimie des solutions
Cours et exercices de chimie des solutions
L'éléctroneutralité d'un mélange de composés ioniques en solution traduit le Vérifier que la réaction de l'acide éthanoïque sur l'eau n'est pas totale.
 SOLUTIONS AQUEUSES IONIQUES
SOLUTIONS AQUEUSES IONIQUES
Électro neutralité d'une solution aqueuse C'est l'équation de l'électroneutralité de la solution ... 2.3-Vérifie l'électroneutralité du mélange.
 [PDF] V Etude rigoureuse des solutions acides et basiques
[PDF] V Etude rigoureuse des solutions acides et basiques
Compte tenu de la précision des mesures vérifier si l'électroneutralité de cette solution est vérifiée (condition de conservation de la matière) 5 4 Ecrire
 solution
solution
Remarque : dans la solution ily a des ions Ca2+ et des ions Cl- venant du La solution est neutre l'équation d'électro-neutralité qui traduit ce fait
 Solutions
Solutions
On voit qu'il y a autant de H3O+ que de OH- ce qui traduit l'électroneutralité de la solution Ainsi à 25 °C : [H3O+] = [OH-]= 10-7 mol l-1
 [PDF] SOLUTIONS AQUEUSES NOTION DE pH
[PDF] SOLUTIONS AQUEUSES NOTION DE pH
quelques propriétés de l'eau de vérifier l'électroneutralité d'une solution aqueuse de déterminer le pH de solutions aqueuses et de les classer
 [PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
[PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Comment prélève t on le volume V0 de la solution mère b Quelle est la concentration de la solution fille ? c Calculer le facteur de dilution F effectué
 [PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
[PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
Force des acides et des bases 1 5 Constantes d'acidité et de basicité 1 6 Coefficient de dissociation d'un acide faible : 2 CALCUL DE PH DES SOLUTIONS
 [PDF] pH et équilibres acido-basiques en solution aqueuse
[PDF] pH et équilibres acido-basiques en solution aqueuse
d'exprimer et de vérifier les équations de conservation de matière (des espèces) et d'électroneutralité pour ces solutions ;
 [PDF] Stéphane Mathé - Dunod
[PDF] Stéphane Mathé - Dunod
L'électroneutralité de la solution 25 5 Le bilan matière 26 6 La résolution d'un problème de chimie des solutions 28 6 1 Identifier les inconnues du
 [PDF] Lélectroneutralité des solutions
[PDF] Lélectroneutralité des solutions
L'électroneutralité des solutions Comment les solutions ioniques sont-elles toujours fournit en solution aqueuse des ions sodium Na+ et des ions
 [PDF] chimie-des-solutions-examens-corrigés-06pdf - F2School
[PDF] chimie-des-solutions-examens-corrigés-06pdf - F2School
4- Si les approximations sont vérifiées comment s'exprimera le pH de la solution en fonction du pKa pKe et de Co? 16-1- Une solution (A) contient 85 g
Comment vérifier l Electroneutralité de la solution ?
On parle d'électroneutralité pour la matière lorsque la somme des concentrations des esp?s chargées positivement est égale à la somme des concentrations des esp?s chargées négativement.Qu'est-ce que l Électroneutralité d'une solution ?
Il faut que le nombre de charges positives soit identique au nombre de charges négatives. Quelques exemples : Chlorure de fer II : +2 (l'ion fer II possédant 2 charges +, il faut prendre 2 ions chlorure, chaque ion chlorure ayant 1 seule charge -).Comment calculer la neutralité d'une solution ?
Si le pH est compris entre 0 et 7, on a une solution acide. Si le pH vaut 7, on a une solution neutre. Si le pH est compris entre 7 et 14, on a une solution basique ou alcaline.
 ENSEIGNEMENT SCIENTIFIQUE PREMIERE PARTIE 1 UNE LONGUE HISTOIRE DE LA MATIERE
ENSEIGNEMENT SCIENTIFIQUE PREMIERE PARTIE 1 UNE LONGUE HISTOIRE DE LA MATIERE ACTIVITE MAILLE DU CHLORURE DE SODIUM
Dans cette activité, nous allons étudier la structure cristalline du chlorure de sodium solide communément appelé
le sel.Le sel ou chlorure de sodium, semble une denrée inépuisable sur la planète, mais les formes qu'il prend sont
recouvraient la Terre, il s'est déposé en couches de sédiments à chaque retrait de la mer. Il se trouve aujourd'hui en abondance dans la nature, soit à l'état de roche, le sel gemme*, soit dissout dans l'eau de mer. La halite (du grec hals, " sel », et lithos, " pierre ») désigne le sel gemme. Les gisements de halite proviennent de l'évaporation de mers ou de lacs salés. Ils sont composés de couches qui peuvent atteindre jusqu'à 30 mètres d'épaisseur. Le sel marin. Le chlorure de sodium issu de l'évaporation de l'eau de mer, appelé sel marin ou sel de mer, est produit ou récolté dans des marais salants. L'énergie solaire ou éolienne permet d'évaporer l'eau. La saumure. La saumure désigne une eau chargée en sel, qu'elle soitd'origine marine ou fossile (sel gemme). Le sel de saumure est obtenu par évaporation de l'eau, soit
naturellement, soit en chauffant l'eau salée. On parle alors de sel ignigène.Le sel extrait des végétaux. Dans les régions dépourvues de ressources en sel, le sel peut être extrait de
végétaux (plantes halophytes) dont on fait brûler les feuilles. Les plantes halophytes vivent dans les milieux
riches en sel, soit des sols, soit des terrains recouverts par la mer. C'est le cas, par exemple, de la salicorne,
qui pousse dans les marais salants. Les cendres végétales sont traitées de manière à en extraire les
nombreux sels minéraux. sel gemme* : Sel fossile extrait des mines sous forme de minerai. Document 3 : Le chlorure de sodium vu à différentes échelles neutre r(Cl- )et r(Na+), rayons des atomes de sodium et chlorure. a = 2 x r(Cl- )+2 x r(Na+),4. Déterminer le nombre de chacune des entités présentes dans la maille en respectant les règles de calcul vues
Multiplicité Sodium 12x1/4 +1 = 3+1=4
Multiplicité Chlorure 8x1/8+6x1/2 =4
chlorure de sodium. Choisir la représentation compacte " Sphères »..Compacité ܿ
7. Dessiner une maille de chlorure de sodium en perspective cavalière en choisissant 2 couleurs différentes pour les
Na+ et le Cl-
quotesdbs_dbs29.pdfusesText_35[PDF] chimie inorganique exercices corrigés pdf
[PDF] chimie de coordination exercices corrigés
[PDF] chimie descriptive exercices corrigés
[PDF] exercices corrigés de chimie minérale descriptive
[PDF] chimie descriptive s3 pdf
[PDF] exercice corrigé de chimie minerale pdf
[PDF] cours de chimie descriptive pdf s4
[PDF] chimie descriptive s6
[PDF] nomenclature chimie minérale exercices corrigés
[PDF] nomenclature des sels
[PDF] nomenclature des composés inorganiques + exercices corrigés
[PDF] nomenclature chimie inorganique pdf
[PDF] chimie minérale pdf
[PDF] chimie nomenclature tableau
