 LES ALCANES
LES ALCANES
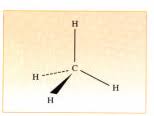
Les alcanes sont des hydrocarbures de formule brute CnH2n+2. Tous leurs atomes de carbone sont tétragonaux. Le méthane CH4 est le plus simple des alcanes.
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
b) Trouver la structure d'une molécule connaissant le nom. 1. Hydrocarbures (HC) saturés acycliques : les alcanes. Les hydrocarbures saturés ne sont formés
 Les alcanes et les alcools
Les alcanes et les alcools
On appelle hydrocarbures les molécules contenant uniquement des atomes de carbone et d'hydrogène : les alcanes sont des hydrocarbures à chaîne linéaire et
 T.P. cours Alcanes Alcools
T.P. cours Alcanes Alcools
Doc n°2 : Les alcanes. Les alcanes sont des hydrocarbures (constitués uniquement d'atomes de carbone et d'hydrogènes) acycliques de formule brute : CnH2n+2.
 Ce document est le fruit dun long travail approuvé par le jury de
Ce document est le fruit dun long travail approuvé par le jury de
pdf. Baldwin et al. (1982). BALDWIN R.R.
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
Les alcanes sont des hydrocarbures saturés de formule brute CnH2n+2. Le nom Pour nommer un radical il suffit de remplacer la terminaison. "ane" de l'alcane ...
 Les alcanes exercices corrigés
Les alcanes exercices corrigés
Les alcanes exercices corrigés pdf 3eme. Hydrocarbure saturé les alcanes exercices corrigés pdf. Exercices corrigés sur les alcanes 3ème pdf. Les alcanes
 Untitled
Untitled
Les ligroïnes (Eb = 60-120°C) sont constituées principalement d'hexane d'heptane et d'octane. Les essences (Eb = 50 à 200°C) se composent d'alcanes moyens
 ALCANES ET ALCOOLS
ALCANES ET ALCOOLS
Combien de doublets liants forme-t-il avec les atomes voisins ? (Rappel : numéro atomique du carbone Z =6.) ➢ Un alcane non-cyclique est un hydrocarbure de
 LES ALCANES
LES ALCANES
Les alcanes sont des hydrocarbures de formule brute CnH2n+2. Tous leurs atomes de carbone sont tétragonaux. Le méthane CH4 est le plus simple des alcanes.
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
Hydrocarbures (HC) saturés acycliques : les alcanes. Les hydrocarbures saturés ne sont formés que de carbone et d'hydrogène.
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
I/ NOMENCLATURE DES ALCANES ACYCLIQUES. Les alcanes sont des hydrocarbures saturés de formule brute CnH2n+2. Le nom des alcanes se termine par le suffixe
 Nomenclature des alcanes et des alcènes
Nomenclature des alcanes et des alcènes
Par conséquent dans une molécule d'alcane
 63 Chapitre 6 : Alcanes
63 Chapitre 6 : Alcanes
Ils sont saturés de formule brute générale CnH2n+2. Les alcanes de C1 à C4 (du méthane au butane) sont gazeux à température ambiante. Jusqu'à C16
 Les alcanes et les alcools
Les alcanes et les alcools
On appelle hydrocarbures les molécules contenant uniquement des atomes de carbone et d'hydrogène : les alcanes sont des hydrocarbures à chaîne linéaire et
 Lycée Maurice Ravel
Lycée Maurice Ravel
Exercices sur les alcanes et les alcools. Exercice 3 : 4. Ecrire la formule brute du 2-methylpropane. 5. Ecrire la formule semi-développée de cette molécule.
 ALCANES ET CYCLOALCANES 1- Définitions Les hydrocarbures
ALCANES ET CYCLOALCANES 1- Définitions Les hydrocarbures
Les noms des alcanes linéaires comportant un nombre d'atomes de carbone supérieur à quatre sont obtenus en faisant suivre du suffixe "ane" un préfixe numérique
 Cours de chimie organique
Cours de chimie organique
Les 4 orbitaux « s » sphériques de 4 atomes d'hydrogène formant un système tétraédrique. Cette hybridation du carbone se retrouve dans tous les alcanes de
 Devoirs : Les alcanes
Devoirs : Les alcanes
On recherchait les composés du gazole …. Exercice 1 : I can all ! / 12 pts. Nommer les alcanes suivants : 1
 [PDF] LES ALCANES
[PDF] LES ALCANES
Alcanes à chaîne carbonée non ramifiée Les quatre premiers alcanes (1 < n < 4) portent des noms consacrés par l'usage : méthane éthane propane butane Les
 [PDF] Nomenclature en chimie organique - UniNE
[PDF] Nomenclature en chimie organique - UniNE
1 NOMENCLATURE EN CHIMIE ORGANIQUE La nomenclature permet de : a) Trouver le nom d'une molécule 1 Hydrocarbures (HC) saturés acycliques : les alcanes
 [PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
[PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
Les alcanes sont des hydrocarbures saturés de formule brute CnH2n+2 Le nom des alcanes se termine par le suffixe "ane" I-1- Alcanes à chaîne linéaire Les
 [PDF] Les alcanes et les alcools - Physique - Chimie
[PDF] Les alcanes et les alcools - Physique - Chimie
I/ L'identification des alcanes et des alcools 1/ Les différents types de squelettes carbonés Les alcanes et les alcools sont des molécules organiques
 [PDF] Nomenclature des alcanes et des alcènes - Nicole Cortial
[PDF] Nomenclature des alcanes et des alcènes - Nicole Cortial
1°) Généralités : Un n-alcane est un alcane où chaque atome de carbone est lié au maximum à deux atomes de carbone
 [PDF] alcanes Courspdf - CELENE
[PDF] alcanes Courspdf - CELENE
ALCANES ????? 41 Ce sont les constituants principaux des pétroles et du gaz Si on donne la vitesse 1 à la chloration d'un carbone primaire on a :
 [PDF] Chapitre 3: Nomenclature en chimie organique
[PDF] Chapitre 3: Nomenclature en chimie organique
Un hydrocarbure est une molécule comportant uniquement des atomes de carbone et d'hydrogène 2 1 1 Hydrocarbures acycliques saturés linéaires : Les alcanes sont
 [PDF] Chimie organique 1 (cours) Nomenclature des alcanes alcènes et
[PDF] Chimie organique 1 (cours) Nomenclature des alcanes alcènes et
Nomenclature des alcanes alcènes et alcools 1 Les alcanes a Définition : ce sont des hydrocarbures saturés (donc formés à partir d'atomes de carbone et
 [PDF] cour-chimie-organique-S2-2017-2018pdf
[PDF] cour-chimie-organique-S2-2017-2018pdf
1 Département de Chimie Support de cours de chimie organique Chapitre VI : Hydrocarbures aliphatiques (Alcanes ; Alcènes ; Alcynes) I Les alcanes :
Quels sont les différents alcanes ?
4C4H10 n-butane 5 C5H12 n-pentane 6 C6H14 n-hexane 7 C7H16 n-heptane Quels sont les 4 premiers alcanes ?
Alcanes à chaîne carbonée non ramifiée Les quatre premiers alcanes (1 < n < 4) portent des noms consacrés par l'usage : méthane, éthane, propane, butane.Quelles sont les formules des alcanes ?
Dénommés également paraffines, les alcanes sont des hydrocarbures acycliques saturés de formule générale CnH2n+2. On peut les représenter symboliquement par la notation RH, où R correspond à un groupe alkyle (CnH2n+1). Ils ne comportent que des liaisons carbone-carbone simples.- Hydrocarbure saturé à chaîne ouverte, de formule générale CnH2n+2.

Chapitre 6 - 2009-2010 63 Chapitre 6 : Alcanes
1. Structure et propriétés physicochimiques
Ils ne sont composés que de carbone et d"hydrogène, ne contiennent que des liaisons simples σ.
Ils sont saturés, de formule brute générale C nH2n+2 Les alcanes de C1 à C4 (du méthane au butane) sont gazeux à température ambiante.Jusqu"à C16, ils sont liquides, au-delà ils sont solides (paraffines). Les liquides sont de bons solvants (les plus utilisés sont
le pentane et l'hexane), non miscibles à l"eau, qui solubilisent les composés apolaires ou peu polaires (le white-spirit par
exemple est un mélange d"alcanes).On trouve les alcanes dans le gaz naturel et le pétrole. Ils sont largement utilisés en tant que source d"énergie lors de
leur combustion.2. Réactivité
Les différentes liaisons dans un alcane sont très peu polarisées, il n"y a donc pas de sites réactifs delta plus ou
delta moins. Les seules réactions envisagées pourront l"être par l"intermédiaire de coupures homolytiques de liaisons, elles
seront donc de type radicalaire, effectuées sous l"effet d"un chauffage à température très élevée, ou sous l"action d"un
radical présent dans le milieu, formé par chauffage ou sous l"effet de radiation lumineuse (hν).
2.1. Halogénation radicalaire
L"halogénation radicalaire des alcanes permet de les fonctionnaliser pour obtenir des composés réactifs, les
halogénoalcanes (cf chapitre 7). La conversion fonctionnelle est la suivante :Il s"agit d"une substitution radicalaire.
Exemple de la chloration du méthane
* Obtention du chlorométhane : équation-bilan +CH4+ HCl + Cl2CH3Cl2Cl2 hν Cette réaction s"effectue en phase gazeuse, à température ambiante, sous lampe UV. * Mécanisme Un mécanisme radicalaire s"effectue toujours en 3 phases : -Phase d"initiation (ou amorçage)ClClCl Clh
Les alcanes sont insensibles à l"énergie lumineuse, contrairement à Cl2. La liaison Cl-Cl se rompt de façon homolytique pour
donner deux radicaux Cl - Phase de propagationEn 2 étapes
CH3ClH CH3
CH3Cl ClCH3Cl Cl HCl
1) 2)+Dans la 1ère étape, un des radicaux chlore formés précédemment réagit avec une liaison C-H d"un méthane (une liaison C-C
est trop stable pour faire de même) pour donner une molécule d"HCl et un radical méthyle. Dans la 2
ème étape, ce radical
méthyle réagit avec une molécule de dichlore (non irradiée) pour donner du chlorure de méthyle (=chlorométhane) et un
radical chlore. Ce radical chlore peut aller réagir avec une autre molécule de méthane, selon l"étape 1 de la phase de
propagation, et ainsi de suite jusqu"à épuisement du méthane (réaction en chaîne). - Phase de terminaisonCl+ClCl2
Cependant, il n"est absolument pas exclu qu"au hasard des chocs inter-entités dans le milieu réactionnel, un radical
rencontre n"importe quel autre radical présent dans le milieu réactionnel pour former une liaison :
CH3ClCH3+Cl
Conversion fonctionnelle : R-H R-X X
2 / hνννν
Chapitre 6 - 2009-2010 64
CH3+CH3CH3CH3
Ces réactions font également partie de la phase de terminaison.L"éthane formé est un produit indésirable. De plus, il ne faut pas oublier que, au niveau moléculaire, les molécules de
réactifs ne réagissent pas toutes en même temps, on a simultanément en présence du réactif inchangé, divers
intermédiaires réactionnels, le produit de réaction etc. Ce qui implique en particulier que le radical chlore peut entrer en
contact avec une autre liaison C-H que celle du méthane, par exemple une de CH3Cl formé Il y a donc obtention de
mélanges de produits chlorés, CH3Cl, CH2Cl2, CHCl3, CCl4...
Exemple de la phase de propagation lors de l"obtention de CH2Cl2 :CH2ClClH CH2-Cl
CH2Cl+Cl ClCH2Cl2 Cl HCl
1) 2)+La réaction de chloration radicalaire du méthane peut également s"appliquer aux autres alcanes. Ce sont des réactions peu
maîtrisables au niveau macroscopique, beaucoup de réactions au niveau moléculaire étant en compétition. Mais les
différents produits chlorés étant facilement séparables, cette réaction conserve donc un intérêt bien qu"elle mène à des
mélanges de produits. Ces réactions sont également applicables pour obtenir des composés bromés à partir de Br
2.2.2. Combustion des alcanes
L"oxydation totale des alcanes par le dioxygène est très exothermique, utilisée comme source d"énergie. La combustion
provoque la rupture de toutes les liaisons covalentes C-C ou C-H pour donner du CO2 et H2O :
2CH4+4O22CO2 + 4H2O
2 CH3CH2CH3+ 10O26CO2 + 8H2O
L"équilibrage de la réaction se fait selon la formule suivante (donnée à titre indicatif) :
2CnH2n+2 + (3n + 1)O22n CO2 + (2n + 2)H2O
2.3. Oxydation des alcanes par le dioxygène lors du stokage (= autooxydation)
L"oxydation des alcanes est très lente à température ambiante : il s"agit d"une réaction radicalaire à partir de O
2. Le dioxygène possède une structure de diradical relativement stable :O O O O
Un radical alkyle présent (provenant par exemple de la coupure homolytique d"une liaison C-H sous l"influence
d"une chaleur temporaire), peut se combiner à l"oxygène pour former un radical hydroperoxyle, qui lui-même va réagir
avec l"alcane pour redonner un radical alkyle (pouvant propager la réaction) et un hydroperoxyde. L"oxygène est trop peu
réactif pour réagir lui-même avec la liaison C-H d"un alcane. O O C HCO OCO OC HC+
radical hydroperoxylealcane+ hydroperoxydeC O O HC OOH+mélanges complexeslumière
ou ΔLa liaison O-O dans le peroxyde formé est fragile et se coupe très facilement de façon radicalaire pour donner
d"autre radicaux oxygénés, qui eux-mêmes entrent en réaction pour former des mélanges complexes. Cette réaction des
peroxydes est explosive et peut être à l"origine d"accidents lors du stockage prolongé d"alcanes.
La formation de peroxydes par réaction radicalaire à partir de dioxygène est également source de certaines
pathologies et du vieillissement des tissus.quotesdbs_dbs29.pdfusesText_35[PDF] les alcanes cours 1ere s
[PDF] formule alcane
[PDF] alcane groupe caractéristique
[PDF] alcane ramifié
[PDF] oxydation des alcools exercices corrigés
[PDF] taux de sulfate dans l'eau
[PDF] teneur en sulfate dans les sols
[PDF] écrouissage isotrope et cinématique
[PDF] écrouissage isotrope linéaire
[PDF] comportement non linéaire des matériaux
[PDF] la chine et l'afrique un nouveau partenariat pour le développement
[PDF] relation chine afrique
[PDF] la chine en afrique : enjeux et perspectives
[PDF] la chine populaire et l afrique
