 Chromatographie par filtration sur gel
Chromatographie par filtration sur gel
La chromatographie par filtration sur gel dite aussi chromatographie d'exclusion - diffusion est une technique qui permet une séparation simple et rapide
 Guide to Gel Filtration or Size Exclusion Chromatography
Guide to Gel Filtration or Size Exclusion Chromatography
Gel Filtration. Gel Filtration also called size-exclusion chromatography can be used for protein. DNA purification buffer exchange
 Gel Filtration Handbook
Gel Filtration Handbook
purified by a combination of affinity chromatography and gel filtration. The antibody was captured by affinity chromatography using MabSelect™. Gel
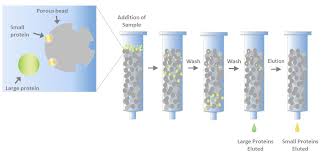 Gel Filtration Chromatography Protocol Utilizing Plain and Cross
Gel Filtration Chromatography Protocol Utilizing Plain and Cross
30 nov. 2018 Beads can be used in column or batch format. Figure 1. Overview of size-exclusion chromatography (also called gel filtration). In this assay.
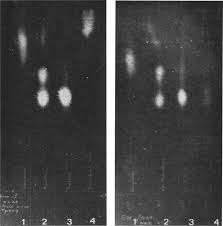 La filtration sur gel moldculaire suivant la technique de la
La filtration sur gel moldculaire suivant la technique de la
La filtration sur gel moldculaire suivant la technique de la chromatographie en couche mince est d'origine r'kente; elk fut mise au point par DETERMANN~
 Chromatography of Trypsin and Its Derivatives
Chromatography of Trypsin and Its Derivatives
desalting by gel filtration before lyophilization. Chromatography of Trypsin Derivatives-A number of deriva- tives of trypsin were also conveniently.
 Chromatographic Separation of Milk Proteins: A Review1
Chromatographic Separation of Milk Proteins: A Review1
Ion exchange chromatography and gel filtration have made possible the isolation and purification of many previously unrecognized milk proteins and must now be
 Selection guide
Selection guide
Size exclusion chromatography (SEC) also called gel filtration (GF)
 Gel Filtration Molecular Weight Markers (MWGF200) - Technical
Gel Filtration Molecular Weight Markers (MWGF200) - Technical
Product Description. Gel filtration chromatography is an established method for determining the size and molecular mass of proteins.
 Size Exclusion Chromatography Principles and Methods
Size Exclusion Chromatography Principles and Methods
Size exclusion chromatography (SEC) also called gel filtration (GF). Charge. Ion exchange chromatography (IEX). Biorecognition (ligand specificity). Affinity
 [PDF] 2-Chromatographiepdf
[PDF] 2-Chromatographiepdf
les interactions ioniques (Chromatographie par échange d'ions) - la taille (Chromatographie par gel-filtration) - la spécificité (Chromatographie
 [PDF] Chromatographie sur Colonne
[PDF] Chromatographie sur Colonne
d'interagir avec le sproteines par differentes methodes – Exchan ge d'Ions – Hydrophobic – Gel de filtration – Affinité
 [PDF] le guide pour une chromatographie dexclusion stérique réussie
[PDF] le guide pour une chromatographie dexclusion stérique réussie
connue sous le nom de chromatographie d'exclusion stérique (SEC) Contrairement Échantillon : mélange d'étalons de filtration sur gel BioRad
 59s - Filtration sur gel malQculaire en couche mince des venins de
59s - Filtration sur gel malQculaire en couche mince des venins de
La filtration sur gel moldculaire suivant la technique de la chromatographie en couche mince est d'origine r'kente; elk fut mise au point par DETERMANN~
 [PDF] Techniques dextraction et de caractérisation dune protéine
[PDF] Techniques dextraction et de caractérisation dune protéine
La chromatographie d'exclusion moléculaire également appelée gel- filtration Celte méthode sépare des protéines selon leur taille La colonne
 [PDF] Méthodes danalyse et de séparation des peptides et protéines
[PDF] Méthodes danalyse et de séparation des peptides et protéines
30 jan 2021 · ?La chromatographie d'exclusion moléculaire (filtration sur gel) sépare en fonction de la taille ?La chromatographie échangeuse d'ions
 [PDF] Chapitre 1 : Techniques Chromatographiques - univ-oeb
[PDF] Chapitre 1 : Techniques Chromatographiques - univ-oeb
appelée chromatographie d'exclusion tamisage moléculaire gel-filtration perméation de gel La phase stationnaire est un solide poreux : les
 [PDF] Chromatographie par filtration sur gel - biotechnologieseducation
[PDF] Chromatographie par filtration sur gel - biotechnologieseducation
La chromatographie par filtration sur gel dite aussi chromatographie d'exclusion - diffusion est une technique qui permet une séparation simple et rapide
 [PDF] Gel Filtration Chromatography
[PDF] Gel Filtration Chromatography
The objective of this experiment is for students to learn the principles of gel filtration chromatography by separating of two substance according to the
 Chromatographie par filtration sur gel - PDF Free Download
Chromatographie par filtration sur gel - PDF Free Download
1 MANIPULATION ff 2 Chromatographie par filtration sur gel Etalonnage de la colonne Détermination de la masse molaire apparente d'une protéine La
 [PDF] Gel Filtration
[PDF] Gel Filtration
Gel Filtration Principles and Methods 18-1022-18 Reversed Phase Chromatography Principles and Methods 18-1134-16 Expanded Bed Adsorption
 (PDF) Gel Filtration Chromatography - ResearchGate
(PDF) Gel Filtration Chromatography - ResearchGate
23 nov 2022 · PDF Apart from finding multitudes of applications in chemical medicinal and pharmaceutical research gel filtration chromatography (GFC)
 (PDF) Gel Filtration Chromatography - ResearchGate
(PDF) Gel Filtration Chromatography - ResearchGate
16 jan 2019 · PDF Gel Filtration Chromatography technique Find read and cite all the research you need on ResearchGate
 [PDF] Chromatographie sur Colonne
[PDF] Chromatographie sur Colonne
Ion exchange chromatography • L'echangeur d'ions contient des groupes chargés Gel filtration chromatography ?Chromatographie sur Gel de filtration
 [PDF] Initiation à la chromatographie sur gel dexclusion-diffusion
[PDF] Initiation à la chromatographie sur gel dexclusion-diffusion
Initiation à la chromatographie sur gel d'exclusion-diffusion 1 Dessalage d'une solution protéique par chromatographie d'exclusion-diffusion
 Chromatographie : introduction - 123bionet
Chromatographie : introduction - 123bionet
Ce type de chromatographie est encore appelé : tamisage moléculaire gel-filtration ou perméation de gel Principe : Cette technique permet la séparation des
Quels sont les 2 rôles de la chromatographie ?
La chromatographie peut être analytique (visant à l'identification des substances présentes) ou préparative (visant à la séparation des constituants d'un mélange).Quel est le principe de la chromatographie ?
La chromatographie est une technique séparative analytique et/ou préparative. Elle consiste à faire migrer les constituants à séparer sur une phase stationnaire immobile, à l'aide d'une phase mobile, liquide ou gazeuse, de nature différente.Comment calculer le volume d'élution ?
Une molécule totalement incluse sera éluée avec un volume d'élution V* = Vm + Vi, où Vi est le volume d'eau interne aux granules de gel (voir plus bas). Les solutés sont donc élués dans l'ordre inverse des masses moléculaires (voir figure ci- dessous).- Un gel de filtration déterminé présente a un domaine de fractionnement (Fractionation Range) spécifique (exprimé en termes de masse moléculaire) à l'intérieur duquel les protéines vont prendre, pour sortir du gel, un temps proportionnel à leur taille, donc à leur poids.
![[PDF] Chromatographie sur Colonne [PDF] Chromatographie sur Colonne](https://pdfprof.com/Listes/17/30896-17BM1chromatographiessuite2020.pdf.pdf.jpg)
Chromatographie sur Colonne
•mobile phase. •stationary phase (resines) •La phase sattionnaire a des carcteristiques physico-chimiques qui lui permettent d'interagir avec le sproteines par differentes methodes -Exchan ge d'Ions -Hydrophobic -Gel de filtration -AffinitéIon exchange chromatography
•L'echangeur d'ions contient des groupes chargés •Si la nature de la resine est acide elle agira avec des proteins chargées positivement donc c'est une echangeuse de cations •Si la nature de la resine est basique elle agira avec des proteins chargées negativement donc c'est une echangeuse anionsDEAE cellulose
anion exchanger= exchangeur d'anion CH 2 -CH 2 -NH (CH 2 CH 2 - - Negatively charged (acidic) protein or enzymeCM cellulose
cation exchanger=exchangeur de cation CH 2 -COO CH 2 -COO + + Positively charged (basic) protein or enzyme CH 2 -CH 2 -NH (CH 2 CH 2Ion exchange chromatography
chromatographie exchangeuse d'IonsCM cellulose
cation exchanger CH 2 -COO CH 2 -COO + + Proteines chargées+ (retenues par la résine) Pour lier les proteins, le pH est fixé pres de la neutralité 0 00 0 Proteines charges -
Proteines non charges 0
(rejetées par la résine)Ion exchange chromatography
CM cellulose
cation exchanger CH 2 -COO CH 2 -COO+ + Pour eluer une protein on ajoute des concentations croissants en sel ou on change de pH (decroissant ou croissant)
exp: Na agit avec le cation de la resine et Cl agit avec notre protein charged positive (+)CM cellulose
cation exchanger CH 2 -COO CH 2 -COO + + Na Na Cl Na +2 Cl Cl Cl Na +2 +++++[NaCl] de la solution d'elutionEtapes de la chrommatographie
echangeuse d'ions exp:proteines1-choix de la résine : R+ ou R-
2-choix du pH pour fixer l'ensemble des proteines
3-variance du ph (croissant/decroissant)
4-elution: ordre;1;2;3.........n
Quelques echangeurs d'ion tres utilisés
Gel filtration chromatography
Chromatographie sur Gel de filtration
Exclusion moléculaire
Tamis moleculaire
Gel filtration chromatography
Size/Taille
Masse moleculaire
(daltons)10,000
30,000
100,000
Gel filtration chromatography
FLUXGel filtration chromatography
FLUXGel filtration chromatography
FLUXGel filtration chromatography
FLUXGel filtration chromatography
fluxGel filtration chromatography
La masse moleculaire de la plus petite molecule incapable de penetrer dans le gel est considerée comme la limité d'exclusion de la chromatographieGel filtration chromatography
•Volume d'Elution (V e ) c'est le volume du solvent necessaitre pour faire sortir un compose donné de la colonne •Les molécules dont le poids estinferieur à la limite d'exclusion du gel seront éluées en ordre décroissant avec les plus grandes qui descendent en premier de la colonneFigure 6-9 Gel filtration chromatography.
Page 137
Figure 6-10 Molecular mass determination
by gel filtration chromatography.Page 138
Quelques gels de filtaration utilisés pour le
tamis moléculaireAffinity chromatography
•Many proteins can bind specific molecules very tightly but noncovalently. •We can use this to our advantage with affinity chromatography. Glucose (small dark blue molecule) binding to hexokinase.The enzyme acts like a jaw and clamps down on the
substrate (glucose)Affinity chromatography
•How does it work? •Ligand - molecule qui se lie specifiquement à la proteine support InerteSpacer arms
(espaceur) + +Ligand
support InerteMateriel d'Affinité
preparéAffinity chromatography
Inert support
Mélange de proteines
Inert support
Proteines non retenues
Affinity chromatography
Inert support
Detahé du ligand
competitif par dialyseInert support
Elué avec un ligand competitif
Affinity chromatography
Pour détacher la protéine voulue:
•utilise un solution contenant un ligand competitif •on change: pH, temp ou force ionique......qui destabilise le complexe proteine-ligand facilement eluableChromatographie d'Immunoaffinité
•Anticorps monoclonaux peuvent etre attachées à la colonne •Seront liées seulemnt les proteins vers les quelles les AC ont eté dirigésInconvenients
•-difficile d'obtenir des AC monoclonaux •-conditions difficiles pour detacher la protein liéeDialyse
•Dialyse-un process qui separe les molecules selon la taille en utilisant des membranes semipermeables contenant des pores •Pores permettent aux solvants, sels et les petits métabolites de diffuser mais bloquent les grosses molecules. •Le Cellophane (cellulose acetate) est le materiau le plus utiliséUtilisation de la dialyse pour separer les
petites et grosses molecules.Page 139
quotesdbs_dbs29.pdfusesText_35[PDF] chromatographie dexclusion exercice corrigé
[PDF] volume hydrodynamique
[PDF] chromatographie par perméation de gel (gpc)
[PDF] exercice chromatographie corrigé pdf
[PDF] qcm sur la chromatographie
[PDF] qcm chromatographie chimie analytique
[PDF] qcm chromatographie phase gazeuse
[PDF] exercices acides aminés biochimie
[PDF] qcm chromatographie pdf
[PDF] ionisation de l'histidine
[PDF] calcul phi acide aminé
[PDF] ionisation des acides aminés cours
[PDF] méthode de dosage des acides aminés
[PDF] 20 acides aminés tableau
