 Chromatographie par filtration sur gel
Chromatographie par filtration sur gel
La chromatographie par filtration sur gel dite aussi chromatographie d'exclusion - diffusion est une technique qui permet une séparation simple et rapide
 Guide to Gel Filtration or Size Exclusion Chromatography
Guide to Gel Filtration or Size Exclusion Chromatography
Gel Filtration. Gel Filtration also called size-exclusion chromatography can be used for protein. DNA purification buffer exchange
 Gel Filtration Handbook
Gel Filtration Handbook
purified by a combination of affinity chromatography and gel filtration. The antibody was captured by affinity chromatography using MabSelect™. Gel
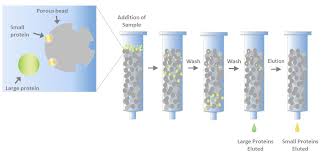 Gel Filtration Chromatography Protocol Utilizing Plain and Cross
Gel Filtration Chromatography Protocol Utilizing Plain and Cross
30 nov. 2018 Beads can be used in column or batch format. Figure 1. Overview of size-exclusion chromatography (also called gel filtration). In this assay.
 La filtration sur gel moldculaire suivant la technique de la
La filtration sur gel moldculaire suivant la technique de la
La filtration sur gel moldculaire suivant la technique de la chromatographie en couche mince est d'origine r'kente; elk fut mise au point par DETERMANN~
 Chromatography of Trypsin and Its Derivatives
Chromatography of Trypsin and Its Derivatives
desalting by gel filtration before lyophilization. Chromatography of Trypsin Derivatives-A number of deriva- tives of trypsin were also conveniently.
 Chromatographic Separation of Milk Proteins: A Review1
Chromatographic Separation of Milk Proteins: A Review1
Ion exchange chromatography and gel filtration have made possible the isolation and purification of many previously unrecognized milk proteins and must now be
 Selection guide
Selection guide
Size exclusion chromatography (SEC) also called gel filtration (GF)
 Gel Filtration Molecular Weight Markers (MWGF200) - Technical
Gel Filtration Molecular Weight Markers (MWGF200) - Technical
Product Description. Gel filtration chromatography is an established method for determining the size and molecular mass of proteins.
 Size Exclusion Chromatography Principles and Methods
Size Exclusion Chromatography Principles and Methods
Size exclusion chromatography (SEC) also called gel filtration (GF). Charge. Ion exchange chromatography (IEX). Biorecognition (ligand specificity). Affinity
 [PDF] 2-Chromatographiepdf
[PDF] 2-Chromatographiepdf
les interactions ioniques (Chromatographie par échange d'ions) - la taille (Chromatographie par gel-filtration) - la spécificité (Chromatographie
 [PDF] Chromatographie sur Colonne
[PDF] Chromatographie sur Colonne
d'interagir avec le sproteines par differentes methodes – Exchan ge d'Ions – Hydrophobic – Gel de filtration – Affinité
 [PDF] le guide pour une chromatographie dexclusion stérique réussie
[PDF] le guide pour une chromatographie dexclusion stérique réussie
connue sous le nom de chromatographie d'exclusion stérique (SEC) Contrairement Échantillon : mélange d'étalons de filtration sur gel BioRad
 59s - Filtration sur gel malQculaire en couche mince des venins de
59s - Filtration sur gel malQculaire en couche mince des venins de
La filtration sur gel moldculaire suivant la technique de la chromatographie en couche mince est d'origine r'kente; elk fut mise au point par DETERMANN~
 [PDF] Techniques dextraction et de caractérisation dune protéine
[PDF] Techniques dextraction et de caractérisation dune protéine
La chromatographie d'exclusion moléculaire également appelée gel- filtration Celte méthode sépare des protéines selon leur taille La colonne
 [PDF] Méthodes danalyse et de séparation des peptides et protéines
[PDF] Méthodes danalyse et de séparation des peptides et protéines
30 jan 2021 · ?La chromatographie d'exclusion moléculaire (filtration sur gel) sépare en fonction de la taille ?La chromatographie échangeuse d'ions
 [PDF] Chapitre 1 : Techniques Chromatographiques - univ-oeb
[PDF] Chapitre 1 : Techniques Chromatographiques - univ-oeb
appelée chromatographie d'exclusion tamisage moléculaire gel-filtration perméation de gel La phase stationnaire est un solide poreux : les
 [PDF] Chromatographie par filtration sur gel - biotechnologieseducation
[PDF] Chromatographie par filtration sur gel - biotechnologieseducation
La chromatographie par filtration sur gel dite aussi chromatographie d'exclusion - diffusion est une technique qui permet une séparation simple et rapide
 [PDF] Gel Filtration Chromatography
[PDF] Gel Filtration Chromatography
The objective of this experiment is for students to learn the principles of gel filtration chromatography by separating of two substance according to the
 Chromatographie par filtration sur gel - PDF Free Download
Chromatographie par filtration sur gel - PDF Free Download
1 MANIPULATION ff 2 Chromatographie par filtration sur gel Etalonnage de la colonne Détermination de la masse molaire apparente d'une protéine La
 [PDF] Gel Filtration
[PDF] Gel Filtration
Gel Filtration Principles and Methods 18-1022-18 Reversed Phase Chromatography Principles and Methods 18-1134-16 Expanded Bed Adsorption
 (PDF) Gel Filtration Chromatography - ResearchGate
(PDF) Gel Filtration Chromatography - ResearchGate
23 nov 2022 · PDF Apart from finding multitudes of applications in chemical medicinal and pharmaceutical research gel filtration chromatography (GFC)
 (PDF) Gel Filtration Chromatography - ResearchGate
(PDF) Gel Filtration Chromatography - ResearchGate
16 jan 2019 · PDF Gel Filtration Chromatography technique Find read and cite all the research you need on ResearchGate
 [PDF] Chromatographie sur Colonne
[PDF] Chromatographie sur Colonne
Ion exchange chromatography • L'echangeur d'ions contient des groupes chargés Gel filtration chromatography ?Chromatographie sur Gel de filtration
 [PDF] Initiation à la chromatographie sur gel dexclusion-diffusion
[PDF] Initiation à la chromatographie sur gel dexclusion-diffusion
Initiation à la chromatographie sur gel d'exclusion-diffusion 1 Dessalage d'une solution protéique par chromatographie d'exclusion-diffusion
 Chromatographie : introduction - 123bionet
Chromatographie : introduction - 123bionet
Ce type de chromatographie est encore appelé : tamisage moléculaire gel-filtration ou perméation de gel Principe : Cette technique permet la séparation des
Quels sont les 2 rôles de la chromatographie ?
La chromatographie peut être analytique (visant à l'identification des substances présentes) ou préparative (visant à la séparation des constituants d'un mélange).Quel est le principe de la chromatographie ?
La chromatographie est une technique séparative analytique et/ou préparative. Elle consiste à faire migrer les constituants à séparer sur une phase stationnaire immobile, à l'aide d'une phase mobile, liquide ou gazeuse, de nature différente.Comment calculer le volume d'élution ?
Une molécule totalement incluse sera éluée avec un volume d'élution V* = Vm + Vi, où Vi est le volume d'eau interne aux granules de gel (voir plus bas). Les solutés sont donc élués dans l'ordre inverse des masses moléculaires (voir figure ci- dessous).- Un gel de filtration déterminé présente a un domaine de fractionnement (Fractionation Range) spécifique (exprimé en termes de masse moléculaire) à l'intérieur duquel les protéines vont prendre, pour sortir du gel, un temps proportionnel à leur taille, donc à leur poids.
![[PDF] Méthodes danalyse et de séparation des peptides et protéines [PDF] Méthodes danalyse et de séparation des peptides et protéines](https://pdfprof.com/Listes/17/30896-17methodes_de_separation_des_peptides-proteines.pdf.pdf.jpg)
30/01/2021
1UniǀersitĠ d'Alger 1 Banyoucef
Benkhedda
Faculté des Sciences
Département SNV
2ème année SNV (S3)
Module: Biochimie
Année universitaire: 2020/2021
MĠthodes d'analyse et de sĠparation des peptides et protéines MĠthodes d'analyse et sĠparation des protĠines ͗ BUTYLe but des techniques de séparation et
quantification des protéines : YCes méthode sont utilisées en recherche pour cibles thérapeutiques YMais également en analyse biologique de routine pour la recherche de paramètres perturbés chez les patients.30/01/2021
2Méthodes de séparation des protéines :
MĠthodes d'analyse et de sĠparation des
peptides-protéinesElectrophorèse:
¾Dans des conditions non dénaturantes
¾Dans des conditions dénaturantes
Méthodes Chromatographique
¾-Chromatographie d'edžclusion molĠculaire¾-Chromatographie échangueses d'ions
¾-chromatographie d'affinitĠ
Combinaisons de séparation identification et quantification des protéines MĠthodes d'analyse et sĠparation des protĠines ͗I- Chromatographie
La chromatographie est une technique de séparation des constituants d'un mélange dans laquelle interviennent des phénomènes d'adsorption et de partage. Le mécanisme général correspond à l'entraînement de ces constituants par une phase mobile (liquide) le long d'une phase stationnaire ou fixe (solide, gel de silice sur plaque aluminium par exemple) contenue dans une colonne. Le solvant de chromatographie de la phase mobile déposé en haut de colonne va descendre par capillarité dans la phase stationnaire entraînant avec lui les composants protéiques. Selon leur hydrophilie, pHi ou encore selon leur P.M ils migreront plus ou moins vite dans la phase fixe.30/01/2021
3 Les techniques de chromatographie permettent la séparation des molécules en fonction de leurs propriétés physicochimiques : ¾La chromatographie d'edžclusion moléculaire (filtration sur gel) sépare en fonction de la taille. ¾La chromatographie échangeuse d'ions sépare en fonction de la charge. ¾La chromatographie d'affinité sépare en fonction de la structure/ séquence.Méthodes de séparation des protéines :
Lors de la chromatographie d'edžclusion moléculaire, les molécules sont séparées de la plus grande à la plus petite en fonction de leur taille moléculaire en solution. Les molécules de très grande taille sont exclues en premier de la phase stationnaire. Les molécules de plus petite taille pénètrent dans les pores à des degrés divers en fonction de leur taille. Les molécules les plus petites diffusant le plus en profondeur dans la structure des pores et sont éluées en dernier. MĠthodes d'analyse et sĠparation des protĠines ͗ I-1- La chromatographie d'edžclusion molĠculaire (gel filtration)Une bille de la phase stationnaire
30/01/2021
4 Dans une chromatographie échangeuse d'ions, des groupes fonctionnels capables de se dissocier sont fixés à la résine. Ce sont habituellement des groupes sulfonate (SO3-: échange de cation) ou ammonium quaternaire (-N (R)3+: échange d'anions). Avec une résine échangeuse d'anions , les molécules chargées négativement restent fixées sur les billes, et les molécules chargées positivement sont éluées. Avec une résine échangeuse de cations, c'est le contraire. MĠthodes d'analyse et sĠparation des protĠines ͗ I-2-La chromatographie Ġchangeuse d'ions (cf. Acides aminĠs) MĠthodes d'analyse et sĠparation des protĠines ͗I-2-La chromatographie Ġchangeuse d'ions
I-2-1-La chromatographie échangeuse de cations
30/01/2021
5 MĠthodes d'analyse et sĠparation des protĠines ͗I-2-La chromatographie Ġchangeuse d'ions
I-2-2-La chromatographie Ġchangeuse d'anions
MĠthodes d'analyse et sĠparation des protĠines ͗I-2-La chromatographie Ġchangeuse d'ions
Choix du type d'échangeur d'ions en fonction du pI de la protéine à séparer et du pH du tamponConsidérons une protéine de pI = 5 :
si le pH du tampon utilisé pour la chromatographie est inférieur au pI de la protéine (zone bleue), celle-ci est chargée positivement ; il faut utiliser un échangeur de cations ; si le pH du tampon utilisé pour la chromatographie est supérieur au pI de la protéine (zone rouge), celle-ci est chargée négativement ; il faut utiliser un échangeur d'anions.30/01/2021
6 Lors de la chromatographie un ligand ayant la propriété de fixer spécifiquement une molécule ou un groupe de molécule est lié de façon covalente à la phase solide. Ainsi au moment du chargement de la colonne, les composés qui ont une affinité pour le ligand sont fixés alors que les impuretés sont éliminées. Par la suite, les composés sont élués avec un solvant dont les caractéristiques chimiques favorisent leur dissociation avec le ligand . MĠthodes d'analyse et sĠparation des protĠines ͗I-3-La chromatographie d'affinitĠ
L'Ġlectrophorğse permet de séparer des solutés chargés par migration dans un champs électrique. La migration dépend de la charge de la molécule, de sa taille et -Electrophorèse en condition non dénaturante -Electrophorèse en condition dénaturante MĠthodes d'analyse et sĠparation des protĠines ͗II-L'Ġlectrophorğse
30/01/2021
7Méthodes de séparation des protéines :
II-L'Ġlectrophorğse
II-1. L'électrophorèse en conditions non dénaturantes les molécules sont séparées dans leur état natif. Plus la charge est importante, plus la vitesse de migration sera importante. selon le signe de la charge native, les molécules pourront migrer vers l'anode (molécules chargées négativement) ou vers la cathode (molécules chargées positivement).et que pour les protéines il convient donc de faire le dépôt à mi-chemin des deux électrodes.
les protéines conservent leur structure "native" (structure tertiaire, quaternaire). Elles conservent donc a priori leur activité, qui pourra être révélée dans le gel. MĠthodes d'analyse et sĠparation des protĠines ͗II-L'Ġlectrophorğse
II-1. L'électrophorèse en conditions non dénaturantes30/01/2021
8 II-2. L'électrophorèse en conditions dénaturantes MĠthodes d'analyse et sĠparation des protĠines ͗II-L'Ġlectrophorğse
Les molécules sont soumises à un traitement dénaturant préalablement à leurséparation électrophorétique, détruisant la structure tridimensionnelle native. Il existe
différentes méthodes pour dénaturer les molécules. Plusieurs conditions peuvent causer la dénaturation des protéines :Chaleur
pH : l'acidité ou l'alcalinité extrême Solvant : le changement du solvant peut modifier la structure tertiaire.Présence de détergents : Exemple SDS
Le sodium-dodecyl-sulfate est un détergent très puissant, très hydrophobe. Il dénature la protéine
qui rompt les liaisons non covalentes. Un complexe SDS - protéine dénaturée se forme et comporte une charge négative et seul le poids moléculaire apparait déterminant. MĠthodes d'analyse et sĠparation des protĠines ͗II-L'Ġlectrophorğse
II-2. L'électrophorèse en conditions dénaturantes : SDS-PAGE L'Ġlectrophorğse SDS-PAGE (électrophorèse en gel de polyacrylamide contenant du dodécysulfate de sodium) est une technique consistant à faire migrer des protéines dans un gel, sous l'influence d'un champ électrique, permettant ainsi leur séparation.30/01/2021
9Afin de conforter l'effet rĠǀersible du SDS , du mercapto-éthanol est ajouté pour rompre les
ponts disulfures. MĠthodes d'analyse et sĠparation des protĠines ͗II-L'Ġlectrophorğse
II-2. L'électrophorèse en conditions dénaturantes : SDS-PAGE Le gel contient des mailles et peut donc jouer ainsi un rôle de tamis : le gel freine les protéines proportionnellement à leur taille (PM). Les protéines les plus grosses restent proches de leur point de dépôt alors que les petites protéines migrent très loin. II-2. L'électrophorèse en conditions dénaturantes : SDS PAGE MĠthodes d'analyse et sĠparation des protĠines ͗II-L'Ġlectrophorğse
30/01/2021
10Remarque :
À forte concentration, l'urée peut constituer lui aussi un agent hydrogène (principales liaisons de faibles énergies responsables du maintien des structures secondaires, tertiaires et quaternaires des protéines). MĠthodes d'analyse et sĠparation des protĠines ͗II-L'Ġlectrophorğse
MĠthodes d'analyse et sĠparation des protĠines ͗II-L'Ġlectrophorğse
II-3- Révélation des protéines après séparation électrophorètiqueLorsque les protéines ont été séparées, leur visualisation peut être effectuée en les
colorant directement (Bleu de Coomassie ou nitrate d'argent). Cette coloration permet de visualiser toutes les protéines. Révélation électrophorèse au bleu de Coomassie RĠǀĠlation Ġlectrophorğse au nitrate d'argentquotesdbs_dbs29.pdfusesText_35[PDF] chromatographie dexclusion exercice corrigé
[PDF] volume hydrodynamique
[PDF] chromatographie par perméation de gel (gpc)
[PDF] exercice chromatographie corrigé pdf
[PDF] qcm sur la chromatographie
[PDF] qcm chromatographie chimie analytique
[PDF] qcm chromatographie phase gazeuse
[PDF] exercices acides aminés biochimie
[PDF] qcm chromatographie pdf
[PDF] ionisation de l'histidine
[PDF] calcul phi acide aminé
[PDF] ionisation des acides aminés cours
[PDF] méthode de dosage des acides aminés
[PDF] 20 acides aminés tableau
