 Plan du cours
Plan du cours
nitrate chloride
 Chromatographie Ionique
Chromatographie Ionique
Principe de la mesure : Le principe de la chromatographie ionique est basé sur les propriétés des résines échangeuses d'ions qui permettent une fixation
 La chromatographie ionique : - une nouvelle technique pour l
La chromatographie ionique : - une nouvelle technique pour l
éluant une vanne d'injection
 Développement analytique en chromatographie ionique couplée à
Développement analytique en chromatographie ionique couplée à
Dec 15 2022 PRINCIPE DE LA CHROMATOGRAPHIE IONIQUE. En chromatographie ionique
 Cours de Chromatographie
Cours de Chromatographie
➢ La phase stationnaire a des propriétés d'échanges d'ions. ➢ Présence de groupements acide ou basique permettant l'échange de certains de leurs ions avec
 Diapositive 1
Diapositive 1
La chromatographie ionique ou. Chromatographie d'échange d'ions. Page 70. Mécanisme de séparation Principe d'un dispositif de dérivation postcolonne. Page 164 ...
 Untitled
Untitled
Principe. La chromatographie ionique est une technique séparative et d'analyse d'espèces ioniques inorganiques ou organiques en solution. La séparation se
 Les techniques Chromatographiques 1.1. Introduction 1.3. Historique
Les techniques Chromatographiques 1.1. Introduction 1.3. Historique
D. 2. Le Principe de la chromatographie d'exclusion. Cette technique La phase stationnaire dans la chromatographie ionique est une résine (polymère insoluble.
 CERTIFICAT DETUDES SUPERIEURES DAGRONOMIE
CERTIFICAT DETUDES SUPERIEURES DAGRONOMIE
METHODOLOGIE D'EXTRACTION ET DOSAGE PAR. CHROMATOGRAPHIE IONIQUE DE L'OXALATE DE CALCIUM. EN SOLS CALCAIRES ET DANS LE MICROENVIRONNEMENT DE. RACINES
 Brochure: EU Training Courses 2020 – The Key to Success for Your
Brochure: EU Training Courses 2020 – The Key to Success for Your
– Principe de l'échange ionique et de la chimie des colonnes Familiarisation aux bonnes pratiques et à l'entretien des systèmes de Chromatographie Ionique.
 Plan du cours
Plan du cours
Chromatographie ionique (Ionic chromatography). ? Spectrométrie UV/Vis (UV/Vis Spectrometry). ? Electrodes ioniques spécifiques (Ion-Selective Electrodes)
 Chromatographie Ionique
Chromatographie Ionique
Le principe de la chromatographie ionique est basé sur les propriétés des résines échangeuses d'ions qui permettent une fixation sélective des anions ou des
 2-Chromatographie.pdf
2-Chromatographie.pdf
les interactions ioniques (Chromatographie par échange d'ions). - la taille (Chromatographie par gel-filtration). - la spécificité (Chromatographie
 La chromatographie ionique : - une nouvelle technique pour l
La chromatographie ionique : - une nouvelle technique pour l
éluant une vanne d'injection
 Chromatographie
Chromatographie
La chromatographie par échange d'ions ou chromatographie ionique : Rq.: éviter d'interrompre une chromatographie en cours.
 Présentation PowerPoint
Présentation PowerPoint
Cours Méthodes D'analyse Biochimique L3. Dr TALHI
 MA. 315 – CNO 1.1 Détermination des cyanates: méthode par
MA. 315 – CNO 1.1 Détermination des cyanates: méthode par
1 févr. 2005 cours. Ce document doit être cité de la façon suivante : ... Détermination des cyanates: méthode par chromatographie ionique MA. 315 – CNO.
 Mr OUNNAS Sahraoui
Mr OUNNAS Sahraoui
2-Principe de La Chromatographie Ionique «CI»: La Chromatographie ionique est une technique analytique à haute performance (HPLC) mais elle a des
 Appareil de Chromatographie Ionique Portable PIA-1000 de
Appareil de Chromatographie Ionique Portable PIA-1000 de
Le principe repose sur les différences d'affinité des ions pour un substrat fonctionnalisé (la résine échangeuse d'ions) en présence d'une phase liquide.
 Polycopié du Cours: Techniques dextraction de purification et de
Polycopié du Cours: Techniques dextraction de purification et de
1. Chromatographie d'exclusion stérique (filtration sur gel ou tamisage moléculaire). 3. 4. 1. 2. Chromatographie échangeuse d'ions……
 [PDF] Chromatographie Ionique
[PDF] Chromatographie Ionique
Le principe de la chromatographie ionique est basé sur les propriétés des résines échangeuses d'ions qui permettent une fixation sélective des anions ou des
 [PDF] Plan du cours
[PDF] Plan du cours
Plan du cours Chromatographie ionique (Ionic chromatography) ? Spectrométrie UV/Vis (UV/Vis B) Chromatographie ionique avec suppression chimique
 [PDF] La chromatographie ionique - Société Chimique de France
[PDF] La chromatographie ionique - Société Chimique de France
La chromatographie ionique (C I ) est une nouvelle technique de chromatographie liquide réalisant le couplage échange d'ions- conductimétrie Cette méthode
 [PDF] La chromatographie ionique - Horizon IRD
[PDF] La chromatographie ionique - Horizon IRD
En chromatographie ionique les vitesses de migration sont fonction principalement de la taille des ions et de leur charge·
 [PDF] LES CHROMATOGRAPHIES
[PDF] LES CHROMATOGRAPHIES
La chromatographie ionique (CI) est une technique analytique qui permet l'analyse qualitative (par séparation des espèces présentes) et quantitative des
 [PDF] Chromatographie ionique pdf - Squarespace
[PDF] Chromatographie ionique pdf - Squarespace
Principe Chromatogramme ionique affichant la séparation des anions La chromatographie par échange d'ions sépare les molécules en fonction de leurs groupes
 [PDF] Evolution de la chromatographie ionique
[PDF] Evolution de la chromatographie ionique
Les évolutions des détecteurs d'absorbance UV et ampérométriques ces dernières décennies contribuent au développement de la chromatographie liquide comme
 [PDF] Chromatographie - L3 Chimie Dijon
[PDF] Chromatographie - L3 Chimie Dijon
La chromatographie par échange d'ions ou chromatographie ionique : la phase stationnaire est une résine échangeuse d'ions (polymère porteur de groupements
 [PDF] es dions - Lavoisierfr
[PDF] es dions - Lavoisierfr
graphie ionique présente suffisamment de différences avec la chromatographie liquide traditionnelle pour justifier un cours dédié
Quel est le principe de la chromatographie d'échange d'ions ?
Le principe de la chromatographie ionique est basé sur les propriétés des résines échangeuses d'ions qui permettent une fixation sélective des anions ou des cations présents dans une solution. Sur la résine échangeuse d'ions conditionnée sous forme d'une colonne chromatographie circule en permanence un éluant.Quelles sont les étapes à réaliser pour effectuer une chromatographie d'échange d'ions ?
Chromatographie d'échange ionique est un processus en deux étapes. Dans un premier temps, l'échantillon est chargé sur la colonne dans un tampon de charge. La liaison de l'échantillon chargée à la résine de colonne est basée sur des interactions ioniques de la résine pour attirer l'échantillon de charge opposée.Quels sont les différents types de chromatographie ?
Présentation de la technique.La chromatographie d'exclusion.La chromatographie échangeuse d'ions.La chromatographie de partage. Principe. La chromatographie de partage en phase gazeuse. La HPLC (chromatographie liquide de haute performance)La chromatographie d'affinitéConclusion.- La chromatographie est une méthode physico-chimique qui sert à séparer les différentes substances présentes dans un mélange (échantillon en phase homogène liquide ou gazeuse).
![[PDF] Chromatographie - L3 Chimie Dijon [PDF] Chromatographie - L3 Chimie Dijon](https://pdfprof.com/Listes/17/30914-17CM_Denat_2010_Chromatographie.pdf.pdf.jpg)
Chromatographie
Chromatographie
Pr. Franck DENAT
ICMUB UMR 5260
9, Av. Alain Savary
BP 47870 21078 Dijon
Franck.Denat@u-bourgogne.fr
Chromatographie
Chromatographie
I. Généralités.
Méthode de séparation des constituants d'un mélange. Applications: Identification, dosage (quantification), purification.Quelques noms et dates :
- 1903 : mise en évidence par Mikhail TSWETT, botaniste russe - 1931 (KUHN et LEDERER) : chromatographie sur colonne (chromatographie liquide- solide CLS) - 1938 (IZMAILOV et SCRAIBER) : chromatographie sur couche mince (CCM ou TLC), TAYLOR et UREY : chromatographie par échange d'ions - 1941 (MARTIN et SYNGE, Nobel en 1952) : concept de chromatographie gaz-liquide, chromatographie de partage liquide-liquide - 1952 : développement pratique de la chromatographie gaz-liquide - 1955 : 1 er chromatographe gaz-liquide sur le marché (chromatographie en phase gazeuse : CPG ou GC) - 1965 (HALASZ, HORVATH) : Chromatographie Liquide Haute Performance (CLHP ou HPLC)Références :
- F. Rouessac et A. Rouessac. Analyse Chimique. Méthodes et techniques instrumentales modernes, 6ème édition (Dunod) - D.A. Skoog, D.M. West, F.J. Holler. Chimie analytique (De Boeck).I. Généralités.
I. 1. Principe :
Le principe repose sur l'équilibre de concentrations des composés présents entre deux phases en contact : la phase stationnaire et la phase mobile (gaz ou liquide) qui se déplace. La séparation est basée sur l'entraînement différentiel des constituants du mélange. Ces derniers parcourent la phase stationnaire avec des temps proportionnelsà leurs propriétés intrinsèques (taille, structure, ...) ou à leur affinité avec la phase
stationnaire (polarité, ...). K = C S /C MK : Coefficient de distribution
C S : Concentration de l'analyte A dans la phase stationnaire C M : Concentration de l'analyte A dans la phase mobile Chromatographie : partition phase stationnaire - phase mobile Extraction : partition entre deux phases liquides non miscibles Cristallisation : partition entre phase liquide - phase cristalline Distillation : partition entre phase liquide - phase gazeuse Sublimation : partition entre phase solide - phase gazeuse A phase mobile A phase stationnaire I. 2. Classification des méthodes chromatographiques : On distingue les différentes méthodes chromatographiques selon la nature des phases. Phase stationnaire : - dans une colonne au travers de laquelle progresse la phase mobile par gravité ou sous l'action d'une différence de pression G chromatographie sur colonne - sur une surface plane G chromatographie sur couche mince (CCM) Phase mobile : phase qui se déplace sur ou à travers la phase stationnaire, entraînant avec elle l'analyte. Le processus d'entraînement de cet analyte est appelé élution. La phase mobile peut être un liquide ou un gaz.I.2.1. Chromatographies en phase liquide (CPL)
La phase mobile est un liquide. On distingue:
- Les chromatographies de partage : - La chromatographie liquide-liquide (CLL) ou chromatographie de partage :la phase stationnaire est un liquide immobilisé sur un support solide inerte : soit imprégnée
dans un solide poreux (risques de lessivage), soit greffée sur le solide (phase greffée). La séparation repose sur le coefficient de partage du soluté dans les deux phases liquides. - La chromatographie d'exclusion, ou perméation de gel, ou tamisage moléculaire : la phase stationnaire est un solide poreux : les grosses particules sont exclues de la phase fixe, les petites particules incluses diffusent dans les pores du gel et sont donc retardés. -Les chromatographies d'adsorption : - La chromatographie liquide-solide (CLS) ou chromatographie d'adsorption (la plus ancienne et la plus générale) : la phase stationnaire est un adsorbant solide polaire (silice ou alumine) : chromatographie sur colonne ou CCM. L'analyte adhère à la phase stationnaire par physisorption etchimisorption G coefficient d'adsorption. La phase stationnaire peut être modifiée pour être
apolaire : chromatographie d'adsorption en phase inverse. -Les chromatographies d'adsorption : - La chromatographie par échange d'ions ou chromatographie ionique : la phase stationnaire est une résine échangeuse d'ions (polymère porteur de groupements ionisés, négativement pour séparer des cations, positivement pour séparer des anions) : interactions électrostatiques. - La chromatographie d'affinité : la phase stationnaire est ici un substrat inerte sur lequel est greffé un "effecteur" quiprésente une affinité pour un soluté de l'échantillon à analyser (affinité enzyme-substrat,
ligand-récepteur, antigène-anticorps).I.2.2. Chromatographies en phase gazeuse (CPG)
La phase mobile est un gaz vecteur. On distingue : - chromatographie de partage : - La chromatographie gaz-liquide : la phase stationnaire est un liquide immobilisé sur un support solide par imprégnation ou par greffage. - chromatographie d'adsorption : - La chromatographie gaz-solide : la phase stationnaire est un solide poreux, réservé à l'analyse de mélanges de gaz ou de liquides à bas points d'ébullition. Eventuellement, la phase mobile peut être un fluide à l'état supercritique (ex CO 2à 50°C et
150 bars)
I.3. Choix de la technique :
Les différentes techniques sont complémentaires plutôt que concurrentes.Le choix de l'une ou l'autre dépend :
- de la nature du soluté : gaz, liquide volatil, liquide peu volatil, solide, macromolécule, espèce organique, polaire, ionique,... - du but de l'analyse : identification de composants d'un mélange, nécessité ou non de "coupler" la chromatographie avec une méthode spectroscopique ou avec la spectrométrie de masse (CPG/SM ou GC/MS), contrôle de pureté, purification de produits (colonnes préparatives), suivi de réaction en continu pour optimiser des paramètres, dosages (quantification)...II. Chromatogramme.
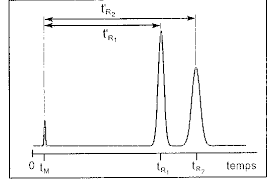
Diagramme montrant l'évolution du signal du détecteur (÷ à la concentration en soluté) en
fonction du temps d'élution (plus rarement du volume d'élution)Chromatogramme :
Elution : entraînement d'un soluté à travers la phase stationnaire par le mouvement de la phase mobile. En CLS (colonne ou CCM), la phase mobile peut être appelée éluantL'analyse du chromatogramme permet une analyse :
-qualitative : identification / position du pic -quantitative : aire des pics t 0 : début de l'injection V m : volume mort de la colonne t m : temps mort V e : volume d'élution ( de rétention, V r d'un composé t r : temps de rétention ( d'élution, t e ) d'un composé V e (volume d'élution) = d (débit) x t (temps) V e ' : volume d'élution réduit (V e = V e ' + V m t r ' : temps de rétention réduit (t r = t r ' + t m W b : largeur du pic à la base (ω) W h : largeur du pic à mi-hauteur (δ) Facteur de rétention (ou facteur de capacité) k : k = = t r t m t r -t m t m k = = = m S m M C S V S C M V M V S V M KK : coefficient de distribution
m S : masse de soluté dans la phase stationnaire m M : masse de soluté dans la phase mobile Idéalement 1Approche ancienne mais toujours utilisée : le phénomène de migration qui est en réalité
dynamique et continu est considéré comme une suite d'étapes distinctes (équilibres successifs). On considère alors qu'une colonne de longueur utile L est composée de N petits disques fictifs superposés (plateaux théoriques) de même hauteur H. H = L NL : longueur utile de la colonne
N : nombre de plateaux théoriques : 100 - 10
6 H : hauteur équivalente à un plateau théorique (HEPT) : 1 cm - 10 µm Une colonne sera d'autant plus efficace que N est grand (L grand) et H est petit.On peut montrer que :
2 L Lω 4t RH = et σ =
Donc H =
Lω 2 16t R 2 et N = 16(t R 2 ou N = 5,545 (t R 2 III.2. Facteur de séparation entre deux solutés (facteur de sélectivité) k 2 k 1 t' R2 t' R1III.3. Facteur de résolution
R = 2 t R2 - t R1 1 2On peut montrer que R est ÷
III.4. Effet de la vitesse d'élution sur l'efficacité de la colonne Mis en évidence par Van Deemter G équation simplifiée :H = A + + Cu
B u u : vitesse linéaire moyenne d'écoulement de la phase mobile (cm/s) (cm) (cm 2 /s) (s) u opt B CAllure de la courbe de Van Deemter en CPG :
A : Coefficient de diffusion turbulente ou terme de remplissageChemins préférentiels dus à la granulométrie de la phase stationnaire (taille et répartition
des particules) G échanges imparfaits entre les phases G perte d'efficacité.A est donc lié au diamètre des particules du support et à l'irrégularité du remplissage.
B : Coefficient de diffusion longitudinale
Diffusion : migration des espèces des régions les plus concentrées vers les régions plus diluées. La vitesse de diffusion est ÷ au coefficient de diffusion. Le coeff. de diffusion est plus important dans les gaz que dans les liquides G phénomène important en CPG (principale cause d'élargissement des pics). B est inversement ÷ à uquotesdbs_dbs29.pdfusesText_35[PDF] chromatographie ionique principe et théorie
[PDF] chromatographie ionique pdf
[PDF] analyse des proteines
[PDF] séparation des protéines par chromatographie
[PDF] séparation des protéines par électrophorèse
[PDF] séparation des acides aminés par chromatographie échangeuse d'ions
[PDF] extraction des pigments chlorophylliens par chromatographie
[PDF] chlorophylle a et b polarité
[PDF] chromatographie d'adsorption sur colonne de silice
[PDF] le paprika est il constitué d un seul pigment
[PDF] chromatographie d'adsorption
[PDF] exercices corrigés chromatographie en phase gazeuse
[PDF] exercice corrigé chromatographie d exclusion
[PDF] exercices corrigés chromatographie liquide
