 Examen Méthodes spectroscopiques 2
Examen Méthodes spectroscopiques 2
16 déc. 2010 Exercice 1 (3 pts – 10min). Il est possible de doser simultanément par spectroscopie UV-‐Visible le cobalt et le nickel dans une.
 TD Ultra-Violet et IR EST (SEMESTRE 2) Filière Génie Biologique
TD Ultra-Violet et IR EST (SEMESTRE 2) Filière Génie Biologique
En déduire sa concentration massique. EXERCICE 12 : Ci-dessous trois spectres (A B et C) d'absorption UV-Visible de la 1
 Correction exercices sur UV-visible Exercices 7- 8- 9*- 25 -26* - 35 p
Correction exercices sur UV-visible Exercices 7- 8- 9*- 25 -26* - 35 p
Séquence III-3: UV-visible. Correction exercices sur UV-visible. Exercices 7- 8- 9*- 25 -26* - 35 p 104-115. Exercice 7-8 p140-105. Exercice 25 p105. Page 2
 EXERCICES DE REVISION : SPECTROMETRIE DABSORPTION
EXERCICES DE REVISION : SPECTROMETRIE DABSORPTION
EXERCICES DE REVISION : SPECTROMETRIE D'ABSORPTION UV VISIBLE
 République Algérienne Démocratique et Populaire Polycopié de
République Algérienne Démocratique et Populaire Polycopié de
Exercices. 37. Résumé des Transitions électroniques et données d'absorption. 42 Spectroscopie UV-Visible. Un schéma de principe d'un spectromètre typique est ...
 Corrigé EVAL1 2014-2015
Corrigé EVAL1 2014-2015
I- Quelles sont les trois règles de sélection en spectroscopie de vibration dans l'infrarouge ? Le spectre UV-visible de cette solution montre une bande à la ...
 Polycopies-En: Spectroscopie Optique et RMN
Polycopies-En: Spectroscopie Optique et RMN
Une série d'exercices corrigés est donnée à la fin de chaque chapitre. Le polycopié est composé de quatre chapitres : • Chapitre I : Rappel sur la structure de
 Chimie et développement durable Partie 1
Chimie et développement durable Partie 1
EXERCICES. Partie 2/ Synthèses chimiques. Fiche 10 : Spectroscopie UV-visible. Exercice 1. Doc 1 : courbe d'absorbance du diiode. Doc 2 : Dosage d'une solution
 EXERCICES ÉPREUVE CHIMIE 1
EXERCICES ÉPREUVE CHIMIE 1
Exercice n°2. L'étude spectroscopique UV-visible d'une solution contenant la molécule A conduit au spectre de la figure 1. La concentration molaire est c = 2
 3. Spectroscopie UV-Visible
3. Spectroscopie UV-Visible
Spectroscopie UV-Visible : Spectroscopie Justifier votre réponse en expliquant le déplacement vers les grandes longueurs d'onde des spectres. 3.4. Exercices ...
 Examen Méthodes spectroscopiques 2
Examen Méthodes spectroscopiques 2
16 déc. 2010 Exercice 2 (toutes les questions sont indépendantes) (5 pts – 30 min) ... En spectroscopie UV-?visible pour mesurer l'absorbance à 500 nm ...
 EXERCICES ÉPREUVE CHIMIE 1
EXERCICES ÉPREUVE CHIMIE 1
Exercice n°2. L'étude spectroscopique UV-visible d'une solution contenant la molécule A conduit au spectre de la figure 1. La concentration molaire est c
 République Algérienne Démocratique et Populaire Polycopié de
République Algérienne Démocratique et Populaire Polycopié de
Spectroscopie UV-Visible. 9. Spectre d'absorption UV-Visible. 11. 4.Transitions électroniques. 13. 4.1 Groupements chromophores. 14. 4.2 La conjugaison.
 EXERCICES DE REVISION : SPECTROMETRIE DABSORPTION
EXERCICES DE REVISION : SPECTROMETRIE DABSORPTION
Spectroscopie UV visible. • Spectroscopie IR. Exercice 1 (Spectre d'absorption du rouge Ponceau). Le rouge Ponceau 4R
 Méthodes danalyses Spectroscopiques
Méthodes danalyses Spectroscopiques
CHAPITRE I : Spectroscopie UV-Visible Corrigé des exercices . ... Une série d'exercices d'application plus un corrigé sont donnés à la fin de.
 TD Ultra-Violet et IR EST (SEMESTRE 2) Filière Génie Biologique
TD Ultra-Violet et IR EST (SEMESTRE 2) Filière Génie Biologique
EXERCICE 5 : On remplit une cuve de 2 mm avec une solution de benzène de concentration 10-5 mol. L-1 ; le spectre UV-Visible de cette solution montre une
 Chimie Analytique- 3ème Année -Département de Pharmacie
Chimie Analytique- 3ème Année -Département de Pharmacie
TD N° 7: Spectroscopie UV-Visible. EXERCICE 1 : Quelles sont toutes les transitions électroniques possibles pour les molécules suivantes :.
 chimie organique
chimie organique
QCM et exercices. 104. Corrigés. 107. Chapitre 6. Spectroscopies IR UV et RMN. 113. ? 1. Notions de spectroscopie. 113. ? 2. Spectroscopies UV-visible et
 Fiche professeur Lanalyse spectrale : spectroscopies IR et RMN
Fiche professeur Lanalyse spectrale : spectroscopies IR et RMN
La spectroscopie infrarouge : un moyen de déterminer les groupes caractéristiques d'une molécule Exploiter des spectres UV-visible. Spectres IR.
 EXERCICE RÉSOLU 2
EXERCICE RÉSOLU 2
Énoncé. On s'intéresse à la réaction des ions cuivrique Cu2+ en solution aqueuse basique (de pH contrôlé) avec une espèce anionique appelée EDTA et
 CHAP 04-ACT EXP Spectro UV-Visible CORRIGE - legtuxorg
CHAP 04-ACT EXP Spectro UV-Visible CORRIGE - legtuxorg
Vérifier par spectroscopie UV-Visible la nature des colorants présents dans un sirop de menthe Estimer la quantité de colorant bleu dans le sirop Matériel et solutions disponibles : Spectrophotomètre Visible (entre 450 et 750 nm) Béchers fioles et pipettes jaugées 2 fioles jaugées de 100 mL 2 fioles jaugées de 50 mL
 Chimie Chapitre 5 Terminale S ANALYSE SPECTRALE EN CHIMIE
Chimie Chapitre 5 Terminale S ANALYSE SPECTRALE EN CHIMIE
1) Faire un schéma de principe d’un spectrophotomètre UV-visible 2) Pourquoi a-t-on choisi de travailler à cette longueur d’onde ? 3) La loi de Beer-Lambert est-elle vérifiée ? 4) Déterminer le coefficient d’absorbance molaire dans ces conditions
 Corrigés exercices UV
Corrigés exercices UV
Thème 3 : Contrôle qualité Séquence III-3: UV-visible Exercice 35 : 1) A :C 2H 6N 2 B : C 7H 8N 2 C : C 12H 10N 2 2) Et 3) Couleur transmise Couleurs absorbées = Couleurs complémentaires de la couleur transmise Longueur d’onde correspondant au max d’absorbance molécules jaune bleu 450 nm A orangé Bleu roi 475 nm B rouge cyan 500 nm C
 spectrometrie absorption uv visible ir
spectrometrie absorption uv visible ir
Exercice 2 (Spectrophotométrie UV visible d’un complexe du cuivre) 1 Définir la transmittance d’un milieu absorbant et donner la relation liant l’absorbance A à la transmittance T 2 Le spectre d’absorption du complexe Cu(NiH 3)4 2+ est représenté ci-dessous Comment choisir la longueur d'onde de travail ? Justifier ce choix
 LPro Spectro 1011 - u-bourgognefr
LPro Spectro 1011 - u-bourgognefr
B En" spectroscopie" UVBvisible" pour" mesurer" l’absorbance" à 250 nm d’un" composé 3- Donner les qualités d’un solvant idéal en spetros opie UV
 Chimie Analytique 3ème Année -Département de Pharmacie
Chimie Analytique 3ème Année -Département de Pharmacie
Chimie Analytique- 3ème Année -Département de Pharmacie - Université Batna2 P r Maghchiche 1 TD N° 7: Spectroscopie UV -Visible EXERCICE 1 : Quelles sont toutes les transitions électroniques possibles pour les molécules suivantes : 1) Méthane ; 2) Ethanol ; 3) Phénol ; 4) Acétylène EXERCICE 2 : 1
 1- Qu'est-ce que la spectroscopie ? 2- Spectroscopie UV-Visible
1- Qu'est-ce que la spectroscopie ? 2- Spectroscopie UV-Visible
Le dosage par spectroscopie UV-visible suppose que les espèces mises en jeu sont colorées 1- A partir du spectre d'absorbtion définir graphiquement ? max 2- établir la courbe d'étalonnage à partir de solution colorées dont on connaît les concentrations
 Analyse spectrale Spectres IR - Labolycée
Analyse spectrale Spectres IR - Labolycée
Les spectroscopies IR (infrarouge) et de RMN (résonance magnétique nucléaire) en sont deux exemples 1 3 1 Donner l’origine des bandes d’absorption 1 et 2 du spectre infrarouge IR (document 1) en exploitant les données du document 2 Accès à la correction
 Spectroscopie Cours Et Exercices By J Michael Hollas
Spectroscopie Cours Et Exercices By J Michael Hollas
Exercices corrigs spectroscopie uv visible pdf Goulotte March 16th 2020 - I exercices SPECTROSCOPIE UV VISIBLE DENYSPierre Frédé rick Exercices spectroscopie et spectre UV visibleCorrigés Un spectre UV visible se décrit en indiquant les valeurs de la longueur Revoir le cours p 94 du livre fiche et faire les exercices corrigés 10 11
 Spectroscopie Cours Et Exercices - Paris Saint-Germain
Spectroscopie Cours Et Exercices - Paris Saint-Germain
Spectroscopie visible UV Chromatographie phase liquide et gazeus Corrigés des parcours en autonomie exercices n° 18 20 23 28 34 et 35''TS CHAPITRE 7 SPECTROSCOPIE UV VISIBLE IR RMN DU PROTON DECEMBER 18TH 2020 - TS INTERFéRENCES COURS PRéPARATION DU TP TS DIFFRACTION DES ONDES COURS PRéPARATION TP TS CHAPITRE 7 SPECTROSCOPIE UV VISIBLE IR
 Spectroscopie Cours Et Exercices By J Michael Hollas
Spectroscopie Cours Et Exercices By J Michael Hollas
Spectroscopie Cours Et Exercices By J Michael Hollas corrigs pdf chimie analytique LA SPECTROSCOPIE INFRAROUGE spectrometrie absorption uv visible ir Spectroscopie Cours et exercices Vegas PDF Free Td corrig Technique spectroscopie 5 EXERCICES CORRIGS SUR LA SPECTROSCOPIE INFRA ROUGE EN TERMINALE S EXERCICES Spectroscopie infra rouge
 Searches related to exercices corrigés spectroscopie uv visible pdf filetype:pdf
Searches related to exercices corrigés spectroscopie uv visible pdf filetype:pdf
Exercices corrigs spectroscopie uv visible pdf Goulotte Cet ouvrage présente les diverses techniques de spectroscopie disponibles aujourd'hui en fournissant les bases théoriques et en en exposant les applications notamment à la détermination des structures et à l'analyse chimique
Qu'est-ce que la spectroscopie UV visible?
- I – SPECTROSCOPIE U.V. VISIBLE. 1) Principe. ? En 1ère S, nous avons vu que les molécules organiques possédant au moins sept doubles liaisons conjuguées sont des espèces de la matière colorée, car elle absorbe des rayonnements dans le domaine du visible ( ? compris entre 400 et 800nm environ).
Qu'est-ce que la spectrophotométrie UV visible?
- La spectrophotométrie uv visible (spectroscopie d’absorption moleculaire) lorsqu’un faisceau lumineux monochromatique (une longueur d’onde fixe) de longueur l et intensité I0traverse une solution (exp bleu de méthylène + eau) les molécules dissoutes vont absorber une quantité de la lumière incidente
Comment fonctionne la spectroscopie d’absorption dans l’UV et le visible?
- • La spectroscopie d’absorption dans l’UV et le visible est une méthode très commune dans les laboratoires. • Elle est basée sur la propriété des molécules d’absorber des radiations lumineuses de longueur d’onde déterminée.
Quels sont les exercices de spectroscopie?
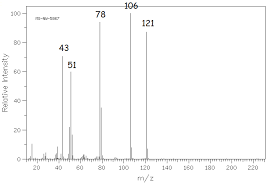
- Exercices spectroscopie Elucider un mécanisme réactionnel A l’obscurité et en présence d’inhibiteurs de radicaux, l’addition électrophile d’acide bromhydrique sur l’acroléine (prop-2-énal) conduit au composé A de formule brute C3H5BrO. Le spectre infra rouge de A présente une bande intense à 1740 cm-1 ; son spectre RMN est le suivant :
Fiche professeur
: spectroscopies IR et RMNThème :
Observer, ondes et matières
Analyse spectrale
Type de ressource :
Documents de formation en spectroscopies
Notions et contenus :
Spectroscopie IR, Spectroscopie RMN
Résumé :
e document est de présenter quelques bases théoriques ainsi que des exemples de spectres à analyser.Plan du document :
Bibliographie et sitographie
La spectroscopie infrarouge : un moyen de déterminerLa spectroscopie RMN
2Bibliographie, sites internet
Pour la théorie :
Vous y trouverez la théorie pour approfondir, ainsi que des exemples de spectres. - HPrépa Chimie 2ème année PC-PC* - André DURUPTHY - Traite de chimie organique VOLLHARDT (théorie simplifiée)- Identification spectrométrique de composés organiques SILVERSTEIN (ouvrage très complet mais théorie
complexe, de nombreux exemples)Bibliothèque de spectres IR et RMN :
- Spectral Database for Organic Compounds (SDBS) : http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi (très utile pour les spectres IR, les spectres RMN sont analysés mais sont de mauvaise
résolution)- Catalogue Sigma Aldrich® : http://www.sigmaaldrich.com/catalog/AdvancedSearchPage.do (spectres RMN de
bonne résolution mais non analysés)Simulateur de spectres RMN :
- http://www.nmrdb.org/predictorBase de données IR par fréquence :
- http://www.unice.fr/cdiec/animations/spectroscopie/infra_rouge/infra_rouge.htm 3L en sein du programme de TS
¾ Dans quel but doit-on présenter cette partie ? Extrait du programme : Observer Analyse spectraleNotions et contenus Compétences exigibles
Spectres UV-visible
espèce colorée.Exploiter des spectres UV-visible.
Spectres IR
correspondant ; détermination de groupes caractéristiques.Mise en évidence de la liaison hydrogène.
Exploiter un spectre IR pour déterminer des groupes caractéristiques Associer un groupe caractéristique à une fonction dans le cas des alcool, aldéhyde, cétone, acide carboxylique, ester, amine, amide. Connaître les règles de nomenclature de ces composés ainsi que celles des alcanes et des alcènes.Spectres RMN du proton
- du déplacement chimique ; - de la multiplicité du signal : règle des (n+1)-uplets. Relier un spectre RMN simple à une molécule organique donnée, Identifier les protons équivalents. Relier la multiplicité du signal au nombre de voisins. Extraire et exploiter des informations sur différents types de spectres et sur leurs utilisations.Cette partie du programme nêtre traitée comme une partie indépendante se suffisant à elle-même.
La théorie associée aux différentes techniques spectroscopiques , on donne aux élèves les moyens
¾ Quelles sont les notions qui doivent être acquises préalablement ? Extrait du programme : Comprendre Structure et transformation de la matièreNotions et contenus Compétences exigibles
Représentation spatiale des molécules
Chiralité : définition, approche historique.Représentation de Cram.
Carbone asymétrique.
Chiralité des acides -aminés.
Énantiomérie, mélange racémique, diastéréoisomérie (Z/E, deux atomes de carbone asymétriques).Conformation ;
conformation la plus stable.Formule topologique des molécules organiques.
Propriétés biologiques et stéréoisomérie. Reconnaître des espèces chirales à partir de leur représentation.Utiliser la représentation de Cram.
e représentation reconnaître si des molécules sont identiques, énantiomères ou diastéréoisomères. Pratiquer une démarche expérimentale pour mettre en évidence des propriétés différentes de diastéréoisomères. simulation, les différentes conformations d'une molécule. Utiliser la représentation topologique des molécules organiques.Extraire et exploiter des informations sur :
- les propriétés biologiques de stéréoisomères, - les conformations de molécules biologiques, stéréoisomérie dans la nature. L conformations des molécules sera nécessaire 4 Extrait du programme : Comprendre Structure et transformation de la matièreNotions et contenus Compétences exigibles
Transformation en chimie organique
Aspect macroscopique :
- Modification de chaîne, modification de groupe caractéristique. - Grandes catégories de réactions en chimie organique : substitution, addition, élimination. Reconnaître les groupes caractéristiques dans les alcool, aldéhyde, cétone, acide carboxylique, ester, amine, amide.Utiliser le
pour en déterminer les groupes caractéristiques et la chaîne carbonée. groupe caractéristique. n, addition, produits. L evenir sur les différentes fonctions associées aux groupescaractéristiques (cf. programme dans la partie analyse spectrale : " Associer un groupe caractéristique à une fonction dans
le cas des alcool, aldéhyde, cétone, acide carboxylique, ester, amine, amide »).¾ Quelles sont les notions en lien qui peuvent être présentées avant ou en parallèle ?
Extrait du programme : Comprendre Energie, matière et rayonnementNotions et contenus Compétences exigibles
Émission et absorption quantiques.
lumineuse.Oscillateur optique : principe du laser.
laser (directivité, monochromaticité, concentration spatiale et temporelle de cole expérimental utilisant un laser comme outil Associer un domaine spectral à la nature de la transition mise en jeu. spectroscopie infrarouge. Mais on peut étudier la spectroscopie IR avec les élèves et autant avoir traité cette partie. Extrait du programme : Agir Synthétiser des molécules, fabriquer de nouveaux matériauxNotions et contenus Compétences exigibles
Stratégie de la synthèse organique
Protocole de synthèse organique :
- identification des réactifs, du solvant, du catalyseur, des produits ; - détermination des quantités des espèces mises en jeu, du réactif limitant ; - choix des paramètres expérimentaux : température, solvant, durée de la réaction, pH ; - choix du montage, de la technique de purification, de - aspects liés à la sécurité ; - coûts. Effectuer une analyse critique de protocoles expérimentaux pour identifier les espèces mises en jeu, leurs quantités et les paramètres expérimentaux. Comparer les avantages et les inconvénients de deux protocoles.Sélectivité en chimie organique
Composé polyfonctionnel : réactif chimiosélectif, protection de fonctions.Extraire et exploiter des informations :
- sur l'utilisation de réactifs chimiosélectifs, peptidique, Pratiquer une démarche expérimentale pour synthétiser une tables fournis.utiliser ces activités expérimentales pour introduire les analyses spectroscopiques comme outil de réponse à des
problématiques telles que la sélectivité en chimie organique. 5 La spectroscopie infrarouge : un moyen de déterminer les groupesI. Principe de la spectroscopie infrarouge
1. Interaction rayonnement-matière
De nombreux points de cette partie théorique ne sont pas utiles pour pouvoir analyser un spectre infrarouge et peuvent
être traités dans la partie " Energie, matière, rayonnement et dualité onde-corpuscule. Certains points (notés en italique) sont hors programme pour des élèves de TS .Cette partie permet de justifier que la spectroscopie infrarouge est liée à des des
molécules. a. Description de la lumière La lumière se comporte dans certains cas comme une onde électromagnétique - Une lumière monochromatique est une onde sinusoïdale de fréquence bien déterminée.Les :
Période :
en s Vitesse : enFréquence :
en (notée aussi en mUne autre grandeur leur sera utile
La lumière se comporte dans certains cas comme si elle était composée de corpuscules : les photons
- Le photon est un corpuscule de masse nulle - Le photon se déplace à la vitesse de la lumière avec la constante de Planck (On parle de dualité onde-corpuscule :
b. le troisième terme est hors programme, mais peut être compris par les élèves) : : énergie électronique.Quantum
(aspect corpusculaire) (aspect ondulatoire) 6 : énergieToutes ces énergies sont quantifiées et la différence entre deux niveaux électroniques, vibrationnels ou rotationnels ne
sont pas du même ordre de grandeur :Figure 1 : Niveaux énergétiques
Ordres de grandeur :
c. Transition de niveaux énergétiques et absorption de rayonnement électromagnétique Une onde électromagnétique de fréquence peut être les deux niveaux énergétiques :On peut déduire des ordres de grandeur précédents les fréquences des rayonnements électromagnétiques absorbés selon le
- Transitions électroniques -visible (spectroscopie UV-visible) Figure 2 : Absorption de rayonnement électromagnétique 7 soit, - Transitions vibrationnelles : ont lieu dans le domaine du proche infrarouge (spectroscopie IR) soit, - Transitions rotationnelles soit, On peut remplir avec les élèves un document du type :Figure 3 : Spectre électromagnétique et transitions associées (extrait du HPrépa PCSI 2ème année)
d. Cas de la spectroscopie infrarougeLa spectroscopie
8Le domaine qui nous intéressera dans le cadre des molécules organiques étudiées est plus restreint :
Remarque :
on devrait donc parler de spectres de rotation-vibration.Figure 4 : transitions rotatio-vibrationnelles
2. les élèves on pourra se contenter de modes de vibration existent. a. Molécule diatomique :¾ Modèle classique : ce modèle peut être présenté aux élèves en parallèle de ce qui est vu en mécanique
On assimile les deux atomes
et unis par une liaison covalente à deux masses et qui seraient reliées par un ressort de constante de raideur . Les masses peuvent osciller autour de leur donnée par la loi de Hooke : , il a absorption (phénomène de résonance) lorsqueOn peut avoir un ordre de grandeur de la fréquence de résonnance pour différentes liaisons classiques ainsi que le nombre
liaison C=C C=OFigure 5 : modélisation de la
liaison covalente 9Tableau 1 : ordres de grandeur des nombres
Remarque : les constantes de raideur des liaisons vont dépendre légèrement du reste de la molécule, on obtient donc un
ordre de grandeur. On pourra comparer ces valeurs à celles données dans les tables
¾ Modèle quantique :
fréquenceAvec :
la fréquence donnée par la loi de Hooke un entier positif ou nul appelé nombre quantique vibrationnelLa transition entre deux niveaux peut se faire si
, on retrouve donc une transition possible si et la b. Molécule polyatomiqueLa situation est beaucoup plus complexe : les différents oscillateurs constitués de deux atomes liés par une liaison
: les vibrations des de vibration indépendants appelés modes normaux.Types de modes normaux :
- Vibrations de déformation angulaire symétrique asymétriqueVibration de déformation
Dans le plan Hors du plan
asymétrique (rotation plane) asymétrique (balancement) symétrique (cisaillement) symétrique (torsion)Figure 5 : exemples des modes de vibration
10 Chaque mode possède sa propre fréquence de résonance.Remarque :
: il existe une règle de sélection de la vibration. - cela justifie les faibles absorptions dues aux doubles liaisons C=C - certaines moléculesExemple :
moment dipolaire qui reste nul : pas il y a variation du moment dipolaire : absorptionFigure 6
c. En conclusion - Les fréquences de vibration de la caractéristiques des molécules dépendent peu du reste de la moléculepermettent alors simplement la reconnaissance de certaines liaisons ou groupes caractéristiques et donc de certaines
fonctions chimiques. - Les spectres infrarouge peuvent parfois être très complexes à cause de apparaissant sur un spectre pour en extraire les informations essentielles et utiles. 11 II. 1. a. AxesVoici le sp 5-hydroxypentan-2-one :
Figure 7
- Labscisses de la droite vers la gauche (de - es est orienté vers le haut et représente la transmittance enRemarques :
- -visible, plus la valeur - On trouve parfois dans la littérature le tableau de valeurs des maxima b. ZonesFigure 8
Zone 1 Zone 2
12 - Zone 1 (entre et ) : on y trouve la plupart des bandes de - Zone 2 (entre et ) : on y trouve la plupart des bandes devibration de déformation (zone souvent difficile à analyser, appelée zone des empreintes digitales)
2. différentesmanières. On peut par exemple leur présenter plusieurs spectres associés à des formules développées de molécules
différentes, de manière des groupes caractéristiques associés trouvées dans la littérature. Nous allons montrer quelques exemples. a. La chaîne carbonéeOn peut présenter des molécules qui diffèrent de par leur fonction chimique mais qui possède la même chaîne carbonée,
Figure 9
Figure 10 propan-1-ol
13Figure 11 -1-amine
Figure 12
Figure 13 -2-one
14Point commun à tous les spectres : entre
etquotesdbs_dbs12.pdfusesText_18[PDF] exercices corrigés stabilité des systèmes asservis
[PDF] exercices corrigés statique du solide
[PDF] exercices corrigés structure des molécules 1ere s
[PDF] exercices corrigés structures de données langage c
[PDF] exercices corrigés suites 1ere es
[PDF] exercices corrigés suites 1ere s
[PDF] exercices corrigés suites arithmético géométriques terminale es
[PDF] exercices corrigés suites arithmétiques géométriques pdf
[PDF] exercices corrigés suites numériques bac pro pdf
[PDF] exercices corrigés suites terminale s pdf
[PDF] exercices corrigés sur fichierprogrammation c
[PDF] exercices corrigés sur l état de rapprochement bancaire pdf
[PDF] exercices corrigés sur l ordonnancement des processus
[PDF] exercices corrigés sur l'échantillonnage des signaux
