Chapitre 1 :Classification périodique des éléments
Chapitre 1 :Classification périodique des éléments
https://www.immae.eu/cours/. Page 2. Chapitre 1 : Classification périodique des éléments. Structure de la matière. Page 2 sur 5. 118? Th. 75.6 ?In. 95. Di. 60 ?
 Chapitre IV : Classification périodique des éléments
Chapitre IV : Classification périodique des éléments
15 avr. 2020 Le tableau périodique actuel classe les éléments par numéro atomique Z croissant. Il diffère peu de la classification selon l'ordre croissant ...
 Chapitre 5 : La classification périodique des éléments
Chapitre 5 : La classification périodique des éléments
A RETENIR : - Dans le tableau périodique des éléments actuel les éléments chimiques sont classés par numéro atomique. (Z) croissant ;.
 Chapitre I - Classification périodique des éléments
Chapitre I - Classification périodique des éléments
Les éléments du syllabus sur lesquels portera le test du comité français des http://www.cayrel.net/?Cours-P1-Mecanique. Page 3. IPHO Lycée Jean Perrin. 3 ...
 Chimie générale
Chimie générale
Lieu du cours. Louvain-la-Neuve. Thèmes abordés. - Structure de l'atome. - Classification périodique des éléments. - Liaisons chimiques. - Structures de Lewis
 1 Classification périodique des éléments
1 Classification périodique des éléments
Présentation d'une case du tableau : Cette présentation est classique mais elle offre à ce stade du cours trop d'informations. En ce qui concerne l'étude du
 Chapitre 9 : La classification périodique des éléments
Chapitre 9 : La classification périodique des éléments
Cet outil est très important pour le chimiste car il lui permet de prévoir le comportement d'un élément chimique au cours d'une réaction. Le tableau périodique.
 Eléments de chimie inorganique et analytique
Eléments de chimie inorganique et analytique
Université catholique de Louvain - Eléments de chimie inorganique et analytique - cours-2022-lchm1231 position dans le tableau de classification périodique. L ...
 CHAPITRE V Classification Périodique des éléments
CHAPITRE V Classification Périodique des éléments
1)- Classification des éléments dans le tableau périodique: couche d incomplète soit à l'état fondamental soit au cours d'une réaction chimique.
 Chapitre 1 :Classification périodique des éléments
Chapitre 1 :Classification périodique des éléments
Conservation de la quantité de ces éléments au cours d'une réaction chimique quelconque. Dalton : La matière est constituée d'atomes. Les éléments chimiques
 Chapitre IV : Classification périodique des éléments
Chapitre IV : Classification périodique des éléments
Le tableau périodique actuel classe les éléments par numéro atomique Z croissant. Il diffère peu de la classification selon l'ordre croissant des masses
 La classification périodique des éléments
La classification périodique des éléments
Chapitre 3 : La classification périodique des éléments. Pierre-Alexis GAUCHARD. Agrégé de chimie Docteur ès sciences. UE1 : Chimie – Chimie physique.
 Lunivers Chapitre 6 : la classification périodique des éléments
Lunivers Chapitre 6 : la classification périodique des éléments
On classe actuellement les éléments chimiques dans un tableau. Le tableau périodique des éléments comporte 112 éléments chimiques connus.
 Chapitre 9 : La classification périodique des éléments
Chapitre 9 : La classification périodique des éléments
Cet outil est très important pour le chimiste car il lui permet de prévoir le comportement d'un élément chimique au cours d'une réaction.
 Chapitre 5 : La classification périodique des éléments
Chapitre 5 : La classification périodique des éléments
En 1869 Mendeleïev est le premier à avoir l'idée de classer les éléments chimiques par « poids » atomiques. (maintenant appelée masse atomique) croissant en s'
 Chapitre II: La classification périodique X
Chapitre II: La classification périodique X
Les éléments d'une même période ont le même nombre quantique principal n. Les éléments appartenant à une même colonne ont généralement la même structure.
 Classification périodique des éléments chimiques
Classification périodique des éléments chimiques
Et avec la croissance du nombre d'éléments chimiques découverts et artificiels au cours des 17ème et 18ème siècles leur ordre et leur organisation selon des
 Architecture de la matière
Architecture de la matière
Chapitre 4.1 : élément et atome. Chapitre 4.2 : la classification périodique des éléments. Chapitre 3 : molécules et solvants. Cours de chimie de première
 [PDF] Chapitre 5 : La classification périodique des éléments - AlloSchool
[PDF] Chapitre 5 : La classification périodique des éléments - AlloSchool
- Dans le tableau périodique des éléments actuel les éléments chimiques sont classés par numéro atomique (Z) croissant ; - Les éléments chimiques dont les
 [PDF] Chapitre 1 :Classification périodique des éléments - Melusine
[PDF] Chapitre 1 :Classification périodique des éléments - Melusine
Mendeleïev réalise une classification pour M croissant en faisant apparaître sur une même ligne des éléments qui ont les mêmes propriétés chimiques Chapitre 1
 [PDF] Chapitre IV : Classification périodique des éléments
[PDF] Chapitre IV : Classification périodique des éléments
15 avr 2020 · Le tableau périodique actuel classe les éléments par numéro atomique Z croissant Il diffère peu de la classification selon l'ordre croissant
 [PDF] Chapitre IV : Classification périodique des éléments
[PDF] Chapitre IV : Classification périodique des éléments
La classification périodique est basée sur la formation de groupes constitués par les éléments possédant des propriétés chimiques analogues On regroupe dans
 [PDF] CHAPITRE V Classification Périodique des éléments
[PDF] CHAPITRE V Classification Périodique des éléments
Chapitre V: Classification Périodique des éléments 69 Sous- couche S p d f 3)- Le nombre quantique magnétique m : Il définit les orientations dans
 [PDF] Chapitre II: La classification périodique (Tableau périodique)
[PDF] Chapitre II: La classification périodique (Tableau périodique)
Les éléments d'une même période ont le même nombre quantique principal n Les éléments appartenant à une même colonne ont généralement la même structure
 [PDF] Tableau périodique des éléments chimiques (2016)
[PDF] Tableau périodique des éléments chimiques (2016)
Tableau périodique des éléments Numéro atomique Principaux nombres d'oxydation (le plus fréquent en gras) Configuration électronique (en rouge
 [PDF] la classification périodique des éléments - Chimie en PCSI
[PDF] la classification périodique des éléments - Chimie en PCSI
Chapitre 3 : molécules et solvants Cours de chimie de première période de PCSI I HISTORIQUE DE LA CLASSIFICATION PERIODIQUE DES ELEMENTS CHIMIQUES
Comment sont classés les éléments dans la classification périodique ?
Dans la classification périodique, les éléments sont classés par numéro atomique Z croissant. La classification périodique des éléments comporte 7 lignes et 18 colonnes. Les lignes ou périodes représentent le nombre de couches électroniques autour du noyau de l'atome correspondant.Quelles sont les 3 règles de construction du tableau périodique actuelle ?
Il dicte alors les points clés de sa théorie : Les propriétés des éléments sont périodiques quand ils sont rangés selon leur masse atomique. Les éléments possédant des propriétés semblables ont des masses atomiques proches. L'arrangement des éléments correspond à peu près à leurs valences.Comment déterminer la position d'un élément dans le tableau périodique PDF ?
Le numéro de la dernière couche qui contient des électrons indique le numéro de la ligne, appelée période, dans laquelle se trouve d'atome. Le nombre d'électrons de la dernière couche indique le numéro de la colonne du tableau simplifié, auquel on ajoute 10 pour avoir le numéro de la colonne dans le tableau complet.- La première colonne est nommée famille des alcalins, la deuxième colonne est nommée famille des alcalino-terreux, l'avant-dernière colonne est nommée famille des halogènes et, enfin, la dernière colonne est nommée famille des gaz inertes (ou gaz rares).

Chapitre II : Classification périodique
1Chapitre II: La classification périodique
I-Des définitions
1-Le nucléide :
Un atome est caractérisé par deux valeurs : la valeur de A et la valeur de Z. Un nucléide X est
représenté de la façon suivante : (Z) : Le nombre atomique dans un atome.Exemple :1H nombre de protons=1
(A) : Le nombre massique Représente le nombre de nucléons (protons+neutrons) A=Z+N 2- : des entités chimiques (atomes, ions, isotopes) qui possèdent le même nombre atomique Z (nombre de protons) portent le même nom et possèdent les mêmes caractéristiques chimiques,Exemple : 3517Cl et 3717Cl
17Cl3-Les isotopes :
Sont des nucléides ayant le même numéro atomique Z mais le nombre massique A est différent.Exemple : 2412Mg ; 2512Mg
4-Les nombres quantiques
Selon le modèle de Bohr l.
Chaque orbite est représentée par n (le nombre quantique principal) qui peut prendre les valeurs n=1, 2,Chapitre II : Classification périodique
2 Pour Sommerfeld les électrons tournent autour du noyau sur des orbites elliptiquesSommerfeld à introduit 4 nombres quantiques :
a-Le nombre quantique principal (n) : n : caractérise une couche électronique n=1 la couche K n=2 la couche L n=3 la couche M n=4 la couche N b-Le nombre quantique secondaire : l l : caractérise une sous couche 0 l n-1 Pour identifier les sous couches, on utilise les symboles suivants : l 0 1 2 3Symbole s P d f
Exemple : n=1 l=0 il ya une seule sous couche s c-Le nombre quantique magnétique ( m)Chapitre II : Classification périodique
3 m prend toutes les valeurs entre -l m +lExemple l=1 m=-1,0,+1
d-Le nombre quantique de SpinS : il prend les valeurs +1/2 ou -1/2
Selon la mécanique quantique on remplace le mot orbite par orbitale atomique (OA) un OA est représenté par une lacune ou une case quantique OA= Chaque valeur de m correspond à un OAreprésenté par une lacune (case quantique) Dans un orbitale atomique, on ne peut pas mettre plus de deux électrons, les électrons qui possèdent les mêmes nombre quantiques (n,l,m) se trouvent dans la même case quantique .Sous couche(l) 0 1 2 3
S p d f
m 0 -1,0,+1 -2,-1,0,+1,+2 -3,-2,-1 ,0,+1,+2,+3Nombre
1 3 5 7
Cases quantiqueNombre maxi
2 6 10 14
Chapitre II : Classification périodique
45-La régle de Klechkowski
orbitales atomiques selon la valeur minimale (n + l), si la valeur (n + l) est constante, donc la répartition se fait selon la valeur croissante de n. Par exemple pour 2p et 3s , on a respectivement n+l=2+1=3 et n+l=3+0=3 la valeur( n+l ) est constante =3 on remplit donc 2p en premier (n plus petit=2) et ensuite on remplit 3s (n=3). -dessous :6-Le cortège électronique
La distribution des électrons se fait selon la règle de Klechkowski (la valeur croissante de (n+l))Exemple
Na11 : 1s2 2s2 2p6 3s1
Fe26 : 1s2 2s2 2p6 3s2 3p6 4s2 3d6
7-La configuration électronique
La répartition des électrons se fait selon la valeur croissante de n (à partir de la valeur la plus petite de n la plus grande de n)Chapitre II : Classification périodique
5 Les éléments qui possèdent Z 20 le cortège= la configurationExemple :
26FeCortège: Fe26 : 1s2 2s2 2p6 3s2 3p6 4s23d6
Configuration: Fe26: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 n=1 n=2 n=3 n=4 Na11 : 1s2 2s2 2p6 3s1 (cortège=configuration, Z20)II- Le tableau périodique
En 1869 Mendeleïev avait classé les éléments selon leurs masse atomique, le premier tableau
périodique contenait 63 élément. La disposition moderne du tableau périodique est caractérisé
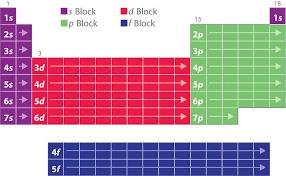
par des rangées horizontales (périodes) et des colonnes verticales (famille ou groupe) le nouveau classement est fait selon Z croissant de la gauche vers la droite et du haut vers le bas.Le tableau périodique est constitué de 7 lignes appelées période et de 18 colonnes appelées
familles ou groupes. e période ont le même nombre quantique principal n. Les éléments appartenant à une même colonne ont généralement la même structureélectronique externe.
1-Les périodes :
Elles sont représentées par 7 lignes.
La 1ére période n=1 (couche K)
on remplit la sous couche 1s (1é) et 2s (2é)2 élémentsH :1s1 et He : 1s2
La 2éme période n=2 (couche L)
Dans cette période on commence par le remplissage de la sous couche 2s ensuite 2p c'est-à- dire 2s22p68 élémentsLi, Be, B, C, N, O, F, Ne
La 3éme période n=3 (coucheM)
Chapitre II : Classification périodique
6 On commence par le remplissage de la sous couche 3s et en fin 3p s23p68èlectrons donc 8 éléments
11Na 18Ar
La 4éme période n=4 (couche N)
On commence par le remplissage de 4s ensuite 3d et en fin 4p (18é)18 éléments19K 36Kr
Chrome (Cr) : Z = 24. On attend la configuration suivante : 1s2 2s2 2p6 3s2 3p6 3d44s2 mais la configuration la plus stable: 1s2 2s2 2p6 3s2 3p6 3d5 4s1 ( plus stable) Le cuivre (Cu) Z=29 : On attend la configuration suivante : 1s2 2s2 2p6 3s2 3p6 4s2 3d9 mais la configuration la plus stable : 1s2 2s2 2p6 3s2 3p6 3d104s1 Remarque -couche (d) peut être complètement remplie (10 électrons) ou àmoitié remplie (5 électrons), la configuration électronique qui en résulte est plus stable
2- 2-a-Ce sont des électrons qui présentent la structure du gaz rare qui précède cet élément et on ajoute
les électrons de la sous couche d et f si elles sont complétement remplies (d10 et f14).Exemple :
11Na : 1s2 2s2 2p6 3s1
11Na:10 [Ne]3s1
2-b-Les électrons de valence
présentent la structure électronique externe (SEE)17Cl : 1s2 2s2 2p6 3s2 3p5
17Cl : 10[Ne]3s2 3p5 les électrons de valence=7
S E E48Cd : 1s2 2s2 2p6 3s2 3p64s2 3d104p6/5s2 4d10 (cortège)
48Cd :36 [Kr] 4d105s2 (configuration)
Les électrons de valence =2 S E E
Chapitre II : Classification périodique
7La 5éme période n=5
Elle corresponde au remplissage des sous couches 5s 4d 5p (18 éléments).37Rb 54Xe
47Ag : 36[Kr]5s1 4d10
Cas particuliers
42Mo: 36[Kr] 5s1 4d5
La 6éme période n=6
Elle corresponde au remplissage des sous couches 6s2 4f14 5d10 6p6 (2+14+10+6)=32éléments
55Cs 86Rn
On appels les éléments qui correspondent au remplissage de la sous couche 4f les lanthanides (57La 71 Lu)La 7éme période n=7
Elle corresponde au remplissage des sous couches 7s 5f 6d 7p (2+14+10+6)=32 éléments On appels les éléments qui correspondent au remplissage de la sous couche 5f les actinides (89Ac 103Lr)3-Les colonnes (18 colonnes)
Les éléments appartenant à une même colonne ont généralement la même structureélectronique externe (SEE)
Il existe deux groupes ou deux familles dans le tableau périodiqueLes éléments appartenant au groupe A possèdent la structure électronique externe (SEE) de
type ns ou ns npLes éléments appartenant au groupe B possèdent une configuration électronique de type type
[gaz rare] (n-1)dy nsx (1y10) (x=1 ou x=2) La 1ére colonne (Familles des Alcalins) groupe IAElle rassemble les éléments de la première colonne leurs SEE est ns1. Ils ont un électron sur
cations monovalents : Li+, Na+ et K+.La 2éme colonne (Alcalino-terreux) groupeIIA
La SEE : ns2
Les éléments de cette colonne perdent facilement deux électrons de leurs couches externes pour donner des cations bivalents : Mg2+, Ca2+Chapitre II : Classification périodique
8Les colonnes de 3 à 12
Ce sont des éléments de transitions qui possèdent une configuration de type [gaz rare] (n-1)dx nsy (10x1 ; y=1 ou 2)IIIB : [gaz rare ] ns2 (n-1)d1
IVB: [gaz rare ] ns2 (n-1)d2
VB: [gaz rare ] ns2 (n-1)d3
VIB: [gaz rare ] ns1 (n-1)d5
VIIB: [gaz rare ] ns2 (n-1)d5
VIIIB: [gaz rare ] ns2 (n-1)d6
ns2 (n-1)d7 ns2 (n-1)d8IB: [gaz rare] ns1 (n-1)d10
IIB: [gaz rare] ns2 (n-1)d10
Les éléments de cette colonne donnent des cations à valence multiple comme : Fe2+, Fe3+ La colonne 13 : groupe IIA (la famille du bore (B))La SEE de cette famille est de type ns2 np1, les éléments de cette colonne ont tendance à
donner facilement trois électrons pour saturer le niveau d'énergie et à former un cation de charge (+3) : B3+, Al3+La colonne 14 :groupe IVA
Appelée aussi famille du Carbone, la SEE est de type ns2 np2. Les éléments de cette famille possèdent 4 électrons de valence donc ils forment des cations tétravalents (+4).La colonne 15 groupeVA)
Les Azotides possèdent 5 électrons de valence, ils ont tendance à gagner 3é pour former une
charge -3 : N3- ; P3-. La SEE est de type ns2 np3.La colonne 16 : (groupeVIA)
La SEE est de type ns2 np4. Les éléments de cette colonne ont tendance à attirer deux électrons pour former des anions de charge (-2) : O2- ; S2- La colonne17 : (Famille des halogènes) groupe VIIALa SEE est de type ns2 np5
Chapitre II : Classification périodique
9 Les halogènes ont 7 électrons sur leur couche externe et vont donc facilement en gagner un pour former des ions de charge e : F - , Cl- , Br- , I- . La colonne18 : (Famille des gaz rares) groupeVIIIA He, Ne, Ar, Kr, Xe. Ce sont les éléments chimiques les plus stables (couche de valence totalement remplie). 4- Déterminer sa période : valeur de n dans le cortège ou la configurationExemple :
19K : 18[Ar]4s1 n=4 4éme période
42Mo : 36[Kr]4d55s1 n=55éme période
Déterminer son groupe :
et le type de SEE détermine appartient au groupe A ou au groupe B.17 Cl : 1s2 2s2 2p6 3s2 3p5
17 Cl : 10[Ne] 3s2 3p5 n= 33éme période
SEE : ns npgroupe A
7é de valences VII groupe VII A
23V : 1s2 2s2 2p6 3s2 3p6/4s2 3d3 n= 44éme période
23V : 18[Ar]3d34s2 SEE : [gaz rare] (n-1)d ns groupe B groupe V B
5é de valences V
5-Périodicité de certaines propriétés
5-a-Energie
un électronA(g) A+ (g) +1é
Exemple : Ca(g) Ca+(g) +1é
EiChapitre II : Classification périodique
10 vers la droite u bas en haut leZ Ei
Z Ei5-b- :
atome B à attirer vers lui atome A . Un élément qui perd facilement un ou plusieurs électrons est dit électropositif.Varie comme Ei
Z ZMadame : ZAABAT.N
quotesdbs_dbs30.pdfusesText_36[PDF] classification phylogénétique des animaux cycle 3
[PDF] classification phylogénétique simplifiée
[PDF] classification phylogénétique definition
[PDF] classification phylogénétique des végétaux
[PDF] arbre phylogénétique des embryophytes
[PDF] chlorobionte
[PDF] classification embryophytes
[PDF] lignée brune
[PDF] lignée verte classification
[PDF] rhodobionte
[PDF] endosymbiose primaire définition
[PDF] embryophytes définition
[PDF] classification phylogénétique du vivant 4ème édition
[PDF] pourquoi enseigner la classification du vivant