 Chapitre 1 :Classification périodique des éléments
Chapitre 1 :Classification périodique des éléments
https://www.immae.eu/cours/. Page 2. Chapitre 1 : Classification périodique des éléments. Structure de la matière. Page 2 sur 5. 118? Th. 75.6 ?In. 95. Di. 60 ?
 Chapitre IV : Classification périodique des éléments
Chapitre IV : Classification périodique des éléments
15 avr. 2020 Le tableau périodique actuel classe les éléments par numéro atomique Z croissant. Il diffère peu de la classification selon l'ordre croissant ...
 Chapitre II: La classification périodique X
Chapitre II: La classification périodique X
Les éléments d'une même période ont le même nombre quantique principal n. Les éléments appartenant à une même colonne ont généralement la même structure.
 Chapitre 5 : La classification périodique des éléments
Chapitre 5 : La classification périodique des éléments
A RETENIR : - Dans le tableau périodique des éléments actuel les éléments chimiques sont classés par numéro atomique. (Z) croissant ;.
 Chapitre I - Classification périodique des éléments
Chapitre I - Classification périodique des éléments
Les éléments du syllabus sur lesquels portera le test du comité français des http://www.cayrel.net/?Cours-P1-Mecanique. Page 3. IPHO Lycée Jean Perrin. 3 ...
 Chimie générale
Chimie générale
Lieu du cours. Louvain-la-Neuve. Thèmes abordés. - Structure de l'atome. - Classification périodique des éléments. - Liaisons chimiques. - Structures de Lewis
 1 Classification périodique des éléments
1 Classification périodique des éléments
Présentation d'une case du tableau : Cette présentation est classique mais elle offre à ce stade du cours trop d'informations. En ce qui concerne l'étude du
 Chapitre 9 : La classification périodique des éléments
Chapitre 9 : La classification périodique des éléments
Cet outil est très important pour le chimiste car il lui permet de prévoir le comportement d'un élément chimique au cours d'une réaction. Le tableau périodique.
 Eléments de chimie inorganique et analytique
Eléments de chimie inorganique et analytique
Université catholique de Louvain - Eléments de chimie inorganique et analytique - cours-2022-lchm1231 position dans le tableau de classification périodique. L ...
 CHAPITRE V Classification Périodique des éléments
CHAPITRE V Classification Périodique des éléments
1)- Classification des éléments dans le tableau périodique: couche d incomplète soit à l'état fondamental soit au cours d'une réaction chimique.
 Chapitre 1 :Classification périodique des éléments
Chapitre 1 :Classification périodique des éléments
Conservation de la quantité de ces éléments au cours d'une réaction chimique quelconque. Dalton : La matière est constituée d'atomes. Les éléments chimiques
 Chapitre IV : Classification périodique des éléments
Chapitre IV : Classification périodique des éléments
Le tableau périodique actuel classe les éléments par numéro atomique Z croissant. Il diffère peu de la classification selon l'ordre croissant des masses
 La classification périodique des éléments
La classification périodique des éléments
Chapitre 3 : La classification périodique des éléments. Pierre-Alexis GAUCHARD. Agrégé de chimie Docteur ès sciences. UE1 : Chimie – Chimie physique.
 Lunivers Chapitre 6 : la classification périodique des éléments
Lunivers Chapitre 6 : la classification périodique des éléments
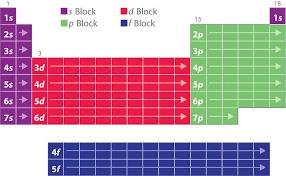
On classe actuellement les éléments chimiques dans un tableau. Le tableau périodique des éléments comporte 112 éléments chimiques connus.
 Chapitre 9 : La classification périodique des éléments
Chapitre 9 : La classification périodique des éléments
Cet outil est très important pour le chimiste car il lui permet de prévoir le comportement d'un élément chimique au cours d'une réaction.
 Chapitre 5 : La classification périodique des éléments
Chapitre 5 : La classification périodique des éléments
En 1869 Mendeleïev est le premier à avoir l'idée de classer les éléments chimiques par « poids » atomiques. (maintenant appelée masse atomique) croissant en s'
 Chapitre II: La classification périodique X
Chapitre II: La classification périodique X
Les éléments d'une même période ont le même nombre quantique principal n. Les éléments appartenant à une même colonne ont généralement la même structure.
 Classification périodique des éléments chimiques
Classification périodique des éléments chimiques
Et avec la croissance du nombre d'éléments chimiques découverts et artificiels au cours des 17ème et 18ème siècles leur ordre et leur organisation selon des
 Architecture de la matière
Architecture de la matière
Chapitre 4.1 : élément et atome. Chapitre 4.2 : la classification périodique des éléments. Chapitre 3 : molécules et solvants. Cours de chimie de première
 [PDF] Chapitre 5 : La classification périodique des éléments - AlloSchool
[PDF] Chapitre 5 : La classification périodique des éléments - AlloSchool
- Dans le tableau périodique des éléments actuel les éléments chimiques sont classés par numéro atomique (Z) croissant ; - Les éléments chimiques dont les
 [PDF] Chapitre 1 :Classification périodique des éléments - Melusine
[PDF] Chapitre 1 :Classification périodique des éléments - Melusine
Mendeleïev réalise une classification pour M croissant en faisant apparaître sur une même ligne des éléments qui ont les mêmes propriétés chimiques Chapitre 1
 [PDF] Chapitre IV : Classification périodique des éléments
[PDF] Chapitre IV : Classification périodique des éléments
15 avr 2020 · Le tableau périodique actuel classe les éléments par numéro atomique Z croissant Il diffère peu de la classification selon l'ordre croissant
 [PDF] Chapitre IV : Classification périodique des éléments
[PDF] Chapitre IV : Classification périodique des éléments
La classification périodique est basée sur la formation de groupes constitués par les éléments possédant des propriétés chimiques analogues On regroupe dans
 [PDF] CHAPITRE V Classification Périodique des éléments
[PDF] CHAPITRE V Classification Périodique des éléments
Chapitre V: Classification Périodique des éléments 69 Sous- couche S p d f 3)- Le nombre quantique magnétique m : Il définit les orientations dans
 [PDF] Chapitre II: La classification périodique (Tableau périodique)
[PDF] Chapitre II: La classification périodique (Tableau périodique)
Les éléments d'une même période ont le même nombre quantique principal n Les éléments appartenant à une même colonne ont généralement la même structure
 [PDF] Tableau périodique des éléments chimiques (2016)
[PDF] Tableau périodique des éléments chimiques (2016)
Tableau périodique des éléments Numéro atomique Principaux nombres d'oxydation (le plus fréquent en gras) Configuration électronique (en rouge
 [PDF] la classification périodique des éléments - Chimie en PCSI
[PDF] la classification périodique des éléments - Chimie en PCSI
Chapitre 3 : molécules et solvants Cours de chimie de première période de PCSI I HISTORIQUE DE LA CLASSIFICATION PERIODIQUE DES ELEMENTS CHIMIQUES
Comment sont classés les éléments dans la classification périodique ?
Dans la classification périodique, les éléments sont classés par numéro atomique Z croissant. La classification périodique des éléments comporte 7 lignes et 18 colonnes. Les lignes ou périodes représentent le nombre de couches électroniques autour du noyau de l'atome correspondant.Quelles sont les 3 règles de construction du tableau périodique actuelle ?
Il dicte alors les points clés de sa théorie : Les propriétés des éléments sont périodiques quand ils sont rangés selon leur masse atomique. Les éléments possédant des propriétés semblables ont des masses atomiques proches. L'arrangement des éléments correspond à peu près à leurs valences.Comment déterminer la position d'un élément dans le tableau périodique PDF ?
Le numéro de la dernière couche qui contient des électrons indique le numéro de la ligne, appelée période, dans laquelle se trouve d'atome. Le nombre d'électrons de la dernière couche indique le numéro de la colonne du tableau simplifié, auquel on ajoute 10 pour avoir le numéro de la colonne dans le tableau complet.- La première colonne est nommée famille des alcalins, la deuxième colonne est nommée famille des alcalino-terreux, l'avant-dernière colonne est nommée famille des halogènes et, enfin, la dernière colonne est nommée famille des gaz inertes (ou gaz rares).
Animation
1.tableaux des isotopes
2. tableaux périodique :
3. Classification périodique (cité des sciences)
4. éléments chimiques avec leurs propriétés
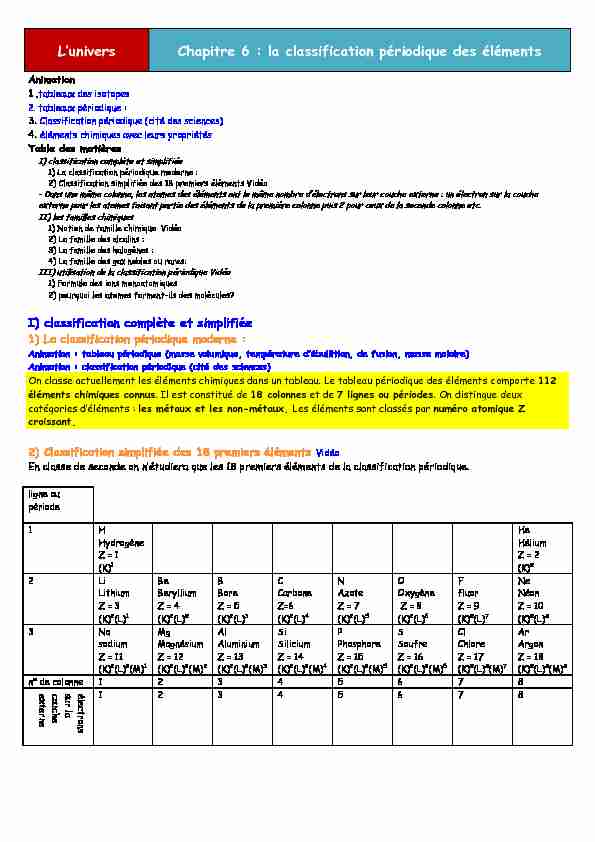
Table des matières
I) classification complète et simplifiée
1) La classification périodique moderne :
2) Classification simplifiée des 18 premiers éléments Vidéo
- GMQV XQH PrPH ŃRORQQH OHV MPRPHV GHV pOpPHQPV RQP OH PrPH QRPNUH G·pOHŃPURQV VXU OHXU Ńouche externe : un électron sur la couche
externe pour les atomes faisant partie des éléments de la première colonne puis 2 pour ceux de la seconde colonne etc.
II) les familles chimiques
1) Notion de famille chimique Vidéo
2) La famille des alcalins :
3) La famille des halogènes :
4) La famille des gaz nobles ou rares:
III) utilisation de la classification périodique Vidéo1) Formule des ions monoatomiques
2) pourquoi les atomes forment-ils des molécules?
I) classification complète et simplifiée
1) La classification périodique moderne :
Animation : PMNOHMX SpULRGLTXH PMVVH YROXPLTXH PHPSpUMPXUH G·pNXOOLPLRQ GH IXVLRQ PMVVH PROMLUH Animation : classification périodique (cité des sciences)On classe actuellement les éléments chimiques dans un tableau. Le tableau périodique des éléments comporte 112
éléments chimiques connus. Il est constitué de 18 colonnes et de 7 lignes ou périodes. On distingue deux
ŃMPpJRULHV G·pOpPHQPV : les métaux et les non-métaux. Les éléments sont classés par numéro atomique Z
croissant.2) Classification simplifiée des 18 premiers éléments Vidéo
(Q ŃOMVVH GH VHŃRQGH RQ Q·pPXGLHUM TXH OHV 18 SUHPLHUV pOpPHQPV GH OM ŃOMVVLILŃMPLRQ SpULRGLTXHB
ligne ou période 1 HHydrogène
Z = 1 (K)1 HeHélium
Z = 2 (K)2 2 LiLithium
Z = 3 (K)2(L)1 BeBeryllium
Z = 4 (K)2(L)2 B Bore Z = 5 (K)2(L)3 CCarbone
Z=6 (K)2(L)4 N Azote Z = 7 (K)2(L)5 OOxygène
Z = 8 (K)2(L)6 F fluor Z = 9 (K)2(L)7 NeNéon
Z = 10
(K)2(L)8 3 Na sodiumZ = 11
(K)2(L)8(M)1 MgMagnésium
Z = 12
(K)2(L)8(M)2 AlAluminium
Z = 13
(K)2(L)8(M)3 SiSilicium
Z = 14
(K)2(L)8(M)4 PPhosphore
Z = 15
(K)2(L)8(M)5 SSoufre
Z = 16
(K)2(L)8(M)6 ClChlore
Z = 17
(K)2(L)8(M)7 Ar ArgonZ = 18
(K)2(L)8(M)8 n° de colonne 1 2 3 4 5 6 7 8 électrons sur la couche externe1 2 3 4 5 6 7 8
I·XQLYHUV Chapitre 6 : la classification périodique des éléments - Dans une même ligne, les atomes des éléments ont le même nombre de couches électroniques occupées : - 1 couche (K) pour la première ligne - 2 couches (K et L) pour la seconde ligne - 3 couches (K, L et M) pour la troisième ligne - Dans une même colonne, les atomes des éléments ont le PrPH QRPNUH G·pOHŃPURQV VXU OHXU ŃRXŃOH externe : un électron sur la couche externe pour les atomes faisant partie des éléments de la première colonne puis 2 pour ceux de la seconde colonne etc.II) les familles chimiques
1) Notion de famille chimique Vidéo
Les éléments ayant des propriétés chimiques voisines forment une famille. Ils sont placés dans la même colonne. Leurs propriétés chimiques sont dues aux nombres G·pOHŃPURQV GH OHXU ŃRXŃOH H[PHUQH.2) La famille des alcalins :
$ O·H[ŃHSPLRQ GH O·O\GURJqQH OHV pOpPHQPV GH OM première colonne appartiennent à la famille des alcalins. Dans la nature on les rencontre sous IRUPH G·LRQV IL+ (lithium), Na+ (sodium) ou K+(potassium), comme dans O·HMX RX OHV HMX[ PLQpUMOHVB HOV VRQP UHVSRQVMNOHV GX métaux mous qui réagissent spontanément avec leGLR[\JqQH GH O·MLU RX O·HMXB
Pourquoi forment t-ils des ions X+ ? En perdant un électron ils répondent aux règles de stabilité des éléments chimiques UqJOH GX GXHP HP GH O·RŃPHPB IHXUélectrons.
atome Li Na K structureélectronique
(K)2(M)1 (K)2(L)8(M)1 (K)2(L)8(M)8(N)1 ion Li+ Na+ K+ structureélectronique
(K)2 (K)2(L)8 (K)2(L)8(M)8 Les atomes appartenant à la famille des alcalins ne forment pas de molécules.3) La famille des halogènes :
Les éléments de la 17° colonne (7 ème colonne de la classification simplifiée) appartiennent à la famille des halogènes. GMQV OM QMPXUH RQ OHV UHQŃRQPUH VRXV IRUPH G·LRQV monoatomiques : F- (fluorure); Cl- (chlorure); Br- (bromure). Ils peuvent également exister sous forme de molécules diatomiques : F2 , Cl2 , Br2 . Ces espèces chimiques sont fortement colorées et très nocives. Pourquoi forment t-ils des ions X- ? En gagnant un électron ils répondent aux règles de stabilité des éléments chimiques UqJOH GX GXHP HP GH O·RŃPHPB IHXU dernLqUH ŃRXŃOH G·pOHŃPURQV ŃRPSRUPH 8 pOHŃPURQVB atome F Cl structureélectronique
(K)2(M)7 (K)2(L)8(M)7 ion F- Cl- structureélectronique
(K)2(L)8 (K)2(L)8(M)84) La famille des gaz nobles ou rares:
Les gaz rares sont peu présents GMQV O·MPPRVSOqUH terrestre. Ce sont les éléments chimiques les plus stables. Ils sont inertes ŃOLPLTXHPHQP Ń·HVP-à-dire TX·LOV QH SMUPLŃLSHQP j MXŃXQH UpMŃPLRQ ŃOLPLTXHB HOV QHIRUPHQP SMV G·LRQV QL GH PROpŃXOHV.
Pourquoi ? Leur dernière couche est saturée à 2 ou 8 électrons. Ces atomes sont stables chimiquement exemple : He ,Hélium, (K)2Ne Néon (K)2(L)8
Ar Argon (K)2(L)8(M)8
BI·OpOLXP HVP O·pOpPHQP OH SOXV MNRQGMQP GMQV O·8QLYHUVDSUqVOquotesdbs_dbs29.pdfusesText_35
[PDF] classification phylogénétique des animaux cycle 3
[PDF] classification phylogénétique simplifiée
[PDF] classification phylogénétique definition
[PDF] classification phylogénétique des végétaux
[PDF] arbre phylogénétique des embryophytes
[PDF] chlorobionte
[PDF] classification embryophytes
[PDF] lignée brune
[PDF] lignée verte classification
[PDF] rhodobionte
[PDF] endosymbiose primaire définition
[PDF] embryophytes définition
[PDF] classification phylogénétique du vivant 4ème édition
[PDF] pourquoi enseigner la classification du vivant
