 Physique chimie 4eme Chapitre 2 Combustion
Physique chimie 4eme Chapitre 2 Combustion
11 mai 2005 RÉALISATION DE LA COMBUSTION DU BUTANE AVEC UN BEC BUNSEN ... Exercice n°5 : Etude de la combustion du fer (5 Points). On fait brûler de la laine ...
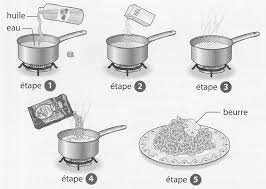 Devoir Surveillé n° 1 de Physique-Chimie
Devoir Surveillé n° 1 de Physique-Chimie
Quatrième. Page 2 sur 4. Exercice 1 – Et si on se faisait des pâtes ? (5 points) : Pour préparer des pâtes 5 étapes sont nécessaires : 1. Compléter le
 Tome 1 pollution (15 juillet)
Tome 1 pollution (15 juillet)
15 juil. 2023 différents combustibles visés par la loi organisent le contrôle des appareils de combustion et ... La quatrième réunion de Haut Niveau du ...
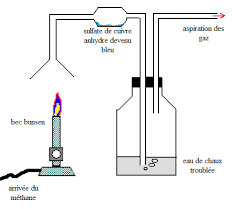 La combustion du méthane
La combustion du méthane
Correction. Exercice 1 : Combustion du butane. 1. Le butane est composé de quatre atomes de carbone et de dix atomes d'hydrogène. 2. Formule: C4H10 . 3. Les
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
6 fév. 2010 La suite de la résolution se fait comme la question 1 de l'exercice 9 de ce chapitre. Par comparaison avec la question précédente ces résultats ...
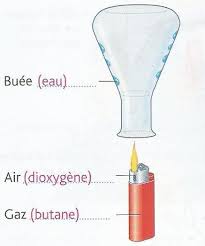 Chapitre 5 : les combustions
Chapitre 5 : les combustions
Remarques : dans une combustion il y a un corps qui brûle le combustible (carbone) et un corps qui permet Correction. Exercice 8. Joséphine n'a pas raison ...
 Plus de bonnes notes
Plus de bonnes notes
20 nov. 2019 Exercice 1 : questions de cours (4 pts). 1- Lors d'une réaction chimique comme une combustion qu'est-ce qu'un réactif et qu'est-ce qu'un ...
 Untitled
Untitled
Lors de la combustion du butane il se forme du dioxyde de carbone et de l'eau. 3 Les combustions incomplètes. 4/ Combustion incomplète du butane. • On allume
 Chapitre 1 : Les trois états de la matière
Chapitre 1 : Les trois états de la matière
avec le dioxyde de carbone la poudre... et le combustible en réalisant une zone morte. Exercice 4. Pour brûler 10 g de carbone il faut 80 L d'air. Liste des ...
 Contrôle n°5
Contrôle n°5
Exercice 2 : Combustion du carbone. 5.5 pts. On réalise la combustion du carbone dans le dioxygène : 1) Quel(s) est(sont) le(s) réactif(s) ? 1 pt. Le carbone
 Contrôle n°5
Contrôle n°5
Une combustion est une réaction chimique qui dégage de la chaleur et dont l'un 3) Lors de l'expérience schématisez (avec une légende) le test qui t'a ...
 Correction du devoir de chimie n°1 (4e) Exercice 1 : Atomes et
Correction du devoir de chimie n°1 (4e) Exercice 1 : Atomes et
3- Les réactifs de la combustion du carbone sont le carbone et le dioxygène car ils disparaissent au cours de la combustion. 4- Le produit de la combustion du
 Untitled
Untitled
Lors de la combustion du butane il se forme du dioxyde de carbone et de l'eau. 3 Les combustions incomplètes. 4/ Combustion incomplète du butane. • On allume
 0D/1D combustion modeling for the combustion systems
0D/1D combustion modeling for the combustion systems
18-Jul-2020 Cette thèse a été effectuée avec la collaboration du laboratoire PRISME de l'Université ... The correct evaluation of maximum cylinder.
 EVALUATION EXPERIMENTALE INDIVIDUELLE 4ème TP n°7 : La
EVALUATION EXPERIMENTALE INDIVIDUELLE 4ème TP n°7 : La
Lorsque le magicien approche l'allumette la paraffine brûle et réagit avec le dioxygène de l'air pour former de l'eau et un gaz ». Elle ne se souvient plus du
 Devoir de sciences physiques n°4 (Chimie) Note : /30
Devoir de sciences physiques n°4 (Chimie) Note : /30
3- Le bilan de la combustion du méthane (CH4) est le suivant : Le danger est donc bien réel pour toutes les personnes en contact avec la fumée de ...
 Design taking into account the partial discharges phenomena
Design taking into account the partial discharges phenomena
https://tel.archives-ouvertes.fr/tel-03124398/document
 4eme - Chimie - Corrigé Exercices chap 1 2 3
4eme - Chimie - Corrigé Exercices chap 1 2 3
Le nombre de molécule de dioxygène qui vont réagir avec le fer lors de la combustion des neuf atomes de fer est six.
 Communication Nationale du Maroc
Communication Nationale du Maroc
Technology Needs Assessment. TPE. Très Petite Entreprise. QCN. Quatrième Communication Nationale. UCA. Université Cadi Ayyad Marrakech.
 The development and combination of electromagnetic non
The development and combination of electromagnetic non
13-Dec-2013 evaluation techniques for the assesment of cover concrete condition ... electrode offset increases (ii) geometric correction by numerical ...
 Réglementation ICPE 2910 : focus sur les chaufferies entre
Réglementation ICPE 2910 : focus sur les chaufferies entre
Exercice n°3 : Ecrire le bilan de la combustion du butane : 4pts On étudie la combustion complète du butane Complétez le schéma suivant à l’aide des mots : dioxyde de carbone combustible comburant eau dioxygène produits butane réactifs Exercice n°4 : Prévenir un danger : 3pts
 Contrôle sur la combustion Quatrième - Plus de bonnes notes
Contrôle sur la combustion Quatrième - Plus de bonnes notes
Contrôle sur la combustion – Quatrième Exercice 1 : questions de cours (4 pts) 1- Lors d’une réaction chimique comme une combustion qu’est-ce qu’un réactif et qu’est-ce qu’un produit ? (2 pts) 2- Donner la définition d’une combustion (1 pts) 3- Quel est le test qui met en évidence le dioxyde de carbone ? (1 pts)
 CHP 4 les combustions - ac-versaillesfr
CHP 4 les combustions - ac-versaillesfr
4) Explication de la combustion du butane avec le modèle moléculaire : Vérifie que la citation de Lavoisier est bien respectée et que le nombre d’atome de carbone d’oxygène et d’hydrogène est bien conservé avant et après la réaction chimique en complétant le tableau ci-dessous :
 Searches related to evaluation combustion 4ème avec correction PDF
Searches related to evaluation combustion 4ème avec correction PDF
On réalise la combustion du carbone dans le dioxygène : 1) Quel(s) est(sont) le(s) réactif(s) ? 1 pt Le carbone et le dioxygène 2) Quel(s) est(sont) le(s) produit(s) ? 0 5 pt Le dioxyde de carbone 3) Lors de l’expérience schématisez (avec une légende) le test qui t’a permis de trouver le produit de la réaction 2 pt
Quelle est la fiche technique de combustion?
La fiche technique de combustion A - I précise que si la puissance d'un appareil est bridée, celle-ci est prise en compte à condition que la solution de bridage soit explicitement précisée dans le dossier de déclaration et que les mesures conservatoires permettant de la respecter soient mises en place. 41.
Quelle est la température de combustion d'un four?
La combustion commence sur charbon à une température de 1250 degrés. Par exemple, le four de fusion travaille sur charbon. La flamme qui est formée en étant alimenté avec de l'air four, fond facilement le métal. En raison du four à haute température tous les éléments internes sont en briques réfractaires spéciales.
Qu'est-ce que le phénomène de combustion ?
Lorsque votre voiture roule, un phénomène de combustion se déroule à l'intérieur de votre moteur, impliquant les pistons et les segments. En fonction de votre vitesse, ces deux éléments vont se déplacer des milliers de fois par minute. Pour limiter les dégâts de ce frottement, le moteur a besoin de lubrifiant pour fonctionner.
Comment calculer le cours de combustion ?
Cours de combustion : définitions et équations de combustion. Quantité d'oxygène nécessaire: 1 mole d'O 2 par mole de C, ou 32/12 = 2.67 kg d'O 2 par kg de carbone. Combustion de l'hydrogène: H 2 + 1/2 O 2 -> H 2 O, enthalpie D H R25°C = -241,6 kJ.mol -1, Quelques repères quand on parle de combustion: Pouvoir...
Exercice 6 page 49 (chapitre 1 du cours)
Clément a placé dans les tubes à essais suivants : de l"eau distillée (1), de l"eau avec de l"huile (2) et de l"eau sucrée (3). a) pour chaque tube, dire s"il contient un corps pur ou un mélange. b) Schématiser les contenus de chaque tube (5 molécules de chaque corps pur) en utilisant les modèles suivants : molécule d"eau molécule d"huile molécule de sucreRéponses :
a) Le tube 1 est un corps pur car il n"est composé que d"un seul constituant, l"eau. Le tube 2 est un mélange car il est composé de plusieurs constituants : l"eau et l"huile. Le tube 3 est un mélange car il est composé de plusieurs constituants : l"eau et le sucre. b) tube n° 1 tube n° 2 tube n° 3L"eau et l"huile ne sont
pas miscibles. Le sucre est dissous dans l"eau.Exercice 8 page 49 (chapitre 1 du cours)
Juliette a dessiné l"expérience qu"elle a réalisée mais elle a oublié de représenter
quelques molécules présentes dans le bécher. a) Lorsque le mélange est réalisé, l"indication de la balance est-elle inférieure,égale ou supérieure à 120 g ? Pourquoi ?
b) Compléter le dessin en représentant les molécules qui manquent dans le bécher du premier dessin.Réponses :
a) La balance indique une masse de 120 grammes car lors d"un mélange, il y a conservation de la masse.b) Lors du mélange, le nombre et le type de molécules ne changent pas. Dans le mélange, il y a 11 molécules
en forme de triangle rouge et 14 molécules en forme de trapèze vert. Il manque donc 3 molécules en forme de triangle rouge dans le premier dessin.120 g ......... g
Exercice 15 page 50 (chapitre 1 du cours)
Choisir puis recopier les propositions correctes.
Quand l"eau passe de l"état solide à l"état liquide, les molécules passent : a) d"un état ordonné à un état ordonné b) d"un état compact à un autre état compact c) d"un état ordonné à un état désordonné d) d"un état compact à un état dispersé e) d"un état dispersé à un état désordonnéRéponses :
Quand l"eau passe de l"état solide à l"état liquide, les molécules passent : - d"un état ordonné à un état désordonné (phrase c) - d"un état compact à un autre état compact (phrase b) En effet, l"état solide est compact et ordonnée et l"état liquide, compact et désordonné.EXERCICES DE L"ANCIEN LIVRE
Exercice 8 page 53 (chapitre 2 du cours)
1)2) Dans la molécule d"eau, il y a un atome d"oxygène et deux atomes
d"hydrogène.3) La formule chimique de la molécule d"eau est H
2O.Exercice 9 page 53 (chapitre 2 du cours)
La formule chimique de la molécule d"aspirine est : C9H8O4.
Exercice 10 page 53 (chapitre 2 du cours)
La molécule de saccharose est composée de 12 atomes de carbone, 22 atomes d"hydrogène et de 11 atomes d"oxygène.Exercice 11 page 53 (chapitre 3 du cours)
O-O O-O + ® ????
O-O O-O
1) Je sais que la combustion du carbone produit du dioxyde de carbone donc
l"équation chimique s"écrit : 4 C + 4 O2 ® 4 CO2.
2) La molécule produite par cette réaction chimique est la molécule de dioxyde
de carbone et il se forme quatre molécules.C-C-C-C
Exercice 13 page 53 (chapitre 3 du cours)
1) C + O
2 ® CO2
0,3 g 0,8 g ? g
La masse se conserve lors d"une réaction chimique donc la masse de dioxyde de carbone formé est la somme des masses des réactifs. En effet, il ne se forme qu"un seul produit le dioxyde de carbone.Nous pouvons alors écrire : m(CO
2) = m(C) + m(O2)
Calcul :
m(CO2) = 0,3 g + 0,8 g m(CO2) = 1,1 g
La masse de dioxyde de carbone formé à l"issu de cette réaction est 1,1 grammes.2) C + O
2 ® CO2
6 g ? g 22 g
La masse se conserve lors d"une réaction chimique donc nous pouvons écrire : m(CO2) = m(C) + m(O2)
Nous recherchons la masse de dioxygène consommé, nous allons alors modifier la relation précédente pour calculer la masse d"oxygène.Soit, m(O
2) = m(CO2) - m(C)
Calcul :
m(O2) = 22 g - 6 g m(O2) = 16 g
La masse d"oxygène consommé lors de cette réaction est 16 grammes.Exercice 15 page 54 (chapitre 3 du cours)
1) C + O
2 ® CO2
Bilan : C 1 + 0 = 1 1
Bilan : O 0 + 2 = 2 2
Cette équation est équilibrée car elle vérifie la conservation des atomes.2) 2 C + O2 ® 2 CO
Bilan : C 1 + 0 = 1 1
Bilan : O 0 + 2 = 2 1 =>
2Bilan : C 1 + 0 = 1 =>
2 2
Nous avons du rééquilibrer le carbone et donc faire un deuxième bilan car en équilibrant l"oxygène nous avons déséquilibré le nombre d"atomes de carbone.L"équation équilibrée est donc : 2
C + O2 ® 2 CO.
3)2 CO + O2 ® 2 CO2
Bilan : C 1 + 0 = 1 1
Bilan : O 1 + 2 = 3 =>
4 2 => 4
Attention, lorsqu"un atome se trouve dans plusieurs espèces chimiques, il fautprendre comme référence le côté (réactif ou produit) où l"atome n"est présent que
dans une seule espèce chimique. Dans le cas présent, l"atome d"oxygène se trouve dans toutes les molécules. Nous raisonnerons alors avec comme référence la molécule de CO2 où les atomes d"oxygène sont par deux (2, 4, 6, ...). On essaye avec 4 atomes d"oxygène, puis, si on n"arrive pas à équilibrer les atomes d"oxygène du côté des réactifs, on essaye avec 6 et ainsi de suite.L"équation équilibrée est donc : 2
CO + O2 ® 2 CO2.
4) C + CO
2 ® 2 CO
Bilan : C 1 + 1 = 2 1 =>
2Bilan : O 0 + 2 = 2 2
L"équation équilibrée est donc : C + CO
2 ® 2 CO.
Remarque :
équilibrer une équation se fait par des essais et des erreurs et donc cela peut prendre du temps.Exercice 16 page 54 (chapitre 3 du cours)
1) L"oxyde de fer Fe
3O4 est composé de trois atomes de fer et de 4 atomes
d"oxygène.2-a) fer + dioxygène ® oxyde magnétique
Fe + O
2 ® Fe3O4
Cette équation n"est pas équilibrée, nous allons donc y remédier.3 Fe + 2 O2 ® Fe3O4
Bilan : Fe 1 + 0 = 1 =>
3 3
Bilan : O 0 + 2 = 2 =>
4 4
L"équation équilibrée est donc : 3
Fe + 2 O2 ® Fe3O4.
2-b) Neuf étant un multiple du chiffre trois, nous allons tripler les coefficients de
l"équation chimique pour en déduire le nombre de molécules de dioxygène qui vont réagir lors de la combustion des neuf atomes de fer. 9Fe + 6 O2 ® 3 Fe3O4.
Le nombre de molécule de dioxygène qui vont réagir avec le fer lors de la combustion des neuf atomes de fer est six.quotesdbs_dbs8.pdfusesText_14[PDF] combustion bougie 4eme
[PDF] qu'est ce qu'une combustion complète
[PDF] combustion complete d'un hydrocarbure
[PDF] combustion complète définition
[PDF] combustion incomplète du méthane
[PDF] exemple de combustion complète
[PDF] equation de combustion propane
[PDF] combustion complète de l'acétylène dans le dioxygène
[PDF] combustion ethane
[PDF] combustion de l'acétylène formule
[PDF] combustion incomplète des alcanes
[PDF] equation de combustion complete du glucose
[PDF] réaction exothermique
[PDF] réaction endothermique
