 LES ALCANES
LES ALCANES
Les alcanes sont des hydrocarbures de formule brute CnH2n+2. Le méthane CH4 est le plus simple des alcanes. ... Combustion incomplète. Expérience :.
 PROPRIETES DES ALCANES ALCENES ET ALCYNES I
PROPRIETES DES ALCANES ALCENES ET ALCYNES I
Si la quantité de dioxygène n'est pas suffisante la combustion d'un hydrocarbure est incomplète. Il se forme alors du carbone
 Combustions des alcanes et des alcools
Combustions des alcanes et des alcools
Lorsque le combustible est un alcane ou un alcool les produits de la réaction Lors d'une combustion incomplète il se forme de l'eau et du carbone ou du ...
 Combustions et combustibles- corrigés des exercices
Combustions et combustibles- corrigés des exercices
combustion incomplète d'un alcane pourrait conduire l'élément chimique carbone à être oxydé en monoxyde de carbone CO ! La combustion totale signifie la
 Première A
Première A
combustion des alcanes. - réaction de substitution. • Réaliser la combustion complète et incomplète d'un alcane : le butane. • Faire identifier les produits
 Une réaction chimique : la combustion du méthane
Une réaction chimique : la combustion du méthane
molécules incomplètes. Pourquoi l'écriture n°6 est-elle fausse ? On a écrit que une molécule de méthane réagit avec une molécule de dioxygène
 Thème 2 : Matière et matériau Combustions Ch 11 Combustions I_
Thème 2 : Matière et matériau Combustions Ch 11 Combustions I_
I_ Alcanes et alcènes. Les alcanes et les alcènes sont deux familles d'espèces chimiques dont les Exemple : combustion incomplète du butane C4H10.
 Réactions en chimie organique
Réactions en chimie organique
il y a combustion incomplète et le monoxyde de carbone (CO) ainsi que le carbone sont aussi formé comme produit. Réaction de substitution des alcanes :.
 Physique-chimie
Physique-chimie
Hydrocarbures ; combustion complète ; combustion incomplète ; enthalpie de les hydrocarbures saturés (alcanes) dont la chaîne carbonée est constituée.
 Thème 10 – Chimie organique (notes manquantes)
Thème 10 – Chimie organique (notes manquantes)
il y a combustion incomplète et le monoxyde de carbone (CO) ainsi que le carbone sont aussi formé comme produit. Réaction de substitution des alcanes :.
 Réactions sur les alcanes et les alcènes - polymères
Réactions sur les alcanes et les alcènes - polymères
PASCAL ASMUSSEN LES ALCANES 5/5 3 2 Combustion incomplète Expérience : Le trou à la base de la cheminée est bouché par la virole la flamme est jaune et éclairante Conclusion : en présence d'un défaut de dioxygène la combustion du méthane est incomplète et donne de l'eau et du carbone CH4 + O2 ? C + 2 H20
 Cours de sciences physiques Rédigé par IBRAHIM ELHADJI
Cours de sciences physiques Rédigé par IBRAHIM ELHADJI
La combustion des alcanes dégage beaucoup de chaleur la réaction est dite exothermique Suivant la quantité de dioxygène utilisée on a des combustions complètes ou incomplètes: Cours de sciences physiques Rédigé par IBRAHIM ELHADJI DJIBRILLA PCEG en Chimie-Physique
 Combustions et combustibles - Cortial
Combustions et combustibles - Cortial
combustion incomplète d’un alcane pourrait conduire l’élément chimique carbone à être oxydé en monoxyde de carbone CO ! La combustion totale signifie la disparition de l’un au moins des réactifs Bilan : 6 14(g) 2(g) 2(g) 2 (g) 19 CH O 6CO 7HO 2 +? + ou bien : 2C H 19O 12CO 14H O6 14(g) 2(g) 2(g) 2 (g)+? + 3° question:
 Chapitre 1 LES ALCANES - Archiveorg
Chapitre 1 LES ALCANES - Archiveorg
Chapitre 1: LES ALCANES I Généralité : A/ Définition : Hydrocarbures saturés non cycliques linéaire ou ramifiés dont la molécule ne comporte que des liaisons simples C-C ou C-H ; de f b CnH2n+2 B/ Etat naturel : Les alcanes existent en mélanges complexes dans les pétroles
Qu'est-ce que la combustion des alcanes?
1.1 La combustion des Alcanes. La combustion des alcanes est la réaction entre l'alcane et le dioxygène contenu dans l'air. La combustion dégage de la chaleur, c'est une réaction exothermique. Lorsque le dioxygène est en excès, la combustion est complète, le dioxyde de carbone et l'eau sont les seuls produits de la réaction.
Qu'est-ce que la combustion incomplète ?
Lors d’une combustion incomplète il se forme de l’eau et du carbone ou du monoxyde de carbone ; on écrit alors une équation pour chaque espèce carbonée formée. c. Les combustions produisent du dioxyde de carbone, gaz à effet de serre qui participe au réchauffement de la planète.
Quelle est la différence entre la combustion complète et incomplète ?
La combustion complète donne de l'eau et du dioxyde de carbone. C2H6O + 3O2 = 2CO2 + 3H2O. La combustion incomplète ( oxygène en défaut) donne de l'eau, du monoxyde de carbone et des particules noires de carbone. C2H6O + 2O2 = 2CO + 3H2O.
Qu'est-ce que la combustion d'un combustible?
Elle a lieu quand la quantité de comburant est insuffisante pour permettre la réaction complète du combustible ou lorsque le temps de contact, à une température rendant la combustion possible, est trop faible. Elle produit des résidus de combustion (sous forme de cendres) et émettent
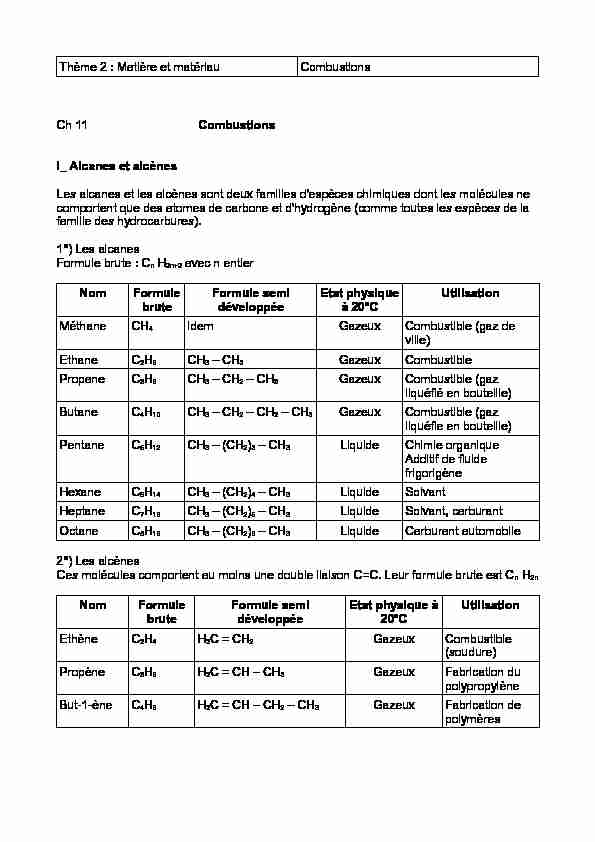
Thème 2 : Matière et matériauCombustions
Ch 11 Combustions
I_ Alcanes et alcènes
Les alcanes et les alcènes sont deux familles d'espèces chimiques dont les molécules ne comportent que des atomes de carbone et d'hydrogène (comme toutes les espèces de la famille des hydrocarbures).1°) Les alcanes
Formule brute : Cn H2n+2 avec n entier
NomFormule
bruteFormule semi développéeEtat physiqueà 20°CUtilisation
MéthaneCH4 idemGazeuxCombustible (gaz de
ville)EthaneC2H6 CH3 - CH3 GazeuxCombustible
PropaneC3H8CH3 - CH2 - CH3 GazeuxCombustible (gaz
liquéfié en bouteille) ButaneC4H10CH3 - CH2 - CH2 - CH3GazeuxCombustible (gaz liquéfie en bouteille) PentaneC5H12CH3 - (CH2)3 - CH3 LiquideChimie organiqueAdditif de fluide
frigorigèneHexaneC6H14CH3 - (CH2)4 - CH3LiquideSolvant
HeptaneC7H16CH3 - (CH2)5 - CH3LiquideSolvant, carburant OctaneC8H18CH3 - (CH2)6 - CH3LiquideCarburant automobile2°) Les alcènes
Ces molécules comportent au moins une double liaison C=C. Leur formule brute est Cn H2nNomFormule
bruteFormule semi développéeEtat physique à20°CUtilisation
EthèneC2H4H2C = CH2 GazeuxCombustible
(soudure)PropèneC3H6H2C = CH - CH3 GazeuxFabrication du
polypropylène But-1-èneC4H8H2C = CH - CH2 - CH3 GazeuxFabrication de polymèresII_ Les alcools
C'est une famille de molécules comportant un ou plusieurs groupes hydroxyle -OH.NomFormule
bruteFormule semi développéeEtat physique à20°CUtilisation
MéthanolCH4O CH3 - OH LiquideSolvant
EthanolC2H6O CH3 - CH2 - OH LiquideSolvant
Combustible
Propan-1-olC3H8OCH3 - CH2 - CH2 - OH LiquideSolvant Butan-1-olC4H10OCH3 - CH2 - CH2 - CH2 - OHLiquideSolvantIII_ Réaction de combustion
C'est une réaction entre un combustible (hydrocarbure, alcool, matière organique...) et un comburant, généralement le dioxygène de l'air1°) Combustion complète
Cette combustion produit uniquement du dioxyde de carbone et de l'eauExemple : combustion du propane C3H8
C3H8 + 5 O2 → 3 CO2 + 4 H2O
2°) Combustion incomplète
Elle a lieu lorsque la quantité de dioxygène nécessaire est insuffisante. Elle produit du monoxyde de carbone CO (gaz mortel) et du carbone C en plus de l'eau et du dioxyde de carbone. Exemple : combustion incomplète du butane C4H10C4H10 + 4 O2 → CO2 + 5 H2O + CO + 2 C
IV_ Avancement et bilan de matière
Comment connaître à tout instant la composition du système chimique ? C'est par l'intermédiaire d'une grandeur appelée avancement de la réaction. Soit la transformation entre les réactifs A et B qui forment les produits C et D suivant l'équation bilan : aA + bB → cC + dD1°) Définition
L'avancement noté x d'une réaction chimique est égal au quotient de la quantité de matière de n'importe quel produit de la réaction par son coefficient stoechiométrique.On a : x=n(C)
c=n(D) dOn a aussi x=nconsommé(A)
a=nconsommé(B) bcar les réactifs sont consommés proportionnellement à leurs coefficients stoechiométriques. L'avancement x, comme les quantités de matière n(C) et n(D), est une fonction du temps.2°) Evolution de l'avancement au cours du temps
L'avancement évolue d'une valeur nulle (les réactifs ne sont pas encore consommés et les produits pas encore formés) jusqu'à une valeur finale notée xf lorsque la composition du système n'évolue plus. L'évolution de x peut être suivi par des méthodes physiques : mesure d'absorbance A, de pH, de conductivité des solutions dans lesquelles se déroulent les transformations. Très souvent, l'évolution de x en fonction du temps pour un système chimique a l'allure de la courbe ci-dessous.3°) Proportions stoechiométriques
Soient ni(A) et ni(B) les quantité initiales de matière des espèces A et B. A et B sont mélangées dans les proportions stoechiométriques si :ni(A) a=ni(B) b Les produits se forment dans les proportions suivantes : ni(A) a=ni(B) b=nf(C) c=nf(D) d4°) Réactifs en excès ou en défaut Si ni(A) a5°) Bilan de matière à l'état final
Si A est le réactif limitant alors A est totalement consommé.On a alors xf =
ni(A) aet nf (A) = 0 (quantité finale de matière de A). Soit nf (B) la quantité finale de matière de B. On a nf (B) = ni (B) - ncons (B) avec ncons (B) = bxf car ncons(B) b= ni(A) a= xf soit nf (B) = ni (B) - bxf Il se forme nf (C) = cxf de C et nf (D) = dxf de D. Si B est limitant, le raisonnement est le même et il suffit de changer A par B dans lesécriture précédentes.
Dans le cas d'une transformation non totale, on définit un avancement maximal xmax correspondant à la consommation totale du réactif limitant même si ce dernier n'est pas entièrement consommé en réalité. On a xmax = ni(réactiflimitant) soncoefficientstoechiométrique6°) Tableau d'avancement
Les résultats précédents peuvent se résumer dans un tableau appelé tableau d'avancement : avancementaAbBcCdDÉtat initialx = 0ni(A)ni(B)00
État
intermédiairex ni(A) -axni(B)-bxcxdxÉtat finalxf ni(A) -axf ni(B) -bxf cxf dxf
Etat maximalxmaxni(A) -axmax ni(B) -bxmax cxmaxdxmax La dernière ligne du tableau peut-être supprimée dans le cas d'une réaction totale.Exemple :
Combustion complète de n(CH4) = 0,5 mol de méthane avec n(O2) = 2,0 mol de dioxygène suivant l'équation bilan CH4 + 2 O2 → CO2 + 2 H2ORéactif limitant ?
On a n(CH4)/1 = 0,5 mol et n(O2)/2 = 1,0 mol. Le méthane est le réactif limitant d'où xmax =
0,5 mol.
A la fin de la réaction, on a nf (CH4) = 0, nf (O2) = 2,0 - 2x0,5 = 1,0 mol ; nf (CO2) = 0,5 mol et nf (H2O) = 2x0,5 = 1,0 mol. Valeurs reportées dans le tableau d'avancement suivant : avancementCH4 2 O2 CO22 H2OÉtat initialx = 00,5200
État
intermédiairex 0,5 - x2,0 - 2xx2xÉtat finalxf = 0,5 mol010,51
quotesdbs_dbs31.pdfusesText_37[PDF] réaction exothermique
[PDF] réaction endothermique
[PDF] combustion du charbon dans l'air
[PDF] les combustions 4ème cours
[PDF] combustion du carbone définition
[PDF] identifier le dioxyde de carbone
[PDF] combustion de l'aluminium
[PDF] combustion du fer et du soufre
[PDF] oxyde magnétique de fer formule
[PDF] combustion du fer dans le dioxygène tableau d avancement
[PDF] combustion du fer wikipedia
[PDF] oxyde de fer fe2o3
[PDF] formule chimique de l'alumine
[PDF] combustion du zinc
