 CCP Chimie 2 PC 2012 — Corrigé
CCP Chimie 2 PC 2012 — Corrigé
fer et à la synthèse diastéréosélective d'un précurseur de l'acide berkelique. ions Fe2+ et Fe3+ on commence par écrire la configuration électronique.
 1. Propriétés du métal. 1.1.1. Configuration électronique 1.1.2
1. Propriétés du métal. 1.1.1. Configuration électronique 1.1.2
Dans les périodes inférieures la taille des ions métalliques aidant
 ch.ci.1:structure de latome et configurations electroniques
ch.ci.1:structure de latome et configurations electroniques
25) et des ions Fer (+II) Fe2+ et Fer (+III) Fe3+ (Fe Z = 26). Ion Mn2+. • La configuration électronique du manganèse (Z = 25) est :.
 PCSI jeudi 22 juin 2017 CHIMIE Filière PC & PSI DEVOIR
PCSI jeudi 22 juin 2017 CHIMIE Filière PC & PSI DEVOIR
2) Quelle est la configuration électronique du chrome dans son état par le fabricant en titrant les ions fer (II) contenus dans une solution préparée à ...
 Le tableau de Mendeleïev
Le tableau de Mendeleïev
Il classe les éléments chimiques en fonction de leur masse et numéro atomique configuration électronique et propriétés chimiques : le tableau de Mendeleïev est
 La structure électronique des complexes des métaux de transition :
La structure électronique des complexes des métaux de transition :
Un complexe est un édifice polyatomique constitué d'un atome ou d'un cation central auquel sont liés des molécules ou ions appelés ligands.
 Corrigé
Corrigé
atomiques pour obtenir la configuration électronique d'un atome. En déduire la configuration électronique du titane. Il faut citer la règle de Klechkowski :.
 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
Il s'agit d'une règle rigoureuse sans exception aucune. Règle de Hund : pour une sous-couche donnée
 Lélément Cobalt
Lélément Cobalt
II - Structure électronique. II-1) Ecrire la configuration électronique d'un atome de fer dans son état fondamental. A quel bloc d'éléments appartient-il?
 wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments. Élément chimique. Série chimique. Configuration électronique n° 1. H. Hydrogène. Non-métal.
 [PDF] 1 Propriétés du métal 111 Configuration électronique 112
[PDF] 1 Propriétés du métal 111 Configuration électronique 112
Le fer est ferromagnétique mou pour le fer a et d dur pour le fer g Il est tenace et ductile 1 3 5 Propriétés chimiques Il est relativement stable à l'
 La configuration électronique du fer - Chimie inorganique descriptive
La configuration électronique du fer - Chimie inorganique descriptive
c- Donner la configuration électronique de Fe puis des ions Fe2+ et Fe3+ Pourquoi Fe3+ est-il l'ion le plus stable ? c- La configuration électronique du fer :
 [PDF] chci1:structure de latome et configurations electroniques
[PDF] chci1:structure de latome et configurations electroniques
1) Donner la configuration électronique pour chacun des ions suivants: Na+ O2- F- Cu+ S2- Cr3+ Mn2+ 2) Représenter la configuration de valence au moyen
 [PDF] Chapitre 3 :Structure électronique des atomes - Melusine
[PDF] Chapitre 3 :Structure électronique des atomes - Melusine
Chaque colonne contient les éléments qui ont la même configuration électronique de valence On observe une structure en blocs (voir chapitre 1 : classification
 [PDF] Règles de remplissage pour les atomes polyélectroniques
[PDF] Règles de remplissage pour les atomes polyélectroniques
Il s'agit d'une règle rigoureuse sans exception aucune Règle de Hund : pour une sous-couche donnée la configuration électronique de plus basse énergie est
 Configuration electronique du Fer - Ile physique
Configuration electronique du Fer - Ile physique
Donner la configuration électronique du fer (Fe: Z=26) dans son état fondamental Préciser les électrons de coeur et de valence de cet atome
 [PDF] Exercices : écritures de configurations électroniques - Chimie en PCSI
[PDF] Exercices : écritures de configurations électroniques - Chimie en PCSI
Exercice 4 : configuration électronique de quelques ions 1) Préciser la configuration électronique c) ion Fe2+ numéro atomique du fer : Z = 26
 [PDF] Structure électronique des atomes - Étienne Thibierge
[PDF] Structure électronique des atomes - Étienne Thibierge
12 déc 2018 · Au programme Ce que vous devez savoir et savoir faire ? Définir les nombres quantiques n l ml et ms et connaître les valeurs qu'ils
Quelle est la configuration électronique de l'atome de fer ?
Pourquoi Fe3+ est-il l'ion le plus stable ? L'ion Fe+ = 1s2 2s2 2p6 3s2 3p6 3d5 4s2 car la sous couche 4s est complète et la sous couche 3d est semi pleine ce qui est la configuration la plus stable après la perte d'un électron.Pourquoi Fe 3+ ?
Il poss? donc 26 - 18 = 8 électrons de valence à répartir sur les sous-couches 3d et 4s suivant la règle de Klechkovski.
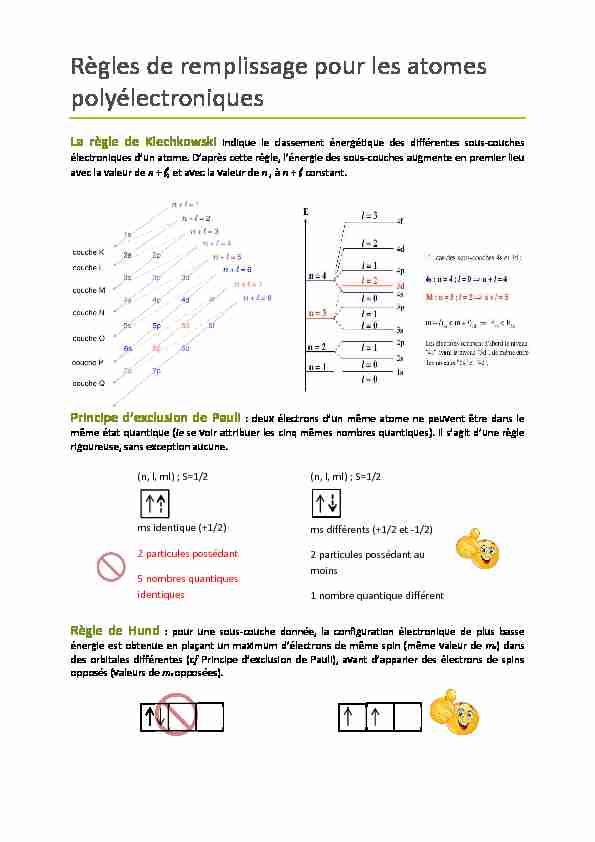
Règles de remplissage pour les atomes
polyélectroniquesLa règle de Klechkowski indique le classement énergétique des différentes sous-couches
électroniques d'un atome. D'après cette règle, l'énergie des sous-couches augmente en premier lieu
avec la valeur de n + l, et avec la valeur de n , à n + l constant. Principe d'exclusion de Pauli : deux électrons d'un même atome ne peuvent être dans lemême état quantique (ie se voir attribuer les cinq mêmes nombres quantiques). Il s'agit d'une règle
rigoureuse, sans exception aucune. Règle de Hund : pour une sous-couche donnée, la configuration électronique de plus basse énergie est obtenue en plaçant un maximum d'électrons de même spin (même valeur de m s) dansdes orbitales différentes (cf Principe d'exclusion de Pauli), avant d'apparier des électrons de spins
opposés (valeurs de m s opposées). (n, l, ml) ; S=1/2 ms identique (+1/2)2 particules possédant
5 nombres quantiques
identiques (n, l, ml) ; S=1/2 ms différents (+1/2 et -1/2)2 particules possédant au
moins1 nombre quantique différent
État fondamental
Afin de répartir tous les électrons d'un atome dans les différentes orbitales atomiques, celles-ci sont
classées par énergie croissante et les électrons sont répartis prioritairement dans les orbitales
d'énergie les plus faibles (utilisation de la règle de Klechkowski). On obtient alors la répartition
électronique pour l'atome dans son état fondamental.Configuration électronique
La répartition des électrons d'un atome dans les orbitales atomiques s'écrit de la façon suivante :
2s1 occupation électronique de la sous-couche
valeur de n type de l'OA (valeur de l) couche sous-couchePour les atomes ayant plusieurs couches électroniques totalement remplies, la notation peut devenir
très longue. On peut alors abréger la notation en indiquant que la configuration des électrons de
coeur (électrons d'une couche électronique totalement remplie, à l'exception des couches d ou f) a
une configuration identique à celle du gaz rare qui précède l'élément. Le phosphore, par exemple, ne
diffère du néon (1s2 2s2 2p6) que par la présence d'une troisième couche. Donc la configuration
électronique du néon est retirée, et le phosphore est noté ainsi : [Ne]3s2 3p3.Cations et Anions
Pour établir la configuration électronique d'un atome non neutre, il faut d'abord chercher celle de
l'atome neutre puis lui retirer (cations) ou lui ajouter (anions) les électrons. En effet, la règle de
Klechkowski ne s'applique qu'aux atomes neutres. Par exemple,26Fe3+ :
Fe -> Fe3+ + 3e
26Fe : [18Ar] 4s2 3d6
on retire les électrons les plus externes en premier : 4s puis 3d26Fe3+ : [18Ar] 4s0 3d5
et non 26Fe3+ 26-3 = 23 électrons => [18Ar] 4s2 3d3 qui est la configuration électronique du Vanadium 23VExceptions
Cette approche simple par les nombres quantiques souffre néanmoins d'un certain nombred'exceptions, en particulier parmi les métaux de transition et les lanthanides ; les règles de
remplissage ne sont qu'une approximation de la mécanique quantique qui décrit les atomes.Une sous-couche à moitié remplie conduit à une configuration de spin maximal, ce qui lui confère
une certaine stabilité en vertu de la règle de Hund. Par exemple, le chrome (numéro atomique 24) a
une configuration électronique [Ar] 3d54s1, et non [Ar] 3d4 4s2. De la même façon, le cuivre (numéro
atomique 29) a une configuration électronique [Ar] 3d10 4s1, et non [Ar] 3d9 4s2, ce qui permet d'avoir
la couche 3d pleine et la couche 4s à demi-pleine.Généralement, les exceptions se trouvent lors que les configurations électroniques sont du type :
(n-1)d4 ns2 remplacé par (n-1)d5 ns1
(n-1)d9 ns2 remplacé par (n-1)d10 ns1
quotesdbs_dbs31.pdfusesText_37[PDF] règle de klechkowski explication simple
[PDF] nombres quantiques exercices corrigés
[PDF] les nombres quantiques exercices corrigés pdf
[PDF] exercices sur configuration électronique d un atome
[PDF] représentation de lewis exercices pdf
[PDF] règle de klechkowski exception
[PDF] configuration electronique ion
[PDF] reséau informatique ppt
[PDF] reséau informatique cours complet pdf
[PDF] reséau informatique cours ppt
[PDF] projet maintenance informatique pdf
[PDF] les droites ab et cd sont elles parallèles vecteurs
[PDF] exercice calculer les coordonnées du milieu d un segment
[PDF] exercices corrigés de stéréoisomérie
