Classification qualitativ redox: ion métalliqu Classification qualitative
Classification qualitativ redox: ion métalliqu Classification qualitative
contenant une solution de sulfate de fer FeSO4 une lame de zinc et at ration vert pâle due à la présence d'ion Fe2+ devient ve un dépôt métallique de Fer sur ...
 Expérience dune plaque de zinc plongée dans du sulfate de cuivre
Expérience dune plaque de zinc plongée dans du sulfate de cuivre
- Une solution de sulfate de cuivre de concentration égale à 05 mol/L. - Une lame de zinc (bien poncée pour enlever la couche d'oxyde de zinc qui se forme.
 I .Classification électrochimique des couples redo Matériel : lame de
I .Classification électrochimique des couples redo Matériel : lame de
lame de zinc + solution molaire de sulfate de zinc lame de cuivre + solution lame de fer + solution molaire de sulfate de fer ponts ioniques (papier ...
 Classification électrochimique des métaux
Classification électrochimique des métaux
Seul le zinc a agi comme réducteur. On dit que le zinc est plus réducteur que le fer. solution aqueuse de sulfate de fer lame de cuivre. B.
 Un jardinier bien embété !!!
Un jardinier bien embété !!!
Hypothèses : soit réaction avec sulfate de cuivre chaux
 Réaction doxydoréduction - Correction
Réaction doxydoréduction - Correction
On plonge une lame de zinc dans un bécher contenant un volume V = 50 mL d'une solution bleue de sulfate de cuivre II de concentration c = 0.1 mol.L-1.
 20 min 35 min
20 min 35 min
Pour réaliser une pile zinc-fer le laborantin fournit : – une lame de fer aqueuse de sulfate de fer (II)
 Série dexercices : réactions doxydo-réduction pr
Série dexercices : réactions doxydo-réduction pr
On émerge une plaque de zinc Zn dans une solution de nitrate d'argent (Ag+. (aq) sulfate de fer II (Fe. 2+. +SO4. 2-. ) de concentration C2=04mol/L. 1)Ecrire ...
 Oxydoréduction – corrigé des exercices Table des matières
Oxydoréduction – corrigé des exercices Table des matières
mole de zinc est dissoute de la lame de Zn. D'abord on calcule le nombre de La concentration en sulfate de zinc augmente et celle de sulfate de nickel ...
 Classification qualitative des couples : ion métallique – métal
Classification qualitative des couples : ion métallique – métal
e peut pas réduire l'ion Zn2+ de même l'ion Zn2+ ne peut pas oxyder le fer. contenant une solution de sulfate de fer FeSO4 une lame de zinc
 TD1 – Léquilibre rédox
TD1 – Léquilibre rédox
1) lame de fer plongée dans une solution de sulfate de fer (II) dissocié en Fe la demi-pile (1) constituée d'une électrode de zinc Zn plongée dans une ...
 TD Chimie SD2 2018-2019
TD Chimie SD2 2018-2019
1) lame de fer plongée dans une solution de sulfate de fer (II) dissocié en Fe2+ et SO4. 2- à 500*10-3 mol.L-1 ;. 2) lame de zinc plongée dans une solution
 ? Zn2+
? Zn2+
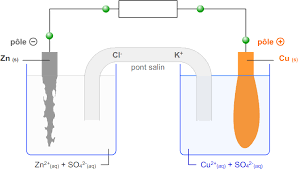
Attention : on ajoute les électrons toujours du côté de l'oxydant. Lame de cuivre Cu. Sulfate de zinc. (Zn2+ SO4. 2?). Lame de zinc. Zn. Sulfate de cuivre.
 Oxydo-réduction et corrosion
Oxydo-réduction et corrosion
Les ions cuivre Cu2+ ont oxydé le fer : l'ion Cu2+ est un oxydant Compartiment de gauche : une lame de zinc dans une solution de sulfate de zinc.
 OXYDANT et REDUCTEUR réduction et oxydation
OXYDANT et REDUCTEUR réduction et oxydation
Mélange de deux poudres : oxyde de fer Fe2O3s (rouge-brun) et aluminium Als (gris clair). a- Lame de zinc Zn et sulfate de cuivre II (Cu.
 Sujet CCF BAC Sciences
Sujet CCF BAC Sciences
zinc on dispose du matériel suivant : • Des béchers. • des lames de matériau différent : fer
 AE 3 - La conservation des éléments chimiques
AE 3 - La conservation des éléments chimiques
Lame de zinc. • Solution de sulfate de cuivre (Cu2+ + SO4. 2-). • Solution d'hydroxyde de sodium (Na+ + HO-). • Solution de sulfate de fer II (Fe2+ + SO4.
 Devoir Surveillé de Chimie
Devoir Surveillé de Chimie
001 mole de sulfate de fer (II) et 10-3 mole de sulfate de fer (III). - La demi-pile n° 2 est constituée d'une lame de zinc plongeant dans 100 mL d'une
 T.3 T.P. N°2 Oxydoréduction – Classement des métaux par
T.3 T.P. N°2 Oxydoréduction – Classement des métaux par
Solutions : Sulfate de cuivre II. Sulfate de fer II. Sulfate de zinc. Nitrate d'argent. Nitrate de mercure II. Acide chlorhydrique. Différentes lames : Lame
 [PDF] une lame de zinc un bécher contenant une solution de sulfate de
[PDF] une lame de zinc un bécher contenant une solution de sulfate de
? Matériel : une lame de zinc un bécher contenant une solution de sulfate de cuivre ? Expérience et Observations : On admet que les ions SO4
 LOXYDOREDUCTION
LOXYDOREDUCTION
On dit que le métal zinc est oxydé tandis que les ions hydrogènes sont réduits Si on fait l'inverse lame de cuivre dans sulfate de fer il ne se passe
 [PDF] Oxydo-Réduction Objectifs: Réaliser une réaction entre un métal et
[PDF] Oxydo-Réduction Objectifs: Réaliser une réaction entre un métal et
Solution de sulfate de cuivre ( initialement bleue ) • Paille de fer Les ions cuivre Cu2+ ont oxydé le fer : l'ion Cu2+ est un oxydant
 [PDF] Contrôle de CHIMIE n°2
[PDF] Contrôle de CHIMIE n°2
2) 2 lames de zinc et une solution de sulfate de cuivre NON 3) 1 lame de zinc fer On observe un dégagement gazeux Le pH de la solution finale est 4
 [PDF] Réaction doxydoréduction - Correction - AlloSchool
[PDF] Réaction doxydoréduction - Correction - AlloSchool
On plonge une lame de zinc dans un bécher contenant un volume V = 50 mL d'une solution bleue de sulfate de cuivre II de concentration c = 0 1 mol L-1
 [PDF] La corrosion
[PDF] La corrosion
Refaisons la même expérience mais avec une lame de zinc à la place du cuivre : Fer Eau désaérée contenant NaCl 1 mol L-1 Zinc OBSERVATIONS :
 [PDF] Quelques expériences sur la corrosion du fer - Sites ENSFEA
[PDF] Quelques expériences sur la corrosion du fer - Sites ENSFEA
1) Matériel et produit sur la paillasse de l'élève - un bécher de 250 mL ; - une lame de fer et une lame de cuivre ; - papier pour décaper - pinces
 [PDF] OXYDANT et REDUCTEUR réduction et oxydation
[PDF] OXYDANT et REDUCTEUR réduction et oxydation
Avec la phosphatation (parkérisation) le métal est immergé dans une solution chaude de sulfates de zinc de fer de manganèse Il se forme une pellicule de
 [PDF] ion métalliqu Classification qualitative des couples : ion métallique
[PDF] ion métalliqu Classification qualitative des couples : ion métallique
ration vert pâle due à la présence d'ion Fe2+ devient ve un dépôt métallique de Fer sur la lame de Zinc de Zinc cède 2 électrons à l'ion Fe2+ Le Zinc a réduit
 [PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
[PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
On plonge une lame de zinc dans une solution de sulfate de cuivre II (couleur bleue) Observations des élèves : La partie immergée de la plaque est recouverte d
T Expérience et Observations :
On admet que les ions SO42- ne participent pas à la réaction RQ GLP TX·LOV VRQP spectateurs.
Pourquoi peut-RQ GLUH TX·LO \ M HX XQH PUMQVIRUPMPLRQ ŃOLPLTXH ?Un dépôt brun orangé pas présent au départ apparaît et la couleur du sulfate de cuivre (bleue)
disparaît. Il se passe donc quelque chose dans le bécher. e Interprétation a- Identification des réactifs4X·LQGLTXH OM ŃRORUMPLRQ GH OM VROXPLRQ GH GpSMUP ? Cela indique que des ions Cu2+ (ce sont eux qui
donnent la couleur bleue à la solution) ont disparu.4XHO HVP O·MXPUH UpMŃPLI ? ?
NOM """""""""""""""35(120 """"""""""""""" FI$66( """""""""""G$7( """C"""C"""Lame de zinc
(Zn)Sulfate de cuivre :
(Cu2+ , SO42-)Dépôt brun
orangéLa solution de
sulfate de cuivre se décoloreDébut :
Après:
Zn Zn Zn Zn Zn Zn Zn Cu2 Cu2 Cu2 SO4 2- SO4 2- SO4 2- Cu2 SO4 2-Lame de zinc
Atome de zinc
Molécule eau
Ions cuivres
Ions sulfates
Comme les ions SO42- sont
spectateurs, ils ne participentSMV j OM UpMŃPLRQB F·HVP GRQŃ OH
]LQŃ =Q TXL HVP O·MXPUH UpMŃPLIB Chimie Ȃ Dossier 5 Ȃ Activité 2 Correction Page 2 b- Identification des produits Observe les étapes 1 et 2 schématisées ci-dessous.Quelle est la nature du dépôt orangé observé ? La couleur brun orangé montre que ce dépôt est du
cuivre.4XH GHYLHQP O·MPRPH GH ]LQŃ ? LO V·HVP PUMQVIRUPp HQ LRQ =Q 2+
f Bilan de la transformation chimique3UpŃLVH VL O·espèce est un atome ou un ion
Réactif 1 + Réactif 2 Produit 1 + Produit 2
g Interprétation de la transformation 4XH V·HVP-il passé pour le réactif Zn ? I·MPRPH =Q V·HVP PUMQVIRUPp HQ Zn2+ en perdant 2 e-.Zn Zn2+ + 2 e-
4XH V·HVP-il passé pour le réactif Cu2+ ? I·LRQ FX2+ V·HVP PUMQVIRUPp HQ Cu en gagnant 2 e-Cu2+ + 2 e- Cu
GRQŃ ORUV GH OM PUMQVIRUPMPLRQ O·LRQ FX2+ a capturé les 2e- OLNpUpV SMU O·MPRPH GH ]LQŃ =Q SRXU IRUPHU XQ
atome de cuivre Cu. U Equation de réaction de la transformation chimique Zn Zn Zn Zn Zn Zn Zn Zn Cu2+ Cu2+ Cu2+ SO42- SO42- SO42- Cu2+ SO42-Etape 1
Zn Zn Zn Zn Zn Zn Cu Zn Cu2+ Cu2+ Zn2+ SO42- SO42- SO42- Cu2+ SO42-Etape 2
Cu2+ Zn Cu Zn2+Ions cuivres
Cu2+Atome de zinc
ZnAtome de
cuivre CuIon Zinc
Zn2+ Chimie Ȃ Dossier 5 Ȃ Activité 2 Correction Page 3IRUV GH OM PUMQVIRUPMPLRQ SUpŃpGHQPH LO \ M pŃOMQJH G·pOHŃPURQV HQPUH FX2+ et Zn. Cet échange
G·pOHŃPURQV VH IMLP ORUVTXH O·LRQ FX2+ HP O·MPRPH =Q VRQP HQ ŃRQPMŃPB2Q VMLP TXH OH ŃRXUMQP GMQV OHV ILOV ŃRQGXŃPHXUV ŃRUUHVSRQG j XQ GpSOMŃHPHQP G·pOHŃPURQVB 1H
pourrait-RQ SMV XPLOLVHU ŃHP pŃOMQJH G·pOHŃPURQV SRXU SURGXLUH XQ ŃRXUMQP ?HO VXIILP G·pORLJQHU O·LRQ FX2+ GH O·MPRPH =Q HP GH OHV UHOLHU SMU XQ ILO ŃRQGXŃPHXUB HOV ŃRQPLQXHUMLHQP
Ainsi, on crée un courant électrique dans le fil grâce à la transformation chimique. c Schématiser la pile Daniell : T ([SOLTXHU SRXUTXRL OM OMPH GH ]LQŃ V·XVHB (ŃULUH OM PUMQVIRUPMPLRQ PLVH HQ ÓHXB Zn Zn2+ + 2 e-Fil conducteur
Zn disparaît OM OMPH GH ]LQŃ V·XVHB
Chimie Ȃ Dossier 5 Ȃ Activité 2 Correction Page 4 e ([SOLTXHU SRXUTXRL OM OMPH GH ŃXLYUH V·pSMLVVLPB (ŃULUH OM PUMQVIRUPMPLRQ PLVH HQ ÓHXBCu2+ + 2 e- Cu
f 3RXUTXRL OM SLOH V·XVH-t-elle ? $X NRXP G·XQ ŃHUPMLQ PHPSV G·XPLOLVDWLRQODSLOHQquotesdbs_dbs4.pdfusesText_8[PDF] systeme lineaire et matrice
[PDF] résolution des systèmes d'équations linéaires
[PDF] système de cramer matrice
[PDF] relier 12 points avec 5 droites
[PDF] relier 9 points en 3 traits sans lever le crayon
[PDF] enigme relier 9 points sans croiser
[PDF] relier 9 points en 4 traits sans croiser
[PDF] exercices gratuits écrits professionnels
[PDF] problème des 9 points
[PDF] heure légale fermeture restaurant
[PDF] relier 9 points en 1 trait
[PDF] fermeture tardive restaurant
[PDF] enigme relier 6 points sans croiser
[PDF] horaire fermeture bar de nuit