 Classification qualitativ redox: ion métalliqu Classification qualitative
Classification qualitativ redox: ion métalliqu Classification qualitative
contenant une solution de sulfate de fer FeSO4 une lame de zinc et at ration vert pâle due à la présence d'ion Fe2+ devient ve un dépôt métallique de Fer sur ...
 une lame de zinc un bécher contenant une solution de sulfate de
une lame de zinc un bécher contenant une solution de sulfate de
Pourquoi peut-on dire qu'il y a eu une transformation chimique ? Un dépôt brun orangé pas présent au départ apparaît et la couleur du sulfate de cuivre (bleue).
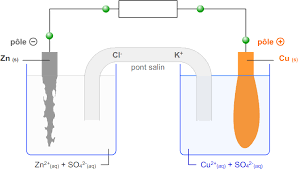
 Expérience dune plaque de zinc plongée dans du sulfate de cuivre
Expérience dune plaque de zinc plongée dans du sulfate de cuivre
- Une solution de sulfate de cuivre de concentration égale à 05 mol/L. - Une lame de zinc (bien poncée pour enlever la couche d'oxyde de zinc qui se forme.
 I .Classification électrochimique des couples redo Matériel : lame de
I .Classification électrochimique des couples redo Matériel : lame de
lame de zinc + solution molaire de sulfate de zinc lame de cuivre + solution lame de fer + solution molaire de sulfate de fer ponts ioniques (papier ...
 Classification électrochimique des métaux
Classification électrochimique des métaux
Seul le zinc a agi comme réducteur. On dit que le zinc est plus réducteur que le fer. solution aqueuse de sulfate de fer lame de cuivre. B.
 Un jardinier bien embété !!!
Un jardinier bien embété !!!
Hypothèses : soit réaction avec sulfate de cuivre chaux
 Réaction doxydoréduction - Correction
Réaction doxydoréduction - Correction
On plonge une lame de zinc dans un bécher contenant un volume V = 50 mL d'une solution bleue de sulfate de cuivre II de concentration c = 0.1 mol.L-1.
 20 min 35 min
20 min 35 min
Pour réaliser une pile zinc-fer le laborantin fournit : – une lame de fer aqueuse de sulfate de fer (II)
 Série dexercices : réactions doxydo-réduction pr
Série dexercices : réactions doxydo-réduction pr
On émerge une plaque de zinc Zn dans une solution de nitrate d'argent (Ag+. (aq) sulfate de fer II (Fe. 2+. +SO4. 2-. ) de concentration C2=04mol/L. 1)Ecrire ...
 Oxydoréduction – corrigé des exercices Table des matières
Oxydoréduction – corrigé des exercices Table des matières
mole de zinc est dissoute de la lame de Zn. D'abord on calcule le nombre de La concentration en sulfate de zinc augmente et celle de sulfate de nickel ...
 Classification qualitative des couples : ion métallique – métal
Classification qualitative des couples : ion métallique – métal
e peut pas réduire l'ion Zn2+ de même l'ion Zn2+ ne peut pas oxyder le fer. contenant une solution de sulfate de fer FeSO4 une lame de zinc
 TD1 – Léquilibre rédox
TD1 – Léquilibre rédox
1) lame de fer plongée dans une solution de sulfate de fer (II) dissocié en Fe la demi-pile (1) constituée d'une électrode de zinc Zn plongée dans une ...
 TD Chimie SD2 2018-2019
TD Chimie SD2 2018-2019
1) lame de fer plongée dans une solution de sulfate de fer (II) dissocié en Fe2+ et SO4. 2- à 500*10-3 mol.L-1 ;. 2) lame de zinc plongée dans une solution
 ? Zn2+
? Zn2+
Attention : on ajoute les électrons toujours du côté de l'oxydant. Lame de cuivre Cu. Sulfate de zinc. (Zn2+ SO4. 2?). Lame de zinc. Zn. Sulfate de cuivre.
 Oxydo-réduction et corrosion
Oxydo-réduction et corrosion
Les ions cuivre Cu2+ ont oxydé le fer : l'ion Cu2+ est un oxydant Compartiment de gauche : une lame de zinc dans une solution de sulfate de zinc.
 OXYDANT et REDUCTEUR réduction et oxydation
OXYDANT et REDUCTEUR réduction et oxydation
Mélange de deux poudres : oxyde de fer Fe2O3s (rouge-brun) et aluminium Als (gris clair). a- Lame de zinc Zn et sulfate de cuivre II (Cu.
 Sujet CCF BAC Sciences
Sujet CCF BAC Sciences
zinc on dispose du matériel suivant : • Des béchers. • des lames de matériau différent : fer
 AE 3 - La conservation des éléments chimiques
AE 3 - La conservation des éléments chimiques
Lame de zinc. • Solution de sulfate de cuivre (Cu2+ + SO4. 2-). • Solution d'hydroxyde de sodium (Na+ + HO-). • Solution de sulfate de fer II (Fe2+ + SO4.
 Devoir Surveillé de Chimie
Devoir Surveillé de Chimie
001 mole de sulfate de fer (II) et 10-3 mole de sulfate de fer (III). - La demi-pile n° 2 est constituée d'une lame de zinc plongeant dans 100 mL d'une
 T.3 T.P. N°2 Oxydoréduction – Classement des métaux par
T.3 T.P. N°2 Oxydoréduction – Classement des métaux par
Solutions : Sulfate de cuivre II. Sulfate de fer II. Sulfate de zinc. Nitrate d'argent. Nitrate de mercure II. Acide chlorhydrique. Différentes lames : Lame
 [PDF] une lame de zinc un bécher contenant une solution de sulfate de
[PDF] une lame de zinc un bécher contenant une solution de sulfate de
? Matériel : une lame de zinc un bécher contenant une solution de sulfate de cuivre ? Expérience et Observations : On admet que les ions SO4
 LOXYDOREDUCTION
LOXYDOREDUCTION
On dit que le métal zinc est oxydé tandis que les ions hydrogènes sont réduits Si on fait l'inverse lame de cuivre dans sulfate de fer il ne se passe
 [PDF] Oxydo-Réduction Objectifs: Réaliser une réaction entre un métal et
[PDF] Oxydo-Réduction Objectifs: Réaliser une réaction entre un métal et
Solution de sulfate de cuivre ( initialement bleue ) • Paille de fer Les ions cuivre Cu2+ ont oxydé le fer : l'ion Cu2+ est un oxydant
 [PDF] Contrôle de CHIMIE n°2
[PDF] Contrôle de CHIMIE n°2
2) 2 lames de zinc et une solution de sulfate de cuivre NON 3) 1 lame de zinc fer On observe un dégagement gazeux Le pH de la solution finale est 4
 [PDF] Réaction doxydoréduction - Correction - AlloSchool
[PDF] Réaction doxydoréduction - Correction - AlloSchool
On plonge une lame de zinc dans un bécher contenant un volume V = 50 mL d'une solution bleue de sulfate de cuivre II de concentration c = 0 1 mol L-1
 [PDF] La corrosion
[PDF] La corrosion
Refaisons la même expérience mais avec une lame de zinc à la place du cuivre : Fer Eau désaérée contenant NaCl 1 mol L-1 Zinc OBSERVATIONS :
 [PDF] Quelques expériences sur la corrosion du fer - Sites ENSFEA
[PDF] Quelques expériences sur la corrosion du fer - Sites ENSFEA
1) Matériel et produit sur la paillasse de l'élève - un bécher de 250 mL ; - une lame de fer et une lame de cuivre ; - papier pour décaper - pinces
 [PDF] OXYDANT et REDUCTEUR réduction et oxydation
[PDF] OXYDANT et REDUCTEUR réduction et oxydation
Avec la phosphatation (parkérisation) le métal est immergé dans une solution chaude de sulfates de zinc de fer de manganèse Il se forme une pellicule de
 [PDF] ion métalliqu Classification qualitative des couples : ion métallique
[PDF] ion métalliqu Classification qualitative des couples : ion métallique
ration vert pâle due à la présence d'ion Fe2+ devient ve un dépôt métallique de Fer sur la lame de Zinc de Zinc cède 2 électrons à l'ion Fe2+ Le Zinc a réduit
 [PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
[PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
On plonge une lame de zinc dans une solution de sulfate de cuivre II (couleur bleue) Observations des élèves : La partie immergée de la plaque est recouverte d
T3 TP N° 2 Oxydoréduction Classement des métaux par électropositivité croissante Page 1 / 3
T.3 T.P. N°2 Oxydoréduction - Classement des métaux parélectropositivité croissante
I) Objectif :
L'objectif de ce T.P. est de classer les métaux en fonction de leur électropositivité croissante. On introduira l'élément hydrogène dans ce classement. II)Matériel :
Logiciel de simulation informatique
Sinon1 bécher
1 pissette contenant de l'eau distillée
1 chiffon
Solutions : Sulfate de cuivre II
Sulfate de fer II
Sulfate de zinc
Nitrate d'argent Nitrate de mercure IIAcide chlorhydrique
Différentes lames : Lame de fer
Lame de cuivre
Lame de zinc
Lame d'argent
Lame d'aluminium
III) Données :
Une oxydoréduction se traduit par un transfert d'électrons. Dans ce transfert, un atomecède un ou plusieurs électrons, il devient un ion positif et on dit qu'il a été oxydé. Ces
électrons sont captés par un ion en solution, cet ion redevient atome et se dépose surl'élément dont sont issus les électrons. On dit qu'il a été réduit. Cette réaction ne peut
avoir lieu que si l'électropositivité de l'élément qui perd ses électrons est plus grande
que celle de l'élément qui les gagne. IV)Protocole expérimental :
L'expérience consiste à mettre dans un
bécher une solution ionique et à y introduire une lame de métal. Lorsque ce métal est plus électropositif que l'élément correspondant à l'ion en solution, celui-ci capte les électrons arrachés à ce métal. Cette réaction est visible puisque celui-ci redevient solide, ou gazeux dans le cas de l'hydrogène.V) Observation :
On effectue plusieurs fois l'expérience en introduisant chaque lame dans toutes les solutions. (Attention : la simulation informatique donne des résultats presqueT3 TP N° 2 Oxydoréduction Classement des métaux par électropositivité croissante Page 2 / 3
instantanément, une durée de réaction plus ou moins longue est parfois nécessaire pour l'observation d'un résultat.) Lorsqu'il y a réaction, on complète d'une croix la case correspondante à la lame et à la solution. Lorsque toutes les manipulations sont terminées, on procédera au classement des éléments métalliques par électropositivité croissante. Pour cela on tiendra compte du phénomène suivant :Lorsqu'un élément A se dépose sur un élément B ou qu'il réagit avec cet élément B, c'est
que l'électropositivité de cet élément B est plus grande. En effet, l'élément B cède plus
facilement ses électrons que l'élément A.Solutions
Lame de
ferLame de cuivreLame de zincLame d'argentLame d'aluminiumSulfate de fer II
FeSulfate de cuivre II
CuSulfate de zinc
ZnNitrate d'argent
AgNitrate de mercure II
HgAcide chlorhydrique
H Classement des éléments métalliques par électropositivité croissante. Reportez les différents éléments suivants dans les cases ci-dessous afin d'obtenir leur classement.Al Ag Cu Fe H Hg Zn
Electropositivité
Croissante
T3 TP N° 2 Oxydoréduction Classement des métaux par électropositivité croissante Page 3 / 3
VI) Explication :
Les couples oxydant réducteurs sont classés en fonction de leur pouvoir oxydant ou réducteur.C'est l'
le plus fort qui réagit avec le le plus fort. La règle du gamma permet de déterminer le sens de la réaction.PouvoirOxydant 1 / Réducteur 1Pouvoir
OxydantRéducteur
CroissantOxydant 2 / Réducteur 2Croissant
Oxydant 1 + Réducteur 2 Oxydant 2 + Réducteur 1quotesdbs_dbs45.pdfusesText_45[PDF] systeme lineaire et matrice
[PDF] résolution des systèmes d'équations linéaires
[PDF] système de cramer matrice
[PDF] relier 12 points avec 5 droites
[PDF] relier 9 points en 3 traits sans lever le crayon
[PDF] enigme relier 9 points sans croiser
[PDF] relier 9 points en 4 traits sans croiser
[PDF] exercices gratuits écrits professionnels
[PDF] problème des 9 points
[PDF] heure légale fermeture restaurant
[PDF] relier 9 points en 1 trait
[PDF] fermeture tardive restaurant
[PDF] enigme relier 6 points sans croiser
[PDF] horaire fermeture bar de nuit
