 Classification qualitativ redox: ion métalliqu Classification qualitative
Classification qualitativ redox: ion métalliqu Classification qualitative
contenant une solution de sulfate de fer FeSO4 une lame de zinc et at ration vert pâle due à la présence d'ion Fe2+ devient ve un dépôt métallique de Fer sur ...
 une lame de zinc un bécher contenant une solution de sulfate de
une lame de zinc un bécher contenant une solution de sulfate de
Pourquoi peut-on dire qu'il y a eu une transformation chimique ? Un dépôt brun orangé pas présent au départ apparaît et la couleur du sulfate de cuivre (bleue).
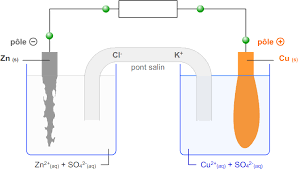
 Expérience dune plaque de zinc plongée dans du sulfate de cuivre
Expérience dune plaque de zinc plongée dans du sulfate de cuivre
- Une solution de sulfate de cuivre de concentration égale à 05 mol/L. - Une lame de zinc (bien poncée pour enlever la couche d'oxyde de zinc qui se forme.
 I .Classification électrochimique des couples redo Matériel : lame de
I .Classification électrochimique des couples redo Matériel : lame de
lame de zinc + solution molaire de sulfate de zinc lame de cuivre + solution lame de fer + solution molaire de sulfate de fer ponts ioniques (papier ...
 Classification électrochimique des métaux
Classification électrochimique des métaux
Seul le zinc a agi comme réducteur. On dit que le zinc est plus réducteur que le fer. solution aqueuse de sulfate de fer lame de cuivre. B.
 Un jardinier bien embété !!!
Un jardinier bien embété !!!
Hypothèses : soit réaction avec sulfate de cuivre chaux
 Réaction doxydoréduction - Correction
Réaction doxydoréduction - Correction
On plonge une lame de zinc dans un bécher contenant un volume V = 50 mL d'une solution bleue de sulfate de cuivre II de concentration c = 0.1 mol.L-1.
 20 min 35 min
20 min 35 min
Pour réaliser une pile zinc-fer le laborantin fournit : – une lame de fer aqueuse de sulfate de fer (II)
 Série dexercices : réactions doxydo-réduction pr
Série dexercices : réactions doxydo-réduction pr
On émerge une plaque de zinc Zn dans une solution de nitrate d'argent (Ag+. (aq) sulfate de fer II (Fe. 2+. +SO4. 2-. ) de concentration C2=04mol/L. 1)Ecrire ...
 Oxydoréduction – corrigé des exercices Table des matières
Oxydoréduction – corrigé des exercices Table des matières
mole de zinc est dissoute de la lame de Zn. D'abord on calcule le nombre de La concentration en sulfate de zinc augmente et celle de sulfate de nickel ...
 Classification qualitative des couples : ion métallique – métal
Classification qualitative des couples : ion métallique – métal
e peut pas réduire l'ion Zn2+ de même l'ion Zn2+ ne peut pas oxyder le fer. contenant une solution de sulfate de fer FeSO4 une lame de zinc
 TD1 – Léquilibre rédox
TD1 – Léquilibre rédox
1) lame de fer plongée dans une solution de sulfate de fer (II) dissocié en Fe la demi-pile (1) constituée d'une électrode de zinc Zn plongée dans une ...
 TD Chimie SD2 2018-2019
TD Chimie SD2 2018-2019
1) lame de fer plongée dans une solution de sulfate de fer (II) dissocié en Fe2+ et SO4. 2- à 500*10-3 mol.L-1 ;. 2) lame de zinc plongée dans une solution
 ? Zn2+
? Zn2+
Attention : on ajoute les électrons toujours du côté de l'oxydant. Lame de cuivre Cu. Sulfate de zinc. (Zn2+ SO4. 2?). Lame de zinc. Zn. Sulfate de cuivre.
 Oxydo-réduction et corrosion
Oxydo-réduction et corrosion
Les ions cuivre Cu2+ ont oxydé le fer : l'ion Cu2+ est un oxydant Compartiment de gauche : une lame de zinc dans une solution de sulfate de zinc.
 OXYDANT et REDUCTEUR réduction et oxydation
OXYDANT et REDUCTEUR réduction et oxydation
Mélange de deux poudres : oxyde de fer Fe2O3s (rouge-brun) et aluminium Als (gris clair). a- Lame de zinc Zn et sulfate de cuivre II (Cu.
 Sujet CCF BAC Sciences
Sujet CCF BAC Sciences
zinc on dispose du matériel suivant : • Des béchers. • des lames de matériau différent : fer
 AE 3 - La conservation des éléments chimiques
AE 3 - La conservation des éléments chimiques
Lame de zinc. • Solution de sulfate de cuivre (Cu2+ + SO4. 2-). • Solution d'hydroxyde de sodium (Na+ + HO-). • Solution de sulfate de fer II (Fe2+ + SO4.
 Devoir Surveillé de Chimie
Devoir Surveillé de Chimie
001 mole de sulfate de fer (II) et 10-3 mole de sulfate de fer (III). - La demi-pile n° 2 est constituée d'une lame de zinc plongeant dans 100 mL d'une
 T.3 T.P. N°2 Oxydoréduction – Classement des métaux par
T.3 T.P. N°2 Oxydoréduction – Classement des métaux par
Solutions : Sulfate de cuivre II. Sulfate de fer II. Sulfate de zinc. Nitrate d'argent. Nitrate de mercure II. Acide chlorhydrique. Différentes lames : Lame
 [PDF] une lame de zinc un bécher contenant une solution de sulfate de
[PDF] une lame de zinc un bécher contenant une solution de sulfate de
? Matériel : une lame de zinc un bécher contenant une solution de sulfate de cuivre ? Expérience et Observations : On admet que les ions SO4
 LOXYDOREDUCTION
LOXYDOREDUCTION
On dit que le métal zinc est oxydé tandis que les ions hydrogènes sont réduits Si on fait l'inverse lame de cuivre dans sulfate de fer il ne se passe
 [PDF] Oxydo-Réduction Objectifs: Réaliser une réaction entre un métal et
[PDF] Oxydo-Réduction Objectifs: Réaliser une réaction entre un métal et
Solution de sulfate de cuivre ( initialement bleue ) • Paille de fer Les ions cuivre Cu2+ ont oxydé le fer : l'ion Cu2+ est un oxydant
 [PDF] Contrôle de CHIMIE n°2
[PDF] Contrôle de CHIMIE n°2
2) 2 lames de zinc et une solution de sulfate de cuivre NON 3) 1 lame de zinc fer On observe un dégagement gazeux Le pH de la solution finale est 4
 [PDF] Réaction doxydoréduction - Correction - AlloSchool
[PDF] Réaction doxydoréduction - Correction - AlloSchool
On plonge une lame de zinc dans un bécher contenant un volume V = 50 mL d'une solution bleue de sulfate de cuivre II de concentration c = 0 1 mol L-1
 [PDF] La corrosion
[PDF] La corrosion
Refaisons la même expérience mais avec une lame de zinc à la place du cuivre : Fer Eau désaérée contenant NaCl 1 mol L-1 Zinc OBSERVATIONS :
 [PDF] Quelques expériences sur la corrosion du fer - Sites ENSFEA
[PDF] Quelques expériences sur la corrosion du fer - Sites ENSFEA
1) Matériel et produit sur la paillasse de l'élève - un bécher de 250 mL ; - une lame de fer et une lame de cuivre ; - papier pour décaper - pinces
 [PDF] OXYDANT et REDUCTEUR réduction et oxydation
[PDF] OXYDANT et REDUCTEUR réduction et oxydation
Avec la phosphatation (parkérisation) le métal est immergé dans une solution chaude de sulfates de zinc de fer de manganèse Il se forme une pellicule de
 [PDF] ion métalliqu Classification qualitative des couples : ion métallique
[PDF] ion métalliqu Classification qualitative des couples : ion métallique
ration vert pâle due à la présence d'ion Fe2+ devient ve un dépôt métallique de Fer sur la lame de Zinc de Zinc cède 2 électrons à l'ion Fe2+ Le Zinc a réduit
 [PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
[PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
On plonge une lame de zinc dans une solution de sulfate de cuivre II (couleur bleue) Observations des élèves : La partie immergée de la plaque est recouverte d
Thème : L'univers Chapitre 3 : Les atomes, constituants universels de la matière 2nd Activité expérimentale 3 1 Activité expérimentale 3 : La conservation de l'élément Fer Problématique : Lorsqu'un clou en fer reste trop longtemps à l'air libre, il rouille. Qu'arrive-t-il au fer de ce clou ? Qu'est-ce que la rouille ? S'agit-il toujours de fer ou d'un tout autre élément ? Différentes espèces chimiques pour l'élément fer - Le fer métallique, de formule Fe, est un solide gris à température ambiante. Il peut être identifié en utilisant un aimant. En effet, le fer est un métal magnétique. - L'élément fer peut aussi se retrouver sous la forme d'ions en solution dans l'eau : - L'ion fer II, de formule Fe2+, dont la solution est de couleur verte très pâle (voire incolore) - L'ion fer III, de formule Fe3+, dont la solution est de couleur orange. Ces ions en sol ution peuvent être identi fiés simpl ement en ajoutant quelques gouttes d'une soluti on d'hydroxyde de sodium (Na+ + HO-). Les espèces qui peuvent être obtenues sont l'hydroxyde de fer II, de formule Fe(OH)2, un solide de couleur verte, et l'hydroxyde de fer III, de formule Fe(OH)3, un solide de couleur orange. La transformation chimique On parle de transformation chimique (ou réaction chimique) lorsqu'un mélange d'espèces chimiques, appelées réactifs, évolue vers un mélange constitué de nouvelles espèces chimiques, appelées produits. ANAlyser * * * REAliser * * * * * * VALider * * * * * * COMmuniquer * * Être AUTOnome * * * Thème : L'univers Chapitre 3 : Les atomes, constituants universels de la matière 2nd Activité expérimentale 3 2 Matériel pour la séance : Verrerie et autres Solides et solutions aqueuses • 6 Tubes à essai + bouchons • 1 Entonnoir • Filtres • 1 Spatule • 4 Bécher de 50 mL • Pipettes plastiques • Papier abrasif • 1 Aimant • 1 Éprouvette de 10 mL • 1 Boîte de pétri • Fer en poudre • Lame de zinc • Solution de sulfate de cuivre (Cu2+ + SO42-) • Solution d'hydroxyde de sodium (Na+ + HO-) • Solution de sulfate de fer II (Fe2+ + SO42-) • Solution de chlorure de fer III (Fe3+ + 3 Cl-) Protocole expérimental Étape 1 : Transformation du fer métallique - Dans un tube à essai, verser une petite spatule de poudre de fer. - Y ajouter environ 10 mL d'une solution de sulfate de cuivre. - Boucher le tube puis agiter vigoureusement pendant 1 minute environ. - Placer un filtre dans un entonnoir, le mettre sur un tube à essai propre et filtrer la solution précédemment obtenue. - Verser environ la moitié du filtrat obtenu dans un bécher propre, en prenant soin de ne pas le recouvrir. Un test d'identification de l'ion obtenu peut alors être envisagé. Étape 2 : Transformation du produit obtenu lors de l'étape 1 - Prélever quelques gouttes du filtrat obtenu précédemment et recouvrir le fond d'une boîte de pétri. - Laisser à l'air libre pendant 10 à 15 minutes. À nouveau, un test d'identification de l'ion obtenu peut être envisagé. Étape 3 : Retour au fer métallique - Dans le bécher, précédemment laissé de côté, déposer une lame de zinc que vous aurez préalablement bien décapée. - Laisser réagir pendant plusieurs minutes et observer. (Toujours replacer la lame dans le liquide) Un test final peut être envisagé afin de voir si vous avez bien récupérer du fer.
Thème : L'univers Chapitre 3 : Les atomes, constituants universels de la matière 2nd Activité expérimentale 3 3 REA Pour chacune des 3 étapes du protocole : - Les réaliser successivement (sans se préoccuper des tests d'identification pour le moment) et observer le milieu avant et après transformation. - Décrire ces observations en complétant les 3 schémas ci-dessous. Bien légender ces schémas, utiliser des couleurs pour décrire les milieux, faites des croix pour représenter les solides. ANA Grâce aux documents, imaginer et rédiger un protocole clair permettant d'identifier quels sont les ions obtenus, à l'étape 1 et à l'étape 2. REA / VAL APRÈS AVOIR MONTRER CE PROTOCOLE À L'ENSEIGNANT, le réaliser pour chaque ion à identifier, donner l'espèce formée pour chacun et conclure quant aux ions formés lors des étapes 1 et 2. ANA De la m ême mani ère, comment po urriez-vous vérifier que vous a vez bien r eformé du fe r métallique sur la lame de fer ? Effectuer le test et conclure. Thème : L'univers Chapitre 3 : Les atomes, constituants universels de la matière 2nd Activité expérimentale 3 4 VAL À partir des résultats expérimentaux, compléter le schéma ci-dessous en remplissant les cases avec les formules des espèces chimiques contenant du fer. VAL Sachant que les manipulations effectuées précédemment vous ont bien permis de former l'un des constituants de la rouille, quelle est la formule chimique de ce constituant ? Justifier. L'utilisation du sulfate de cu ivre ou de l'hydroxyde de sodium ont permis d'accélérer le proc essus de formation de la rouille. En réalité, l'ion fer II peut être obtenu de la même manière que l'ion fer III, de même que la simple présence d'humidité suffit à former la rouille à partir de l'ion fer III. Ces processus prennent simplement beaucoup plus de temps. COM Expliquer comment se forme la rouille au quotidien, en donnant toutes les étapes de sa formation. Dans le schéma que vous avez complété à la question 5, vous pouvez remarquer que quelle que soit la transformation que vous effectuez, vous avez toujours l'élément fer qui est présent. VAL Essayer de compléter la phrase suivante, dans un cas plus général où vous pourriez avoir d'autres éléments que le fer : Les éléments chimiques se .................................... lorsqu'il subissent une transformation chimique.
quotesdbs_dbs45.pdfusesText_45[PDF] systeme lineaire et matrice
[PDF] résolution des systèmes d'équations linéaires
[PDF] système de cramer matrice
[PDF] relier 12 points avec 5 droites
[PDF] relier 9 points en 3 traits sans lever le crayon
[PDF] enigme relier 9 points sans croiser
[PDF] relier 9 points en 4 traits sans croiser
[PDF] exercices gratuits écrits professionnels
[PDF] problème des 9 points
[PDF] heure légale fermeture restaurant
[PDF] relier 9 points en 1 trait
[PDF] fermeture tardive restaurant
[PDF] enigme relier 6 points sans croiser
[PDF] horaire fermeture bar de nuit
