 Chapitre 5 :Systèmes cristallins
Chapitre 5 :Systèmes cristallins
Réseau cubique simple coordinence = 6 pour tous les constituants élémentaires. Réseau cubique faces centrées : coordinence = 12 (pour tous aussi).
 Chimie - Chapitre 4 : Structure cristalline Ce quil faut retenir… ?
Chimie - Chapitre 4 : Structure cristalline Ce quil faut retenir… ?
Coordinence : nombre de plus proches voisins. Masse volumique : Cubique. Cubique centrée. Cubique faces centrées. Maille. Multiplicité.
 Pr. Abdeljalil LAMZIBRI Cristallochimie Structurale Chapitre I
Pr. Abdeljalil LAMZIBRI Cristallochimie Structurale Chapitre I
II – Indice de coordination (coordinence). C'est le nombre de particules les certains métaux tels que le cubique simple et le cubique centré appelés.
 Empilements.pdf
Empilements.pdf
Cubique Faces Centrées. Coordinence: c'est le nombre d'atomes plus proche voisin. Un atome sommet a pour voisins les 3×2 atomes des sommets adjacents et les
 Enseignement scientifique
Enseignement scientifique
Pour chacun des deux réseaux (cubique simple et cubique à faces centrées) : • représenter la maille en perspective cavalière ;. • calculer la compacité dans le
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
4) Définir et calculer la compacité de la structure cubique centrée en fonction de a et N. N°3 : Alliage cuivre-or. La maille « cubique » à faces centrées
 Cristallographie Exemples dapplication
Cristallographie Exemples dapplication
Exemple : direction [100] cubique à face centrée. (monoatomique) : 71 %. Nombre d'atomes par maille : plan compact. Coordinence :.
 Structure des cristaux (cristallographie)
Structure des cristaux (cristallographie)
1 - Faire le schéma d'une maille cubique faces centrées. 2 - Donner la population d'une maille la coordinence de chaque atome
 Chapitre II-Structures métalliques
Chapitre II-Structures métalliques
Dans une structure cubique centrée la coordinence est de huit à une distance de ?3/2. c)Masse volumique : C'est le rapport entre la masse des atomes et
 Symétries en physique 2. Symétries géométriques. Cristaux `a 3 d
Symétries en physique 2. Symétries géométriques. Cristaux `a 3 d
Figure 2 – Réseaux cubique centré et cubique `a faces centrées. On a dessiné un choix de maille primitive en lignes (tirets) rouges. La.
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
Réseau cubique simple coordinence = 6 pour tous les constituants élémentaires Réseau cubique faces centrées : coordinence = 12 (pour tous aussi)
 [PDF] Chapitre 3 Structure des matériaux - Slim CHOUCHENE
[PDF] Chapitre 3 Structure des matériaux - Slim CHOUCHENE
II 1 Structure cubique centré (CC) : Pour le système cubique centré (CC) dans la maille se trouve en plus des atomes des sommets un atome central (Cr W
 Cubique centré - Wikipédia
Cubique centré - Wikipédia
La structure cubique centrée (cc) dite aussi cubique à corps centré (ccc) est un type de structure cristalline Elle se rencontre dans tous les métaux
 [PDF] Chimie - Chapitre 4 : Structure cristalline Ce quil faut retenir ?
[PDF] Chimie - Chapitre 4 : Structure cristalline Ce quil faut retenir ?
Coordinence : nombre de plus proches voisins Masse volumique : Cubique Cubique centrée Cubique faces centrées Maille Multiplicité
 [PDF] Principaux systèmes cristallins - cpge paradise
[PDF] Principaux systèmes cristallins - cpge paradise
On peut alors augmenter la compacité de l'ensemble en utilisant un réseau cubique faces centrées d'anions La structure est alors : • un cubique faces centrées
 [PDF] STRUCTURES CRISTALLINES
[PDF] STRUCTURES CRISTALLINES
réseau de Bravais est cubique centré la coordinance d'une sphère est le nombre de voisins centré et cubique à faces centrées formés d'un
 [PDF] Cristallographie - Physique-Chimie – BCPST
[PDF] Cristallographie - Physique-Chimie – BCPST
La coordinence est le nombre de plus proches voisins que possède un point Empilement compact 1 : Structure cubique à faces centrées (cfc)
 [PDF] CRISTALLOGRAPHIE - Chimie - PCSI
[PDF] CRISTALLOGRAPHIE - Chimie - PCSI
1) Représenter une maille cubique à faces centrées et calculer la compacité 2) Calculer la masse volumique à l'état solide pour chacun des « gaz » nobles 3)
 [PDF] 2) Structure du cristal parfait - IRAMIS
[PDF] 2) Structure du cristal parfait - IRAMIS
Cubique Faces Centrées CC Cubique Centré Maille oblique: 1 atome/maille Maille cubique: 4 atomes/maille Maille oblique: 1 atome/maille
Comment calculer la coordinence d'une maille CFC ?
La structure cubique à faces centrées (CFC)
Elle est constituée de 4 atomes par maille, six sur les faces du cubes appartenant chacun à deux mailles et huit aux sommets du cube appartenant chacun à huit mailles. Le nombre de coordination est de 12. La compacité est de 0.74.Comment trouver la coordinence ?
Sidgwick a introduit la notion de nombre atomique effectif qui représente le nombre total des électrons entourant l'atome central compte tenu des doublets mis en commun ; si Z est le numéro atomique de l'atome central,V la valeur algébrique de la valence de l'ion correspondant, et C la coordinence, on a : Zeff = Z ? VQuelle est la coordinence d'un atome dans un métal de structure cubique centrée ?
Le fer à 20 °C poss? une structure cubique centrée dans laquelle chaque atome de fer occupe le centre d'un cube formé par huit atomes de fer voisins. La coordinence d'un atome dans cette structure est alors 8.- la maille élémentaire cubique faces centrées comporte un site octaédrique au centre de la maille, donc interne à la maille (compte pour 1). Elle comporte aussi un site centré au milieu de chaque arête, partagé par 4 mailles, soit 12 x 1/4 = 3 sites en propre.
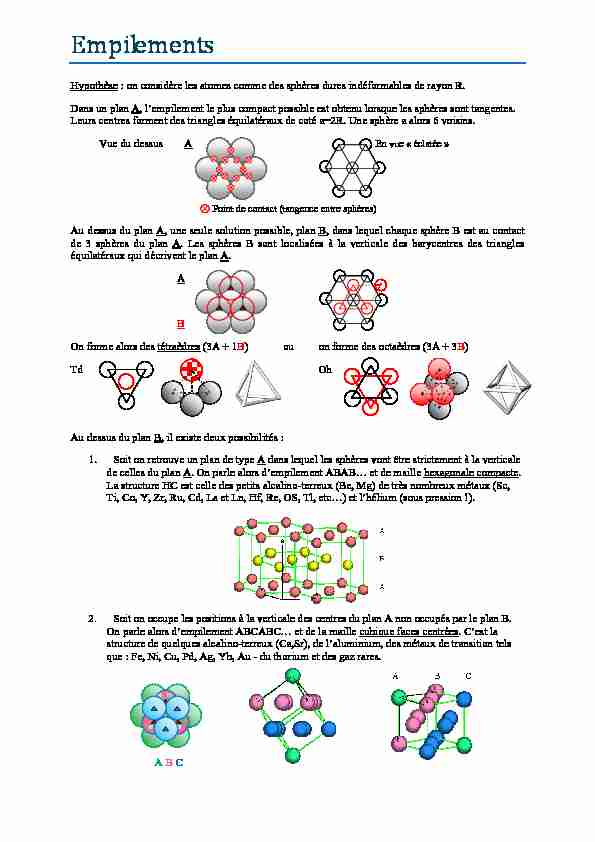
Soit on retrouve un plan de type A
Soit on occupe les positions à la verticale des centres du plan A non occupés par le plan B. On parle alors d'empilement ABCABC... et de la maille cubique faces centrées ahLes sphères grises de rayon Ra sont les atomes - Les sphères rouges de rayon Ri sont les interstices
N=3 : interstice créé par 3 atomes formant un triangle équilatéral de paramètre a.Relation entre Ri et Ra
aahRaRi (I)Relation de Contact
Raa2 (II)
D'où
RaRaRi23
RaRi N=4 : interstice créé par 4 atomes dormant un tétraèdre régulier de paramètre aRelation entre Ri et Ra
aaHRaRi (I)Relation de Contact
Raa2 (II)
D'où
RaRaRi2322
RaRi N=6 : interstice créé par 6 atomes formant un octaèdre régulier de paramètre a.Relation entre Ri et Ra
aRaRi (I)Relation de Contact
Raa2 (II)
D'où
RaRaRi222
414.012RaRi
N=8 : interstice créé par 8 atomes formant un cube de paramètre a.Relation entre Ri et Ra
aRaRi (I)Relation de Contact
Raa2 (II)
D'où
RaRaRi232
732.013RaRi
Ri/Ra 0.154 0.225 0.414 0.732 1
N 3 4 6 8
aHDans le plan de l'octaèdre
a a a CFC Coordinence: c'est le nombre d'atomes plus proche voisin. Un atome sommet a pour voisins les 3×2 atomes des sommets adjacents et les 3×2 atomes des centres des faces adjacentes. C=12 Multiplicité : nombre d'atome par maille cristalline. Chaque atome de sommet (il y en a 8) appartient à 8 mailles et contribue donc pour 1/8 dans la maille et chaque atome de face (il y en a 6) appartient à 2 mailles et contribue donc pour 1/2 dans la maille, soit au total : Z = 8×(1/8) + 6×(1/2) Z = 4 atomes par maille. Condition de tangence : la tangence des atomes est selon la diagonale d'une face, soit 4 r = a 2 Compacité : = volume occupé par la matière / volume de la mailleV matière = 4×4/3××r
3 = 16/3××r 3V maille = a
3Dénombrement des sites tétraédriques : un site Td est créé par 1 atome sommet et 3 atomes centrés.
Le site Td est entièrement compris dans la maille CFC. Il y a 8 sommets par conséquent il y a8 sites tétraédriques par maille CFC.
a Dénombrement des sites octaédriques : plusieurs types possibles1 Site Oh créé par les 8 atomes centrés. Ce site appartient entièrement à la maille car il est
situé en son centre.12 Sites Oh créés par 2 atomes sommets, deux atomes centrés et 2 atomes centrés d'une maille
adjacente. Ces sites comptent pour 1/4 car ils appartiennent à 4 mailles. Ils sont situés aux milieux des arêtes. Il y a 12 arêtes dans un cube donc il y 12×1/4 = 3 sites de ce type. Au total, il y a 4 sites octaédriques par maille CFC. a2Z sites Td pour Z sites Oh
Relation entre le paramètre c et le paramètre a dans le td bleu h=c/2 avec h=a(2/3) d'où aac Multipliciténombre d'atome par maille cristalline cZ = 3 (atomes du plan B)
+ 2 1 2 (les centres des faces A sont partagés avec les mailles au dessus et au dessous de celle qui est dessinée) + 12 1 6 (la moitié inférieure de l'atome individualisé sur la fig. 16 est partagée entre 3 mailles). Z = 6 atomes par maille triple (2 pour la maille élémentaire) Condition de tangencela tangence des atomes est le long d'une arête, soit 2 r = aCompacité
: = volume occupé par la matière / volume de la maille = 0,74 = 74% avec volume occupé par la matière : il y a 2 atomes par maille élémentaire, soit V matière = 2×4/3××r 3 = 16/3××r 3Volume de la maille hexagonale
hexagone = c × 2 × S losange = c × 6 × S triangle équilatéral V hc = 6 c (1/2 a h tr ) = 6 c (1/2 a a3/2) V=3 a 2 c 3/2 Or ac d'où V maille hc =3 a 3 2 Dénombrement des sites tétraédriques : plusieurs types possibles c2 sites Td ayant pour base les atomes de la couche B. Ils appartiennent
entièrement à la maille.6 sites Td ayant pour sommet l'un des trois atomes de la couche B.
appartiennent entièrement à la maille12 sites Td ayant un sommet des faces A. Ces sites sont partagés entre
trois mailles. Au total, il y a 2×1+6×1+12×1/3 = 12 sites tétraédriques par maille triple (ou 4 sites Td par maille élémentaire)Dénombrement des sites octaédriques :
c6 sites octaédriques ayant pour arête un segment entre 2 (des 3) atomes
B de la maille. Ces sites sont entièrement dans la maille. Il y a donc 6 sites octaédriques par maille triple HC2Z sites Td pour Z sites Oh
a C aMaille tri
quotesdbs_dbs30.pdfusesText_36[PDF] coordonnées sphériques cartésiennes
[PDF] coordonnées d'une personne
[PDF] coordonnées vecteur
[PDF] coordonnées personnelles
[PDF] coordonnées lambert
[PDF] coordonnés
[PDF] coordonnées cylindriques pdf
[PDF] coordonnées cylindriques cours
[PDF] repère cartésien orthonormé
[PDF] repère x y
[PDF] coordonnées x y z
[PDF] repérage d'un point dans l'espace
[PDF] lire les coordonnées d'un point dans l'espace
[PDF] coordonnées d'un point géométrie dans l'espace
