 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
Afin de répartir tous les électrons d'un atome dans les différentes orbitales atomiques celles-ci sont classées par énergie croissante et les électrons sont
 Corrigé
Corrigé
1) Nommer et énoncer la règle qui permet d'obtenir l'ordre de remplissage des orbitales atomiques pour obtenir la configuration électronique d'un atome.
 REGLES DE REMPLISSAGE (2016-2017) a- Règle de
REGLES DE REMPLISSAGE (2016-2017) a- Règle de
L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) c- Règle de Hund : les électrons occupent un maximum d'orbitales définies par le.
 Chapitre I – Structure des atomes
Chapitre I – Structure des atomes
Les orbitales sont définies par les trois nombres quantiques n l et m (nombres Respecter l'ordre de remplissage selon la règle de Klechkowski (règle.
 4-La configuration électronique
4-La configuration électronique
facilement l'ordre énergétique des orbitales atomiques et par le fait même leur ordre de remplissage ce qui constitue un outil fort avantageux
 Chapitre 1 - Configuration électronique
Chapitre 1 - Configuration électronique
des volumes appelés orbitales dans lesquels l'électron a le plus de chance de de retrouver l'ordre de remplissage des couches électroniques d'un élément.
 Sans titre
Sans titre
quantique magnétique pour prévoir l'ordre de remplissage des orbitales atomiques. E. Des atomes appartenant à la même famille ont généralement un même.
 Les orbitales moléculaires
Les orbitales moléculaires
+ 1.1 LCAO 1.2 L'orbitale moléculaire ?+ 1.3 ?. 2. Diagramme d'énergie moléculaire. 2.1 H. 2. 2.2 He. 2. 2.3 Ordre de la liaison 2.4 Règles de construction.
 RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
L'ordre de remplissage des orbitales atomiques se fait suivant la règle de Klechkowski : L'ordre est par ordre croissant d'énergie.
 Diapositive 1
Diapositive 1
On obtient donc l'ordre de remplissage suivant : Cette règle traduit le fait que les orbitales se remplissent dans l'ordre suivant :.
 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
Règle de Hund: pour une sous-couche donnée la configuration électronique de plus basse énergie est obtenue en plaçant un maximum d’électrons de même spin (même valeur de ms) dans des orbitales différentes (cf Principe d’exclusion de Pauli) avant d’apparier des électrons de spins opposés (valeurs de ms opposées)
 1 Atomistique - editions-ellipsesfr
1 Atomistique - editions-ellipsesfr
A Les orbitales s sont de forme sphérique B Selon les règles de l’Aufbau Principe les orbitales 4s se remplissent après les orbitales 3d C Toutes les liaisons chimiques se forment lors d’un échange d’électrons entre atomes D En liant des atomes pour former une molécule on forme une structure
 La Classification Périodique - chemphysfr
La Classification Périodique - chemphysfr
l'ordre de remplissage des orbitales atomiques d'un atome polyélectronique 1s2 2s2 2p6 3s2 3p6 =18 e-puis: E 4s < E 3d OA 4s se remplit avant OA 3d E 5 s < E 4d E 5 d ? E 4f dans le lanthane (Z=57) 5d se remplit avant 4f E 6 d ? E 5f dans l'actinium (Z=89) 6d se remplit avant 5f K L M N O P Q
 Searches related to ordre de remplissage des orbitales PDF
Searches related to ordre de remplissage des orbitales PDF
la somme des énergies des électrons de la molécule: E = E = ?? n n i EE i E = 2 E( 1s) = 2 (1597) = 3194 eV La molécule H 2 est plus stable que les 2 H séparés car son niveau d'énergie est plus bas L'énergie de stabilisation ?E de l'orbitale liante est inférieure en valeur
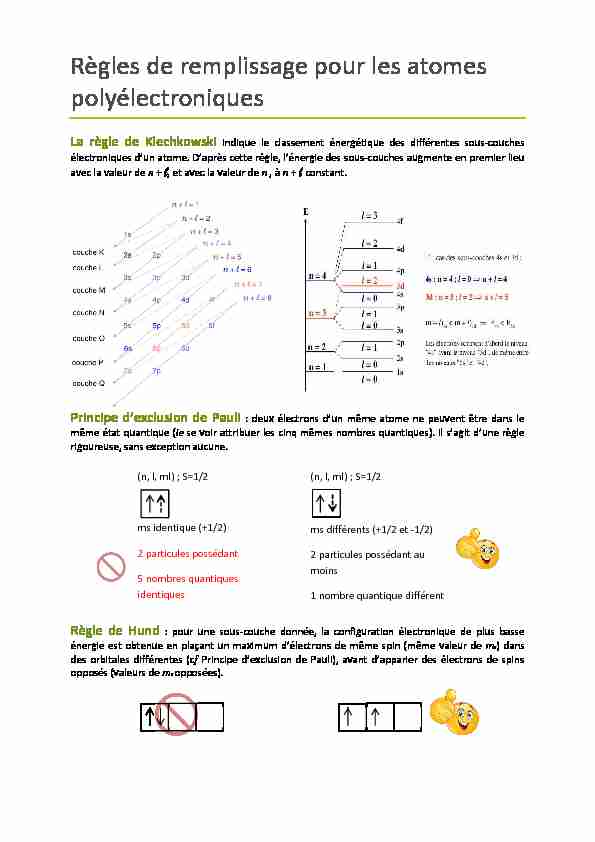
Règles de remplissage pour les atomes
polyélectroniquesLa règle de Klechkowski indique le classement énergétique des différentes sous-couches
électroniques d'un atome. D'après cette règle, l'énergie des sous-couches augmente en premier lieu
avec la valeur de n + l, et avec la valeur de n , à n + l constant. Principe d'exclusion de Pauli : deux électrons d'un même atome ne peuvent être dans lemême état quantique (ie se voir attribuer les cinq mêmes nombres quantiques). Il s'agit d'une règle
rigoureuse, sans exception aucune. Règle de Hund : pour une sous-couche donnée, la configuration électronique de plus basse énergie est obtenue en plaçant un maximum d'électrons de même spin (même valeur de m s) dansdes orbitales différentes (cf Principe d'exclusion de Pauli), avant d'apparier des électrons de spins
opposés (valeurs de m s opposées). (n, l, ml) ; S=1/2 ms identique (+1/2)2 particules possédant
5 nombres quantiques
identiques (n, l, ml) ; S=1/2 ms différents (+1/2 et -1/2)2 particules possédant au
moins1 nombre quantique différent
État fondamental
Afin de répartir tous les électrons d'un atome dans les différentes orbitales atomiques, celles-ci sont
classées par énergie croissante et les électrons sont répartis prioritairement dans les orbitales
d'énergie les plus faibles (utilisation de la règle de Klechkowski). On obtient alors la répartition
électronique pour l'atome dans son état fondamental.Configuration électronique
La répartition des électrons d'un atome dans les orbitales atomiques s'écrit de la façon suivante :
2s1 occupation électronique de la sous-couche
valeur de n type de l'OA (valeur de l) couche sous-couchePour les atomes ayant plusieurs couches électroniques totalement remplies, la notation peut devenir
très longue. On peut alors abréger la notation en indiquant que la configuration des électrons de
coeur (électrons d'une couche électronique totalement remplie, à l'exception des couches d ou f) a
une configuration identique à celle du gaz rare qui précède l'élément. Le phosphore, par exemple, ne
diffère du néon (1s2 2s2 2p6) que par la présence d'une troisième couche. Donc la configuration
électronique du néon est retirée, et le phosphore est noté ainsi : [Ne]3s2 3p3.Cations et Anions
Pour établir la configuration électronique d'un atome non neutre, il faut d'abord chercher celle de
l'atome neutre puis lui retirer (cations) ou lui ajouter (anions) les électrons. En effet, la règle de
Klechkowski ne s'applique qu'aux atomes neutres. Par exemple,26Fe3+ :
Fe -> Fe3+ + 3e
26Fe : [18Ar] 4s2 3d6
on retire les électrons les plus externes en premier : 4s puis 3d26Fe3+ : [18Ar] 4s0 3d5
et non 26Fe3+ 26-3 = 23 électrons => [18Ar] 4s2 3d3 qui est la configuration électronique du Vanadium 23VExceptions
Cette approche simple par les nombres quantiques souffre néanmoins d'un certain nombred'exceptions, en particulier parmi les métaux de transition et les lanthanides ; les règles de
remplissage ne sont qu'une approximation de la mécanique quantique qui décrit les atomes.Une sous-couche à moitié remplie conduit à une configuration de spin maximal, ce qui lui confère
une certaine stabilité en vertu de la règle de Hund. Par exemple, le chrome (numéro atomique 24) a
une configuration électronique [Ar] 3d54s1, et non [Ar] 3d4 4s2. De la même façon, le cuivre (numéro
atomique 29) a une configuration électronique [Ar] 3d10 4s1, et non [Ar] 3d9 4s2, ce qui permet d'avoir
la couche 3d pleine et la couche 4s à demi-pleine.Généralement, les exceptions se trouvent lors que les configurations électroniques sont du type :
(n-1)d4 ns2 remplacé par (n-1)d5 ns1
(n-1)d9 ns2 remplacé par (n-1)d10 ns1
quotesdbs_dbs32.pdfusesText_38[PDF] couche electronique tableau periodique
[PDF] couchsurfing listening comprehension
[PDF] couchsurfing oral anglais
[PDF] le français pas ? pas lecture pdf
[PDF] python module lycee
[PDF] python pour le lycée
[PDF] python seconde
[PDF] débuter avec python au lycée pdf
[PDF] trouver une copine sur internet
[PDF] je cherche une copine sur facebook
[PDF] je cherche une fille serieuse
[PDF] je cherche un copain
[PDF] je cherche une copine canadienne
[PDF] coucou c'est nous les moments cultes
