 Cinétique Chimique
Cinétique Chimique
La cinétique chimique est la science qui s'occupe de la façon dont les réactions chimiques procèdent au cours des 10 première minutes de la réaction.
 Terminale S CINETIQUE ET CATALYSE La cinétique chimique est l
Terminale S CINETIQUE ET CATALYSE La cinétique chimique est l
a-Par observations. L'observation du système au cours du temps peut donner des renseignements sur son évolution par : ? un changement de couleur. ? un
 Chapitre 1 - Cinétique chimique
Chapitre 1 - Cinétique chimique
1.1 Facteurs cinétiques et catalyse. 1.1.1 Transformation lente ou rapide. Transformation lente ou rapide. Une transformation chimique est dite rapide s'il
 PHYSIQUE-CHIMIE- TECHNOLOGIE
PHYSIQUE-CHIMIE- TECHNOLOGIE
TOMASINO et al. ? Sciences physiques. Rappels de Cours et exercices corrigés. Collection Union Bac. Terminales D C et E. ? Physique Terminale
 Physique Chapitre 3 Terminale S
Physique Chapitre 3 Terminale S
Page 1 sur 6. Temps et évolution chimique. Physique Chapitre 3. Terminale S. CINETIQUE ET CATALYSE. I – REACTION RAPIDE OU LENTE ?
 Cours et exercices de chimie des solutions
Cours et exercices de chimie des solutions
Cours. 49. Exrecices. 57. Chapitre 5: Equilibre d'oxydoréduction. Cours. 59. Exrecices. 69. Chapitre 6: Cinétique chimique. Cours.
 Reaction chimique - Thermodynamique - Cinétique
Reaction chimique - Thermodynamique - Cinétique
La réaction chimique. Définition. Il s'agit d'une transformation au cours de laquelle un certain nombre de constituants initiaux appelés réactifs.
 p2 - sommaire 173
p2 - sommaire 173
Cette réalisation est une séquence de cinétique chimique de Terminale S réalisée lors de mon stage pédagogique en novembre 2014. Elle comprend 5 h de TP/cours (
 Chapitre 2 : léchelle des longueurs
Chapitre 2 : léchelle des longueurs
Terminale S Thème Comprendre Chap.9 Ce système chimique évolue au cours d'une transformation chimique d'un état initial à un ... 2) Cinétique chimique.
 Fiche de synthèse n°4 Cinétique dune réaction chimique
Fiche de synthèse n°4 Cinétique dune réaction chimique
Remarque : la concentration d'un réactif par définition
 [PDF] Cinétique chimique - Lycée dAdultes
[PDF] Cinétique chimique - Lycée dAdultes
1 1 Facteurs cinétiques et catalyse 1 1 1 Transformation lente ou rapide Transformation lente ou rapide Une transformation chimique est dite rapide s'il
 [PDF] Cinétique Chimique
[PDF] Cinétique Chimique
La cinétique chimique est la science qui s'occupe de la façon dont les réactions chimiques procèdent ( mécanisme) et de leur vitesse
 [PDF] Cours-Cinétique-chimiquepdf
[PDF] Cours-Cinétique-chimiquepdf
La cinétique chimie permet de déterminer les facteurs qui peuvent influencer la vitesse des réactions et permet d'augmenter le rendement du produit
 [PDF] Cinétique chimique en Terminale S - Sites ENSFEA
[PDF] Cinétique chimique en Terminale S - Sites ENSFEA
Cette réalisation est une séquence de cinétique chimique de Terminale S réalisée lors de mon stage pédagogique en novembre 2014 Elle comprend 5 h de TP/cours (
 [PDF] Cinétique chimique
[PDF] Cinétique chimique
Plan 1 Equations cinétiques 1 1 Définition de la vitesse; 1 2 Loi de vitesse; 1 3 Etapes élémentaires 1 4 Cinétique d'ordre 0; 1 5 Cinétique d'ordre 1;
 [PDF] Chapitre 9 : Temps et évolution chimique
[PDF] Chapitre 9 : Temps et évolution chimique
Terminale S Thème Comprendre Chap 9 Ce système chimique évolue au cours d'une transformation chimique d'un état initial à un 2) Cinétique chimique
 [PDF] Physique Chapitre 3 Terminale S
[PDF] Physique Chapitre 3 Terminale S
La cinétique chimique est l'étude du déroulement temporel des réactions chimiques Pour décrire l'évolution d'un système chimique qui est le siège d'une
 [PDF] Terminale S CINETIQUE ET CATALYSE La cinétique chimique est l
[PDF] Terminale S CINETIQUE ET CATALYSE La cinétique chimique est l
Terminale S CINETIQUE ET CATALYSE La cinétique chimique est l'étude du déroulement temporel des réactions chimiques I- REACTION RAPIDE OU LENTE ?
 [PDF] Fiche de synthèse n°4 Cinétique dune réaction chimique
[PDF] Fiche de synthèse n°4 Cinétique dune réaction chimique
La cinétique chimique est l'étude de la vitesse des réactions La concentration d'un réactif diminue au cours du temps tandis que celle d'un produit de
 [PDF] CINETIQUE CHIMIQU EE SPÉ MP
[PDF] CINETIQUE CHIMIQU EE SPÉ MP
Ce sera l'entité la plus simple à étudier en cinétique chimique : elle ne fera en général pas intervenir plus de deux molécules et les modifications de
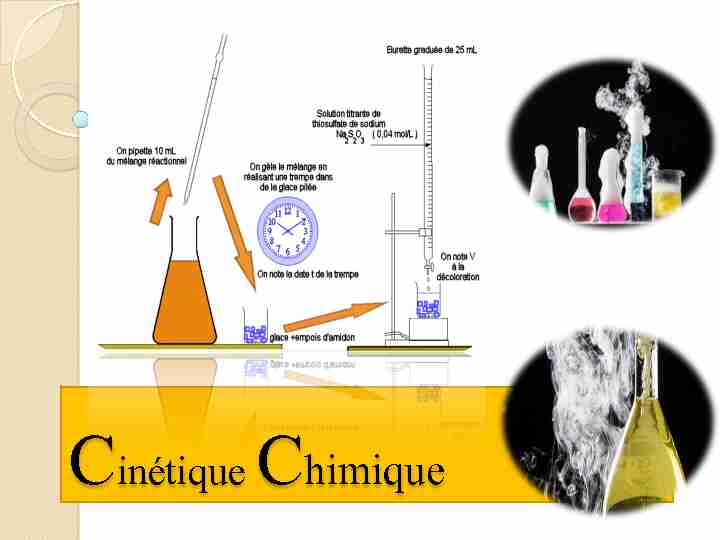
Cinétique Chimique
Introduction
Une réaction chimique est la modification de l'assemblage des atomes constituants les molécules de réactifs pour conduire à de nouvelles molécules produits. Etudier une réaction consiste à envisager deux problèmes dont elle dépend: • La thermodynamique
• La cinétiqueLa thermodynamique étudie l'énergie de l'état initialLa cinétique met en évidence les intermédiaires
La cinétique chimique est la science qui s'occupe de la façon dont les réactions chimiques procèdent ( mécanisme) et de leur vitesse Deux motivations principales pour étudier la cinétique: • Prédire les facteurs qui peuvent influer sur la vitesse: température, pression, concentrations, présence d'un catalyseur • Relier la vitesse au mécanisme: une réaction dont nous écrivons l'équation stoechiométrique de manière globale, est en fait une succession de réactions élémentaires. • Ces deux motivations relèvent de la cinétique proprement dite. on peut aussi s'intéresser au rôle de la vibration a la rotation cette description relève de la dynamique chimique.
Il existe des réaction chimique : • Rapide: comme la précipitation du chlorure d'argent: Ag
+ Cl AgCl • Lente : comme l'oxydation de l'eau par le MnO 4 4MnO 4 + 4H 3O 2 + 4 MnO 2 +2H 2 O chauffageFacteurs influençant la cinétique:
1. Les concentrations des réactifs: Dismutation des ions thiosulfates S
2 O 3en milieu acide Si on augmente la concentration du thiosulfate la vitesse d'apparition du précipité augmente (le soufre augmente): S
2 O 3 2- + 2 HS + SO
2 +H 2 O S 2 O 3 2- diluée HCl ( rien) Précipité blanc jaunâtre du soufre ConcentréFacteurs influençant la cinétique:
2. La température du milieu: L'oxydation de l'eau par le permanganate, la vitesse de la réaction augmente par l'augmentation de la température (choc, rencontre des réactifs, agitation). Température faible réaction lente (réfrigérateur)
MnO 4 + H 2O Lente MnO
2Chauffage
Facteurs influençant la cinétique:
°°°°°°°°° °°°°°°°°°° 2. Présence de substances autres que le réactif (Le catalyseur): dismutation de l'eau oxygénée est instable réagit sur elle même réaction lente Réaction homogène(même phase exemple H
2 0 2 +sang), hétérogène(différente phase), enzymatique H 2 O 2 H 2O + ½ O
2FeCl3,CuCl2
H 2 0 2Bulles d'oxygène FeCl
3Solution aqueuse Incolore de H
2 O 2Vitesse de réaction:
Variation d'une grandeur par unité de temps Elle est définie soit par rapport à la disparition d'un réactif soit par rapport à l'apparition d'un produit Elle s'exprime en unité de concentration par unité de temps mol l
-1 s -1elle est toujours positive Variation de concentration du réactif est négative (le réactif disparait) Variation de concentration du produit est positive (le produit apparaît)
Vitesse rapide : Produit se forment rapidement Exemple: précipitation, explosion,.... Vitesse lente: Longue période
Première tache est d'établir une définition quantitative précise de la vitesse de la réaction Une vitesse est définie comme le changement d'une proprietes divisé par le temps qu'il faut pour obtenir ce changement Exemple : Vitesse d'une voiture: La vitesse de son changement de position est définie comme la distance parcourue divisée par le temps nécessaire Nous obtenons " la vitesse moyenne »
Si on divise la longueur d'un voyage par le temps total de ce voyage On obtient la vitesse instantanée ( lit le compteur de vitesse) On chimie on exprime la vitesse en fonction de la consommation des réactifs ou formation des produits Vitesse de réaction : variation de le concentration divisée par l'intervalle de temps V= - dR/dT(réactifs) V= + dP/dT (Produits)
Supposez qu'on étudiant le réaction 2HI (g) H 2 (g)+I 2 (g) nous trouvions que dans un intervalle de 100 s, la concentration de HI diminue de 4 mmol L -1à 3,5 mmol L
-1 . Quelle est la vitesse moyenne de réaction? V (HI) = - (3,5 - 4) / 100 = 5 10 -3 mmol L -1 s -1 concentration TempsExemple 1
• La vitesse instantanée correspond à la limite de la variation du réactif dans un intervalle de temps trés court • La vitesse moyenne diminue lorsque la réaction progresse • Pour déterminer la vitesse de réaction à un instant donné au cours de la réaction, on détermine: " la pente de la tangente en fonction du temps » Cette pente est la vitesse instantanée de la réaction
La vitesse instantanée
Supposons que la vitesse de la réaction N 2 O 5 (g) 2NO 2 (g)+1/2 O 2 (g) Soit indiqué sous la forme - Δ N 2 O 5/Δ t Exprimer la vitesse de cette réaction en termes de la concentration de chacun des produits.
Exemple 2
La vitesse de la disparition de N
2 O 5 est deux fois plus grande que celle de la production de O 2Parce que deux molécules de N
2 O 5 sont consommées pour chaque molécule de O 2 produite On a des lors, Vitesse = -Δ N 2 O 5 /Δt = 2 Δ O 2 /Δt La vitesse de la disparition de N 2 O 5 est la moitié de la vitesse de la production du NO 2 parce que deux molécules de NO 2 sont formées pour chaque molécule de N 2 O 5 qui se décompose Vitesse = -Δ N 2 O 5 /Δt= (½) Δ NO 2 /ΔtCorrection Exemple 2
Calculer à l'aide des données du tableau la vitesse de la production du NO 2 au cours des 10 première minutes de la réaction N 2 O 5 (g) 2NO 2 (g)+1/2 O 2 (g) t min N 2 O 5 M NO 2 M O 2M 0 1,24 10
-20 0 10 0,92 10
-20,64 10
-20,16 10
-220 0,68 10
-21,12 10
-20,28 10
-230 0,5 10
-21,48 10
-20,37 10
-240 0,37 10
-21,74 10
-20,44 10
-250 0,27 10
-21,92 10
-20,48 10
-260 0,20 10
-22,08 10
-20,52 10
-270 0,14 10
-22,18 10
-20,55 10
-280 0,11 10
-22,26 10
-20,57 10
-290 0,08 10
-22,32 10
-20,58 10
-2100 0,06 10
-22,36 10
-20,59 10
-2Exemple 3
Etant donné que NO
2 est un produit, la vitesse de production de NO 2 est donnée par Δ N 2 O 5 /Δt au cours des 10 premières minutes de la réaction: Vitesse = Δ NO 2 /Δt = (0,64 10quotesdbs_dbs32.pdfusesText_38[PDF] cinétique chimique cours mpsi
[PDF] c'est quoi le civisme
[PDF] civisme ? l'école primaire
[PDF] importance du civisme?
[PDF] les jeunes et le civisme
[PDF] civilité civisme citoyenneté
[PDF] exposé sur le civisme
[PDF] cours de civisme ? l'école pdf
[PDF] le civisme au quotidien
[PDF] cours de climatologie tropicale
[PDF] cours de climatologie tropicale pdf
[PDF] concepts fondamentaux climatologie
[PDF] elements de climatologie
[PDF] pouvoir comburivore wikipedia
