 01 - Loi dArrhenius
01 - Loi dArrhenius
la vitesse de réaction associée
 Troisième chapitre Première période Plan du cours Cinétique
Troisième chapitre Première période Plan du cours Cinétique
PCSI. Page 26. 3.2. Loi de Van't Hoff. La réaction étudiée est décrite par une 1. Loi d'Arrhénius. Expérimentalement dans la plupart des cas
 cinétique chimique
cinétique chimique
II Le facteur cinétique température loi d'Arrhenius. III Le facteur cinétique concentration
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI-. 1.1.2.2 INFLUENCE DE LA TEMPÉRATURE : On admet la loi d'Arrhenius : d ln k. dT. = Ea. RT2. ◇ k :constante de la vitesse. T
 03 - Décompo N2O5
03 - Décompo N2O5
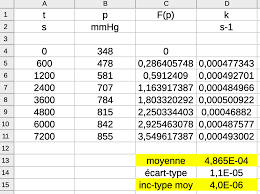
que la réaction est d'ordre 1 : [N O ]=[N O ] exp La loi empirique de variation de la constante de vitesse avec la température est la loi d'Arrhenius :.
 Introduction à la théorie de létat de transition
Introduction à la théorie de létat de transition
F. LAHITÈTE
 Cinétique chimique
Cinétique chimique
Cours de chimie de première période de PCSI. Page 2. 2. Cinétique formelle 1. Loi d'Arrhénius. Expérimentalement dans la plupart des cas
 Cinétique chimique
Cinétique chimique
1. LOI D'ARRHENIUS. 2. DETERMINATION EXPERIMENTALE DE L'ENERGIE D'ACTIVATION EA. 3. EFFETS DE LA TEMPERATURE ; EXEMPLES EN CHIMIE ET DANS LA VIE COURANTE. III
 Cinétique chimique
Cinétique chimique
Plan. 1. Equations cinétiques. 1.1 Définition de la vitesse; 1.2 Loi de vitesse; 1.3 Etapes élémentaires. 1.4 Cinétique d'ordre 0; 1.5 Cinétique d'ordre 1;
 Cinétique chimique
Cinétique chimique
1. LOI D'ARRHENIUS. 29. 2. DETERMINATION EXPERIMENTALE DE L'ENERGIE D'ACTIVATION EA. 30. 3. EFFETS DE LA TEMPERATURE ; EXEMPLES EN CHIMIE ET DANS LA VIE
 01 - Loi dArrhenius
01 - Loi dArrhenius
Cinétique chimique. Exercice 1. Page 1 sur 5. Corrigé exercice 1. LOI DsARRHENIUS. 1). Équation de la réaction de décomposition de N O : N O = 2NO +.
 LE MODELE QUANTIQUE DE LATOME
LE MODELE QUANTIQUE DE LATOME
PCSI 1. Cinétique Chimique. S. Falcou. 2015-2016. La cinétique formelle. 1 II- Loi de vitesse ordre d'une réaction. p. 10. 1- ... 1- Loi d'Arrhénius.
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- On admet la loi d'Arrhenius : d ln k ... C'est la loi cinétique d'une réaction chimique d'ordre n > 1.
 Troisième chapitre Première période Plan du cours Cinétique
Troisième chapitre Première période Plan du cours Cinétique
participant à la réaction ceci grâce à l'établissement de lois de vitesse 1. Ecriture d'une réaction et avancement «qsi» ... 1. Loi d'Arrhénius.
 Cinétique chimique
Cinétique chimique
Plan. 1. Equations cinétiques. 1.1 Définition de la vitesse; 1.2 Loi de vitesse; 1.3 Etapes élémentaires. 1.4 Cinétique d'ordre 0; 1.5 Cinétique d'ordre 1;
 Cinétique chimique
Cinétique chimique
LOI DE VAN'T HOFF. 3.3. ORDRE INITIAL ET ORDRE COURANT. II – INFLUENCE DU FACTEUR CINETIQUE TEMPERATURE SUR LA VITESSE DE LA REACTION. 1. LOI D'ARRHENIUS.
 PCSI 1 et 3 cours de Chimie
PCSI 1 et 3 cours de Chimie
1°) Vitesse volumique d'apparition d'une espèce: v = dci/dt (v Montrer que la cinétique suit la loi d'Arrhénius (régression linéaire à faire ?)
 Devoir Surveillé n°2
Devoir Surveillé n°2
12 nov. 2015 CHIMIE PCSI. Devoir Surveillé n°2 ... Exercice 1 : destruction du méthane CH4 sous l'action ... Il faut utiliser la loi d'Arrhénius :.
 CINÉTIQUE CHIMIQUE
CINÉTIQUE CHIMIQUE
Loi de vitesse ; réactions chimiques avec ordre et sans ordre. II Le facteur cinétique température loi d'Arrhenius. III Le facteur cinétique concentration
 Cinétique chimique
Cinétique chimique
Cours de chimie de première période de PCSI 1. LOI D'ARRHENIUS. 14. 2. DETERMINATION EXPERIMENTALE DE L'ENERGIE D'ACTIVATION EA.
[PDF] LOI N° 91-22 DU 16 FEVRIER 1991 portant orientation - Unesco
[PDF] 1ère S
[PDF] La loi de Beer - Lambert - LHCE
[PDF] Spectrophotométrie - Eduscol
[PDF] Comportements non linéaires des matériaux solides
[PDF] Comportement Mécanique des Matériaux - Mines Saint Etienne
[PDF] Controles corrigés - Jamiati
[PDF] Page 1 - Samedi 17 Dhou El Hidja 1414 33è ANNEE : /:
[PDF] Cameroun - Loi de finances pour 2010 (wwwdroit-afriquecom)
[PDF] Loi de finances F 2011 - Ohada Legis
[PDF] Tunisie - Loi de finances pour 2012 (wwwdroit-afriquecom)
[PDF] Congo - Loi de finances pour 2013 (wwwdroit-afriquecom)
[PDF] Congo - Loi de finances pour 2014 (wwwdroit-afriquecom)
[PDF] journal officiel - FCE
