 chap.2TP2 Suivi par spectrophotométrie-correction
chap.2TP2 Suivi par spectrophotométrie-correction
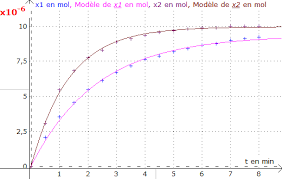
Chap 2 – Suivi temporel d'une transformation chimique. Correction. TP 2 : SUIVI TEMPOREL D'UNE REACTION CHIMIQUE PAR SPECTROPHOTOMETRIE. [I2] en mol.L-1. A480
 CHAPITRE 10:CINÉTIQUE ET CATALYSE TP:SUIVI CINÉTIQUE
CHAPITRE 10:CINÉTIQUE ET CATALYSE TP:SUIVI CINÉTIQUE
TP:SUIVI CINÉTIQUE PAR SPECTROPHOTOMÉTRIE. A. LA RÉACTION ÉTUDIÉE. 1. Équation Or la concentration est un facteur cinétique : plus elle est grande plus la ...
 TP Spectroscopie : Suivi temporel dune réaction chimique
TP Spectroscopie : Suivi temporel dune réaction chimique
But : Suivi temporel d'une réaction chimique et facteurs cinétiques. Il s'agit de la réaction entre les ions iodure I– (incolores) et les ions
 Fiche de présentation et daccompagnement Niveau Terminale
Fiche de présentation et daccompagnement Niveau Terminale
8 juil. 2020 TP : L'informatique au service du chimiste : Suivi cinétique d'une réaction catalysée. La cinétique chimique n'a donc pas comme seul objectif ...
 TP 18 – Étude dune cinétique suivie par spectrophotométrie
TP 18 – Étude dune cinétique suivie par spectrophotométrie
TP 18 – Étude d'une cinétique suivie par spectrophotométrie. Matériel (par groupe) : spectrophotomètre et cuves chronomètre
 CPGE Brizeux
CPGE Brizeux
TP 6. 2018-2019. 1. TP 6 : Suivi cinétique par spectrophotométrie. ➢ Objectif 1 : Consolidation des acquis : proposer un protocole à partir des données.
 Exercice corrigé gradateur triphase pdf
Exercice corrigé gradateur triphase pdf
11 juin 2012 ... TP n 2b (correction) 1 SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION) Objectifs : Déterminer l évolution de la vitesse de réaction par ...
 TP13. SUIVI TEMPOREL DUNE REACTION PAR
TP13. SUIVI TEMPOREL DUNE REACTION PAR
SUIVI TEMPOREL D'UNE REACTION PAR SPECTROPHOTOMETRIE. Suivi cinétique de la Correction. Ch9. Suivi temporel d'une réaction par spectrophotométrie. Suivi ...
 08 - Cin dune réaction redox par spectro
08 - Cin dune réaction redox par spectro
Cinétique chimique. Exercice 8. Page 1 sur 5. Corrigé exercice 8. CINÉTIQUE DsUNE RÉACTION DsOXYDORÉDUCTION SUIVIE PAR. SPECTROPHOTOMÉTRIE. 1). Réaction étudiée.
 SUIVI TEMPOREL DUNE TRANSFORMATION CHIMIQUE PAR
SUIVI TEMPOREL DUNE TRANSFORMATION CHIMIQUE PAR
Chapitre : La cinétique chimie. TP N°… 1. SUIVI TEMPOREL D'UNE REACTION CHIMIQUE PAR SPECTROPHOTOMETRIE. Objectif bac : Pratiquer une démarche expérimentale
 CHAPITRE 10:CINÉTIQUE ET CATALYSE TP:SUIVI CINÉTIQUE
CHAPITRE 10:CINÉTIQUE ET CATALYSE TP:SUIVI CINÉTIQUE
TP:SUIVI CINÉTIQUE PAR SPECTROPHOTOMÉTRIE Or la concentration est un facteur cinétique : plus elle est grande plus la transformation est rapide.
 Spécialité Physique – Chimie Terminale Chimie TP n°5 :Suivi
Spécialité Physique – Chimie Terminale Chimie TP n°5 :Suivi
Chimie TP n°5 :Suivi cinétique d'une réaction par spectrophotométrie /CORRECTION. Contexte du sujet. On souhaite étudier l'influence des concentrations sur
 TP13. SUIVI TEMPOREL DUNE REACTION PAR
TP13. SUIVI TEMPOREL DUNE REACTION PAR
SUIVI TEMPOREL D'UNE REACTION PAR SPECTROPHOTOMETRIE. Suivi cinétique de la réaction d'oxydoréduction entre l'eau oxygénée et les ions iodure.
 Fiche de présentation et daccompagnement Niveau Terminale
Fiche de présentation et daccompagnement Niveau Terminale
TP de suivi cinétique utilisant un colorimètre pour l'acquisition de l'absorbance Réalisation du montage « Construction d'un spectrophotomètre avec un ...
 TP8 suivi cinétique par spectrophotométrie (résultats) Le peroxyde d
TP8 suivi cinétique par spectrophotométrie (résultats) Le peroxyde d
TP8 suivi cinétique par spectrophotométrie (résultats). Le peroxyde d'hydrogène H2O2 (nom commun : eau oxygénée) est un oxydant dont les propriétés.
 CPGE Brizeux
CPGE Brizeux
TP 6 : Suivi cinétique par spectrophotométrie. ? Objectif 1 : Consolidation des acquis : proposer un protocole à partir des données fournies.
 chap.2TP2 Suivi par spectrophotométrie-correction
chap.2TP2 Suivi par spectrophotométrie-correction
Chap 2 – Suivi temporel d'une transformation chimique. Correction. TP 2 : SUIVI TEMPOREL D'UNE REACTION CHIMIQUE PAR SPECTROPHOTOMETRIE. [I2] en mol.L-1.
 Chimie Catalyse et suivi cinétique dune réaction chimique Chap.08
Chimie Catalyse et suivi cinétique dune réaction chimique Chap.08
1 mars 2016 TP. Thème : Observer. TS. Chimie. Catalyse et suivi cinétique d'une ... ? Allumer le spectrophotomètre « signale unique » et le logiciel ...
 CORRECTION TP 4 : ETUDE CINETIQUE DE LIODURATION DE
CORRECTION TP 4 : ETUDE CINETIQUE DE LIODURATION DE
CORRECTION TP 4 : ETUDE CINETIQUE DE L'IODURATION DE LA PROPANONE. 1). SOLUTION 1. SOLUTION 2. SOLUTION 3. Acétone ( pure ). 1 mL. [A]o = 027 mol.L-1.
 CH08 TP cinétique
CH08 TP cinétique
Cette transformation chimique peut être suivie par la mesure de Connecter la sortie absorbance (jaune) du spectrophotomètre à la voie EA1 de l'interface ...
 SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION)
SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION)
Terminale S CHIMIE TP n 2b (correction) 1 SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION) Objectifs : Déterminer l évolution de la vitesse de réaction
 [PDF] TP Spectroscopie : Suivi temporel dune réaction chimique
[PDF] TP Spectroscopie : Suivi temporel dune réaction chimique
TP Spectroscopie : Suivi temporel d'une réaction chimique Le spectrophotomètre Cet appareil permet de mesurer l'absorbance d'une solution
 [PDF] tp:suivi cinétique par spectrophotométrie - ScPhysiques
[PDF] tp:suivi cinétique par spectrophotométrie - ScPhysiques
CHAPITRE 10:CINÉTIQUE ET CATALYSE THÈME 2 : LOIS ET MODÈLES ACTIVITÉ 2 TP:SUIVI CINÉTIQUE PAR SPECTROPHOTOMÉTRIE A LA RÉACTION ÉTUDIÉE
 [PDF] chap2TP2 Suivi par spectrophotométrie-correction
[PDF] chap2TP2 Suivi par spectrophotométrie-correction
Chap 2 – Suivi temporel d'une transformation chimique Correction TP 2 : SUIVI TEMPOREL D'UNE REACTION CHIMIQUE PAR SPECTROPHOTOMETRIE [I2] en mol L-1
 [PDF] CINÉTIQUE DsUNE RÉACTION DsOXYDORÉDUCTION SUIVIE PAR
[PDF] CINÉTIQUE DsUNE RÉACTION DsOXYDORÉDUCTION SUIVIE PAR
Comme on fait un suivi cinétique par spectrophotométrie le tableau de valeurs expérimentales indique les valeurs d'absorbance à différentes dates Pour
 TP2b Chimie Cinetique-Spectrophotometrie Correct PDF - Scribd
TP2b Chimie Cinetique-Spectrophotometrie Correct PDF - Scribd
Terminale S – CHIMIE TP n°2b (correction) 1 SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION) Objectifs : Déterminer l'évolution de la vitesse de
 TP2b Chimie Cinetique-Spectrophotometrie Correct PDF - Scribd
TP2b Chimie Cinetique-Spectrophotometrie Correct PDF - Scribd
Terminale S CHIMIE TP n2b (correction) SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION) Objectifs : Dterminer lvolution de la vitesse de raction par
 [PDF] TP 6 : Suivi cinétique par spectrophotométrie CPGE Brizeux
[PDF] TP 6 : Suivi cinétique par spectrophotométrie CPGE Brizeux
Le BBPH? étant une substance colorée la réaction sera suivie par spectrophotométrie L'ordre partiel par rapport au BBPH? sera déterminé en utilisant la
 [PDF] TP 18 – Étude dune cinétique suivie par spectrophotométrie
[PDF] TP 18 – Étude dune cinétique suivie par spectrophotométrie
TP 18 – Étude d'une cinétique suivie par spectrophotométrie Matériel (par groupe) : spectrophotomètre et cuves chronomètre iodure de potassium (K+
 [PDF] TP : suivi dune transformation par spectrophotométrie
[PDF] TP : suivi dune transformation par spectrophotométrie
TERMINALE S Cinétique Chimique CHAP 2 TP SUIVI TEMPOREL D'UNE TRANSFORMATION CHIMIQUE PAR SPECTROPHOTOMETRIE Matériel:
01/03/2016 TP_CH08_2_Catalyse_suivi_cinetique.doc 1/8
TP Thème : Observer TS
Chimie Catalyse et suivi cinétique d"une réaction chimique Chap.08But du TP : Mettre en oeuvre une démarche expérimentale pour mettre en évidence le rôle d"un catalyseur. Suivre
l"évolution temporelle d"une réaction chimique.I. Etude de la catalyse
· Sécurité : La solution de peroxyde d"hydrogène utilisée est corrosive : Le port de la blouse, de gants et
de lunettes de protection est obligatoire.· L"eau oxygénée est couramment utilisée comme antiseptique (nettoyage des plaies superficielles par
exemple). Cette propriété est due à la présence du peroxyde d"hydrogène H2O2 dissout en solution, qui est un
excellent oxydant. Souvent, l"eau oxygénée est contenue dans un flacon en verre opaque car la molécule H
2O2 se
dismute spontanément en produisant du dioxygène.· Dans trois tubes à essais notés , et , verser environ 10 mL d"eau oxygénée à 10 volumes.
1) La décomposition du peroxyde d"hydrogène est-elle une réaction lente ou rapide ?
2) Sachant que la dismutation de H
2O2 fait intervenir les couples redox H2O2 / H2O et O2 / H2O2, écrire les deux
demi-équations électroniques en milieu acide. Préciser dans chaque cas s"il s"agit d"une oxydation ou d"une
réduction. En déduire l"équation bilan de la réaction.1. Catalyse homogène par les ions fer III
· Dans le tube , verser 1 mL d"une solution de
chlorure de fer III contenant les ions Fe 3+.1.1. Observer et comparer l"évolution de la couleur du milieu réactionnel dans le tube. Identifiez le gaz produit.
1.2. Comment expliquer la rapidité de la réaction en présence des ions fer III ? Quel rôle jouent les ions Fe
3+ introduits ?
1.3. Ajouter à nouveau 2 mL d"eau oxygénée dans le même tube. Que se passe-t-il ? Interpréter.
1.4. Justifier le qualificatif de cette catalyse.
2. Catalyse hétérogène en présence de platine
· Dans le tube , plonger un fil de platine.
2.1. Faire un schéma du tube en précisant où se déroule la transformation chimique.
2.2. Comment pourrait-on améliorer l"efficacité du catalyseur ?
2.3. Justifier le qualificatif de cette catalyse.
3. Catalyse enzymatique en présence de catalase
· Dans le tube , ajouter un morceau de navet
contenant une enzyme, la catalase.3.1. Noter les observations. Justifier le nom de cette enzyme.
3.2. Lors du soin d"une plaie avec de l"eau oxygénée, pourquoi
apparaît-il un dégagement gazeux ?3.3. À partir du doc.1 ci-contre, expliquer pourquoi la
dismutation est plus rapide en présence d"un catalyseur. Une réaction chimique a besoin d'énergie pour se produire. La présence d'un catalyseur abaisse l'énergie d'activation et permet à la réaction d'être plus rapide. Le catalyseur étant régénéré, il n'apparaît donc pas dans l'équation bilan de la réaction. Une enzyme, par ses sites actifs est un catalyseur très spécifique. Cela lui permet aussi d'abaisser l'énergie d'activation de la réaction.01/03/2016 TP_CH08_2_Catalyse_suivi_cinetique.doc 2/8
II. Cinétique d"une réaction chimique
· On souhaite suivre l"évolution temporelle d"une transformation chimique mettant en jeu la réaction
d"oxydoréduction entre le peroxyde d"hydrogène H2O2 et les ions iodure I- en milieu acide.
· Le suivi de l"évolution de la réaction se fait par mesure de l"absorbance A de la solution au cours du temps, grâce à
la formation de diiode I2 brun.
1. Protocole expérimental
· Dans un bécher, verser 10,0 mL de la solution aqueuse d"iodure de potassium de concentration [I -(aq)] = 0,10 mol/L. · Dans le même bécher, ajouter environ 10 mL d"acide sulfurique à 1 mol.L -1.· Dans un second bécher, verser 10,0 mL de solution de peroxyde d"hydrogène de concentration
[H2O2(aq)] = 8,0 mmol/L.
2. Acquisition automatique
Allumer le spectrophotomètre " signale unique » et le logiciel regressi.Indiquer un titre ; choisir un temps final de 15 minutes ; régler la longueur d"onde de mesure (475 nm).
Remplir la cuve de la solution mère de iodure de potassium et la placer dans le spectrophotomètre ; puis valider
pour réaliser le blanc (ou zéro).Une fois le blanc réalisé, mélanger les deux solutions et démarrer l"acquisition : vider la cuve, la remplir du
mélange réactionnel et la replacer dans le spectrophotomètre. Adapter l"échelle du graphique . Une fois l"acquisition achevée, imprimer la courbe.3. Exploitation
3.1. Ajuster l"équation bilan dans le tableau d"avancement ci-dessous.
3.2. Expliquer pourquoi la valeur de l"absorbance augmente au cours du temps.
3.3. Mesurer la durée t
R de fin de la transformation chimique.
3.4. Evaluer le temps de demi-réaction noté t
1/2 .3.5. Compléter le tableau d"avancement. En déduire la valeur de l"avancement maximal x
max.3.6. À partir de la loi de Beer-Lambert, déterminer la relation entre A
max et xmax. Puis, entre A(t) et x(t).3.7. En déduire que la relation x(t) = A(t)
A max ´ xmax est vérifiée. Le temps de demi-réaction sera-t-il différent si on le déterminait à partir de la courbe x = f(t) ?Equation bilan
H2O2(aq) + I-(aq) + H+(aq) ¾® I2 (aq) + H2O (l)
Etat du système Avancement Quantité de matière (en mol)Initial x = 0
Final xmax =
01/03/2016 TP_CH08_2_Catalyse_suivi_cinetique.doc 3/8
III. Objectif Bac : Rédiger une synthèse de documents· Ce dossier contient :
- un texte présentant le principe de la catalyse trois voies des " voitures propres » ; - un schéma d"un pot catalytique ; - un texte présentant les réactions subies par les polluants dans les pots catalytiques.DOCUMENT 1. La catalyse trois voies
La " catalyse 3-voies » est en place sur les voitures neuves depuis le début des années 1990. Elle consiste à faire passer les gaz d"échappement par un filtre dans lequel une réaction de catalyse se produit au contact de métaux précieux et transforme ainsi les polluants, une partie des NO x, le CO et les hydrocarbures imbrûlés (HC) en N2, H2O et CO2.
Le taux de conversion maximum est atteint si la richesse du mélange air- carburant est égale à 1. Elle demande donc un réglage optimum du moteur pour y parvenir et explique que dans certaines conditions de charge, la catalyse soit moins efficace. Extrait d"un rapport du Sénat sur Définition et implications du concept de voiture propre (2012), paragraphe 2.Disponible sur :
DOCUMENT 2. Schéma d"un pot catalytique
DOCUMENT 3. Réactions subies par les polluants dans les pots catalytiques" Dans un moteur à combustion interne, la combustion du carburant dans l"air provoque la formation d"eau et de dioxyde
de carbone. Cependant, les hautes températures dans le front de combustion sont responsables de la formation de
monoxyde de carbone et de monoxyde d"azote. En outre, la combustion du mélange n"étant pas totale, une fraction des
hydrocarbures reste imbrûlée. [...].Les polluants, dont les émissions sont réglementées, sont le monoxyde de carbone, les hydrocarbures C
xHy, les oxydesd"azote et les particules [...]. L"élimination des polluants dans la ligne d"échappement repose sur des transformations
chimiques relativement simples telles que :· 2CO + O
2 ® 2CO2 ; 4CxHy + (4x + y) O2 ® 4x CO2 + 2y H2O ;
· 2 CO + 2NO ® 2 CO
2 + N2 ; CO + H2O ® CO2 + H2 [...]
D"autres réactions sont possibles telles que :· 2H
2 + O2 ® 2H2O ; CO + 2 NO ® N2O + CO2; 5 H2 + 2NO ® 2NH3 + 2H2O.
Ces réactions sont gênantes car elles consomment des réactifs capables d"éliminer les polluants ou elles engendrent des
produits secondaires non recherchés ; N2O est un gaz à effet de serre et NH3 est un composé toxique.
Les réactions recherchées sont toutes possibles d"un point de vue thermodynamique mais leur cinétique est lente dans les
conditions de température et de concentration des gaz d"échappement. L"implantation d"un catalyseur dans la ligne
d"échappement permet d"accélérer les réactions pour les rendre possibles à basse température, c"est-à-dire rapidement
après la mise en marche du moteur. Ce catalyseur doit aussi être sélectif pour favoriser les réactions recherchées et non
celles qui conduisent à des produits secondaires. [...]Les catalyseurs pour moteurs à allumage commandé sont appelés catalyseurs 3-voies car ils réalisent simultanément
l"oxydation de CO, l"oxydation des hydrocarbures et la réduction des NO x. Leur phase active est à base de Pt, Pd, Rh.La catalyse étant un phénomène de surface, il est nécessaire d"obtenir un très grand état de division des métaux nobles
pour que leur activité spécifique soit élevée, ce qui est d"autant plus important que leur coût élevé exige une utilisation
optimale. Pour cela, les métaux nobles sont déposés sur des supports oxydes de grande surface spécifique. »
Extrait de Mabilon G., Dépollution catalytique des gaz d"échappement automobiles, N° Spécial " Chimie et vie quotidienne » Lettre des sciences
chimiques du CNRS, L"actualité Chimique, novembre 1999, p. 117.1) Quel est le rôle du filtre évoqué dans les documents 2 et 3 ?
2) Quel est le type de catalyseur utilisé ?
3) Quelle est la qualité d"un catalyseur mise en évidence dans le document 3 ?
4) Sur l"exemple de la dépollution des gaz d"échappement des véhicules, rédiger une synthèse de 20 lignes pour
montrer comment ces documents mettent en évidence le rôle d"un catalyseur et les caractéristiques spécifiques de la
catalyse hétérogène.01/03/2016 TP_CH08_2_Catalyse_suivi_cinetique.doc 4/8
TP TS
Chimie CORRECTION Catalyse et suivi cinétique d"une réaction chimique Chap.08I. Etude de la catalyse
· Sécurité : La solution de peroxyde d"hydrogène utilisée est corrosive : Le port de la blouse, de gants et
de lunettes de protection est obligatoire.· L"eau oxygénée est couramment utilisée comme antiseptique (nettoyage des plaies superficielles par
exemple). Cette propriété est due à la présence du peroxyde d"hydrogène H2O2 dissout en solution, qui est un
excellent oxydant. Souvent, l"eau oxygénée est contenue dans un flacon en verre opaque car la molécule H
2O2 se
dismute spontanément en produisant du dioxygène.· Dans trois tubes à essais notés , et , verser environ 10 mL d"eau oxygénée à 10 volumes.
5) La décomposition du peroxyde d"hydrogène est-elle une réaction lente ou rapide ?
6) Sachant que la dismutation de H
2O2 fait intervenir les couples redox H2O2 / H2O et O2 / H2O2, écrire les deux
demi-équations électroniques en milieu acide. Préciser dans chaque cas s"il s"agit d"une oxydation ou d"une
réduction. En déduire l"équation bilan de la réaction.1. Catalyse homogène par les ions fer III
· Dans le tube , verser 1 mL d"une solution de
chlorure de fer III contenant les ions Fe 3+.1.1. Observer et comparer l"évolution de la couleur du milieu réactionnel dans le tube. Identifiez le gaz produit.
1.2. Comment expliquer la rapidité de la réaction en présence des ions fer III ? Quel rôle jouent les ions Fe
3+ introduits ?
1.3. Ajouter à nouveau 2 mL d"eau oxygénée dans le même tube. Que se passe-t-il ? Interpréter.
1.4. Justifier le qualificatif de cette catalyse.
2. Catalyse hétérogène en présence de platine
· Dans le tube , plonger un fil de platine.
2.1. Faire un schéma du tube en précisant où se déroule la transformation chimique.
2.2. Comment pourrait-on améliorer l"efficacité du catalyseur ?
2.3. Justifier le qualificatif de cette catalyse.
3. Catalyse enzymatique en présence de catalase
· Dans le tube , ajouter un morceau de navet
contenant une enzyme, la catalase.3.1. Noter les observations. Justifier le nom de cette enzyme.
3.2. Lors du soin d"une plaie avec de l"eau oxygénée, pourquoi
apparaît-il un dégagement gazeux ?3.3. À partir du doc.1 ci-contre, expliquer pourquoi la
dismutation est plus rapide en présence d"un catalyseur. Une réaction chimique a besoin d'énergie pour se produire. La présence d'un catalyseur abaisse l'énergie d'activation et permet à la réaction d'être plus rapide. Le catalyseur étant régénéré, il n'apparaît donc pas dans l'équation bilan de la réaction. Une enzyme, par ses sites actifs est un catalyseur très spécifique. Cela lui permet aussi d'abaisser l'énergie d'activation de la réaction.01/03/2016 TP_CH08_2_Catalyse_suivi_cinetique.doc 5/8
II. Cinétique d"une réaction chimique
· On souhaite suivre l"évolution temporelle d"une transformation chimique mettant en jeu la réaction
d"oxydoréduction entre le peroxyde d"hydrogène H2O2 et les ions iodure I- en milieu acide.
· Le suivi de l"évolution de la réaction se fait par mesure de l"absorbance A de la solution au cours du temps, grâce à
la formation de diiode I2 brun.
1. Protocole expérimental
· Dans un bécher, verser 10,0 mL de la solution aqueuse d"iodure de potassium de concentration [I -(aq)] = 0,10 mol/L. · Dans le même bécher, ajouter environ 10 mL d"acide sulfurique à 1 mol.L -1.· Dans un second bécher, verser 10,0 mL de solution de peroxyde d"hydrogène de concentration
[H2O2(aq)] = 8,0 mmol/L.
2. Acquisition automatique
Allumer le spectrophotomètre " signale unique » et le logiciel regressi.Indiquer un titre ; choisir un temps final de 15 minutes ; régler la longueur d"onde de mesure (475 nm).
Remplir la cuve de la solution mère de iodure de potassium et la placer dans le spectrophotomètre ; puis valider
pour réaliser le blanc (ou zéro).Une fois le blanc réalisé, mélanger les deux solutions et démarrer l"acquisition : vider la cuve, la remplir du
mélange réactionnel et la replacer dans le spectrophotomètre. Adapter l"échelle du graphique . Une fois l"acquisition achevée, imprimer la courbe.3. Exploitation
3.1. Ajuster l"équation bilan dans le tableau d"avancement ci-dessous.
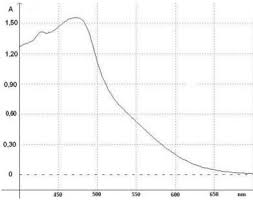
3.2. Expliquer pourquoi la valeur de l"absorbance augmente au cours du temps.
La valeur de l"absorbance est liée à la concentration de l"espèce colorée, ici le diode I
2 qui est un
produit. Sa concentration augmente donc au cours de la transformation, et l"absorbance également.
3.3. Mesurer la durée t
R de fin de la transformation chimique.
3.4. Evaluer le temps de demi-réaction noté t
1/2 .01/03/2016 TP_CH08_2_Catalyse_suivi_cinetique.doc 6/8
3.5. Compléter le tableau d"avancement. En déduire la valeur de l"avancement maximal x
max = 0,080 mmol3.6. À partir de la loi de Beer-Lambert, déterminer la relation entre A
max = 3,15 xmax = 0,080 mmol .Soit A
(t) = 393,75. x(t)3.7. En déduire que la relation x(t) = A(t)
A max ´ xmax est vérifiée. Le temps de demi-réaction sera-t-il différent si on le déterminait à partir de la courbe x = f(t) ? Non car les grandeurs sont proportionnelles .Equation bilan EN MMOL
H2O2(aq) + 2 I-(aq) + 2 H+(aq) ¾® I2 (aq) + 2 H2O (l)
Etat du système Avancement Quantité de matière (en mol) Initial x = 0 0,080 mmol 0,50 mmol excès 0 Excès Final xmax = 0,080 0,080-x=0 0,50-x=0,42 excès 0,080 excès01/03/2016 TP_CH08_2_Catalyse_suivi_cinetique.doc 7/8
III. Objectif Bac : Rédiger une synthèse de documents· Ce dossier contient :
- un texte présentant le principe de la catalyse trois voies des " voitures propres » ; - un schéma d"un pot catalytique ; - un texte présentant les réactions subies par les polluants dans les pots catalytiques.DOCUMENT 1. La catalyse trois voies
La " catalyse 3-voies » est en place sur les voitures neuves depuis le début des années 1990. Elle consiste à faire passer les gaz d"échappement par un filtre dans lequel une réaction de catalyse se produit au contact de métaux précieux et transforme ainsi les polluants, une partie des NO x, le CO et les hydrocarbures imbrûlés (HC) en N2, H2O et CO2.
Le taux de conversion maximum est atteint si la richesse du mélange air- carburant est égale à 1. Elle demande donc un réglage optimum du moteur pour y parvenir et explique que dans certaines conditions de charge, la catalyse soit moins efficace. Extrait d"un rapport du Sénat sur Définition et implications du concept de voiture propre (2012), paragraphe 2.Disponible sur :
DOCUMENT 2. Schéma d"un pot catalytique
DOCUMENT 3. Réactions subies par les polluants dans les pots catalytiques" Dans un moteur à combustion interne, la combustion du carburant dans l"air provoque la formation d"eau et de dioxyde
de carbone. Cependant, les hautes températures dans le front de combustion sont responsables de la formation de
monoxyde de carbone et de monoxyde d"azote. En outre, la combustion du mélange n"étant pas totale, une fraction des
hydrocarbures reste imbrûlée. [...].Les polluants, dont les émissions sont réglementées, sont le monoxyde de carbone, les hydrocarbures C
xHy, les oxydesd"azote et les particules [...]. L"élimination des polluants dans la ligne d"échappement repose sur des transformations
chimiques relativement simples telles que :· 2CO + O
2 ® 2CO2 ; 4CxHy + (4x + y) O2 ® 4x CO2 + 2y H2O ;
· 2 CO + 2NO ® 2 CO
2 + N2 ; CO + H2O ® CO2 + H2 [...]
D"autres réactions sont possibles telles que :· 2H
2 + O2 ® 2H2O ; CO + 2 NO ® N2O + CO2; 5 H2 + 2NO ® 2NH3 + 2H2O.
Ces réactions sont gênantes car elles consomment des réactifs capables d"éliminer les polluants ou elles engendrent des
produits secondaires non recherchés ; N2O est un gaz à effet de serre et NH3 est un composé toxique.
Les réactions recherchées sont toutes possibles d"un point de vue thermodynamique mais leur cinétique est lente dans les
conditions de température et de concentration des gaz d"échappement. L"implantation d"un catalyseur dans la ligne
d"échappement permet d"accélérer les réactions pour les rendre possibles à basse température, c"est-à-dire rapidement
après la mise en marche du moteur. Ce catalyseur doit aussi être sélectif pour favoriser les réactions recherchées et non
celles qui conduisent à des produits secondaires. [...]Les catalyseurs pour moteurs à allumage commandé sont appelés catalyseurs 3-voies car ils réalisent simultanément
l"oxydation de CO, l"oxydation des hydrocarbures et la réduction des NO x. Leur phase active est à base de Pt, Pd, Rh.La catalyse étant un phénomène de surface, il est nécessaire d"obtenir un très grand état de division des métaux nobles
pour que leur activité spécifique soit élevée, ce qui est d"autant plus important que leur coût élevé exige une utilisation
optimale. Pour cela, les métaux nobles sont déposés sur des supports oxydes de grande surface spécifique. »
Extrait de Mabilon G., Dépollution catalytique des gaz d"échappement automobiles, N° Spécial " Chimie et vie quotidienne » Lettre des sciences
chimiques du CNRS, L"actualité Chimique, novembre 1999, p. 117.1) Quel est le rôle du filtre évoqué dans les documents 2 et 3 ? Transformer ainsi les polluants, une partie des NOx,
le CO et les hydrocarbures imbrûlés (HC) en N2, H2O et CO2.
2) Quel est le type de catalyseur utilisé ?
Métaux précieux, leur phase active est à base de Pt, Pd, Rh.01/03/2016 TP_CH08_2_Catalyse_suivi_cinetique.doc 8/8
3) Quelle est la qualité d"un catalyseur mise en évidence dans le document 3 ?
Activité spécifique soit élevée
4) Sur l"exemple de la dépollution des gaz d"échappement des véhicules, rédiger une synthèse de 20 lignes pour
montrer comment ces documents mettent en évidence le rôle d"un catalyseur et les caractéristiques spécifiques de
la catalyse hétérogène.Une réaction de catalyse se produit au contact de métaux précieux et transforme ainsi les polluants,
L"élimination des polluants dans la ligne d"échappement repose sur des transformations chimiques relativement
simples telles que :· 2CO + O
2 ® 2CO2 ; 4CxHy + (4x + y) O2 ® 4x CO2 + 2y H2O ;
· 2 CO + 2NO ® 2 CO
2 + N2 ; CO + H2O ® CO2 + H2 [...]
D"autres réactions sont possibles telles que :
· 2H
2 + O2 ® 2H2O ; CO + 2 NO ® N2O + CO2; 5 H2 + 2NO ® 2NH3 + 2H2O.
Un catalyseur dans la ligne d"échappement permet d"accélérer les réactions Ce catalyseur doit aussi être sélectif pour favoriser les réactions recherchéesLes catalyseurs pour moteurs à allumage commandé sont appelés catalyseurs 3-voies car ils réalisent simultanément
l"oxydation de CO, l"oxydation des hydrocarbures et la réduction des NO xquotesdbs_dbs35.pdfusesText_40[PDF] suivi cinétique par spectrophotométrie dune transformation lente
[PDF] correction tp cinétique chimique
[PDF] compte rendu tp cinetique chimique
[PDF] fiche révision bts hotellerie restauration
[PDF] exercice brevet equation produit nul
[PDF] ne l'entendez vous pas
[PDF] pidapi cm2 exercices
[PDF] pidapi cm2
[PDF] pidapi prix
[PDF] pidapi fiches
[PDF] suites et fonctions stmg
[PDF] progression maths terminale stmg
[PDF] comment calculer un angle dans un tableau de statistique
[PDF] calculer l'aire d'une pyramide ? base rectangle
