 Cours TS spécialité N°3 : Chimie
Cours TS spécialité N°3 : Chimie
Titrage direct et titrage indirect a) Titrage direct : Lors d'un titrage Exemple : La réaction entre le diiode I2 et les ions thiosulfate S2O3. 2- obéit à ...
 Dosages indirects
Dosages indirects
Dosage indirect Un dosage indirect met en jeu deux transformations successives. Principe Dans un titrage indirect on ajoute un excès connu d'un réactif R1 à
 Thème : Enseignement de spécialité Fiche 11 : Contrôles de qualité
Thème : Enseignement de spécialité Fiche 11 : Contrôles de qualité
Titrage indirect : dosage nécessitant deux transformations : - la première Exemple 1 : dosage indirect de l'eau de Javel. Les ions hypochlorite ClO- ne ...
 Dosage indirect
Dosage indirect
Dosage indirect. C1 = ? V1. On s'arrange pour être sûr que ce réactif soit en excès. Dosage direct d'un des produits de la réaction 1 par exemple le produit C.
 Dosage indirect ? Dosage en retour ?
Dosage indirect ? Dosage en retour ?
Un tel titrage peut être précédé par une étape de substitution (réaction B par exemple). Le réactif doit toujours être introduit en excès mais sa quantité
 Différents types de dosages Détermination de la concentration dun
Différents types de dosages Détermination de la concentration dun
Les nouveaux programmes de première et terminale font appel à des dosages particuliers tels que le dosage en retour ou le dosage indirect (l'échantillon à
 Vuibert
Vuibert
dans ce cas par titrage indirect. Cette méthode permet de vérifier la mac Par exemple
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
titrage direct (voir Extrait 8 par exemple). MÉTHODE : • Bien lire l'énoncé en se l'appropriant : - identifier l'espèce titrée et l'espèce titrante (placée ...
 TD – Réactions doxydoréduction
TD – Réactions doxydoréduction
Titrage en retour (exercice II partie 1) et titrage indirect (exercice II partie Prenons l'exemple du titrage d'une solution de sel de Mohr (Fe2+. (aq) SO2 ...
 Glossaire daccompagnement des programmes de chimie
Glossaire daccompagnement des programmes de chimie
Titrage indirect (M). 20. Caractère « IN » ou « EX » d'une pièce de verrerie Titrage par la soude des ions ammonium contenus dans une solution aqueuse.
 Cours TS spécialité N°3 : Chimie
Cours TS spécialité N°3 : Chimie
L'équivalence correspond à l'apparition d'une couleur bleue en présence de Thiodène®. b) Titrage indirect : Exemple : On ne peut pas titrer des ions
 Thème : Enseignement de spécialité Fiche 11 : Contrôles de qualité
Thème : Enseignement de spécialité Fiche 11 : Contrôles de qualité
Exemples : titrage acido-basique pH-métrique ou colorimétrique (par utilisation de la Titrage indirect : dosage nécessitant deux transformations :.
 Dosages indirects
Dosages indirects
Dosage indirect Un dosage indirect met en jeu deux transformations successives. Principe Dans un titrage indirect on ajoute un excès connu d'un réactif R1 à
 Dosage indirect
Dosage indirect
Dosage indirect. C1 = ? V1. On s'arrange pour être sûr que ce réactif soit en excès. Dosage direct d'un des produits de la réaction 1 par exemple le
 Dosage indirect ? Dosage en retour ?
Dosage indirect ? Dosage en retour ?
Un tel titrage peut être précédé par une étape de substitution (réaction B par exemple). Le réactif doit toujours être introduit en excès mais sa quantité
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Établir l'équation de la réaction support de titrage EXERCICE 2 – UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE L'IBUPROFÈNE. ACCÈS CORRECTION.
 Remarque sur les titrages :
Remarque sur les titrages :
En Terminale S on appelle titrage « indirect »
 TB1TP fiche 5 dosage
TB1TP fiche 5 dosage
exemple il y est possible de faire un suivi conductimétrique pour un dosage acido-basique
 Les bases du titrage - Travaux pratiques
Les bases du titrage - Travaux pratiques
Pour la détermination de la teneur en eau par exemple par titrage. Karl Fischer
 DOSAGE DUNE EAU DE JAVEL
DOSAGE DUNE EAU DE JAVEL
En donner un exemple. A quelle condition un tel titrage peut-il être réalisé expérimentalement ? Dans un titrage indirect l'espèce A que l'on souhaite
 [PDF] Thème : Enseignement de spécialité Fiche 11 : Contrôles de qualité
[PDF] Thème : Enseignement de spécialité Fiche 11 : Contrôles de qualité
Titrage indirect : dosage nécessitant deux transformations : - la première transformant l'espèce chimique à doser : réaction de l'espèce A à doser avec une
 5titrage Direct Et Indirect PDF PDF - Scribd
5titrage Direct Et Indirect PDF PDF - Scribd
Au cours d'un titrage indirect deux transformations totales rapides et uniques se succèdent Dans la première on fait réagir un excès de solution titrante Ti
 [PDF] Cours TS spécialité N°3 : Chimie
[PDF] Cours TS spécialité N°3 : Chimie
Lors d'un titrage indirect l'espèce chimique dont on cherche à déterminer la concentration n'intervient pas lors de l'équivalence Page 2 3 Réaction de
 [PDF] Dosages indirects - chaurandfr
[PDF] Dosages indirects - chaurandfr
Principe Dans un titrage indirect on ajoute un excès connu d'un réactif R1 à une prise d'essai de l'es- pèce A à doser la transformation A + R1 ? C +
 [PDF] Dosage indirect ? Dosage en retour ?
[PDF] Dosage indirect ? Dosage en retour ?
Un tel titrage peut être précédé par une étape de substitution (réaction B par exemple) Le réactif doit toujours être introduit en excès mais sa quantité
 [PDF] 2 dosage indirect en retour - AC Nancy Metz
[PDF] 2 dosage indirect en retour - AC Nancy Metz
Remarque : pour un dosage indirect par simple couplage de réactions le calcul de la concentration de la solution à TITRAGE DU THIOCYANATE DE POTASSIUM
 [PDF] Dosage indirect - laboiteaphysique
[PDF] Dosage indirect - laboiteaphysique
Dosage indirect C1 = ? V1 On s'arrange pour être sûr que ce réactif soit en exemple le produit C V3éq C3 connue Réaction 1 : A + B C + D
 [PDF] Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
[PDF] Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
EXERCICE 2 – UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE L'IBUPROFÈNE ACCÈS CORRECTION Troisième partie : titrage d'un comprimé d'ibuprofène
 [PDF] TP n°06 Titrage indirect de la vitamine C Terminale spé - Meck-anique
[PDF] TP n°06 Titrage indirect de la vitamine C Terminale spé - Meck-anique
d'oxyder les constituants des aliments et protège ainsi par exemple les corps gras contre le rancissement Ce sont ces propriétés réductrices que nous
 [PDF] ex_chap3_correctionpdf
[PDF] ex_chap3_correctionpdf
Dans tous les exercices on donnera la formule littérale puis on fera EXERCICES D'AUTOMATISATION Ex 19 – Titrage indirect de la vitamine C
Qu'est-ce qu'un titrage indirect ?
Lorsque la réaction de titrage consomme une esp? dont la concentration est reliée à celle de l'esp? d'intérêt Eint, on parle de titrage indirect : plusieurs réactions peuvent être mises en jeu.Quand faire un titrage indirect ?
Un dosage indirect, on l'utilise quand le dosage direct de la solution est difficile.Comment savoir si un titrage est direct ou indirect ?
Dans un titrage direct, la manipulation ne met en jeu qu'une seule réaction chimique, contrairement à un titrage indirect qui en utilise plusieurs (pour consommer le titré, puis le titrant).- La détection du point d'équivalence se fait en suivant un changement de couleur ou une formation d'un précipité : changement de couleur (titrage colorimétrique) : sans ajout d'un indicateur coloré : dans quelques réactions chimiques, la solution change de couleur au point d'équivalence.
TS -Spécialité PHYSIQUE
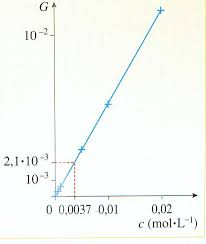
Cours de Chimie N° 3EFFECTUER DES CONTRÔLES DE QUALITÉ1. Détermination d'une concentration par dosageLa spectrophotométrie et la conductimétrie permettent la détermination d'une concentration au moyen d'une courbed'étalonnage (voir doc. 1). Ces dosages par étalonnage se révèlent précis mas nécessitent l'utilisation d'un appareillagesophistiqué. Les dosages par titrage font intervenir l'entité dont on cherche à déterminer la concentration à l'aide d'une réactionchimique.Quel que soit le titrage, il faut faire réagir un volume, ajouté progressivement à la burette, d'une solution titrante deconcentration connue avec un volume précis de solution de concentration inconnue. On visualise la fin du titrage enutilisant un indicateur de fin de réaction (changement de couleur) ou en exploitant l'allure de la courbe en cas dedétermination d'un pH. 2. Titrage direct et titrage indirecta)Titrage direct : Lors d'un titrage direct la réaction chimique utilisée met en jeu, au moment de l'équivalence, l'espècechimique dont on veut déterminer la concentration et le réactif titrant.Exemple :La réaction entre le diiode I2 et les ions thiosulfate S2O32- obéit à ces critères. On peut montrer, pour chaquecas concret, son caractère quasi total, grâce à sa constante d'équilibre (K = 5.1015). Elle est rapide : chaquegoutte de réactif titrant ajoutée réagit au moment même du mélange. Il n' y a pas de réaction concurrente.L'équivalence correspond à l'apparition d'une couleur bleue en présence de Thiodène®.
b)Titrage indirect : Exemple :On ne peut pas titrer des ions hypochlorite ClO- avec les ions thiosulfate S2O32- car plusieurs réactions sonten compétition : production de S4O62-, de SO42- ...
On ne peut pas non plus utiliser la réaction des ions hypochlorite ClO- avec les ions iodure I- car ladétermination de l'équivalence est impossible de par l'absence de changement de couleur.Le titrage des ions hypochlorite ClO- va donc mettre en jeu, dans une première étape, la réaction entre lesions ClO- et un excès d'ions I-.
Le diiode formé est ensuite titré par les ions S2O32- , réaction connue pour posséder toutes les qualitésrequises pour un titrage. Le titrage des ions ClO- est de ce fait indirect puisque, au moment de l'équivalence(réaction entre I2 et S2O32- ), les ions ClO- n'interviennent pas.La détermination de la quantité de matière d'ions ClO- est facilités par une représentation schématique (voirdoc. 2).A l'équivalence, les réactifs introduits sont dans les proportions stoechiométriques. L'équation du titrage, le volume à l'équivalence et les conditions initiales permettent de déterminer laconcentration ou la quantité de matière inconnue. La réaction servant de support à un titrage direct doit obéir aux critèressuivants : •être quasi totale,•être rapide,•ne pas être en compétition avec une autre réaction,•permettre la détermination de l'équivalence.Lors d'un titrage indirect, l'espèce chimique dont on cherche à déterminer laconcentration n'intervient pas lors de l'équivalence.
3. Réaction de complexationExemple :Un ion solvaté est un complexe, par exemple l'ion cuivre Cu(H2O)62+.
La réaction d'une solution de sulfate de cuivre avec une solution d'ammoniaque conduit à la formationd'une coloration bleu céleste, caractéristique du complexe Cu(NH3)42+.
On met, par exemple, en évidence la présence d'ions Fe3+ en solution en ajoutant des ions SCN- (voirdocument 3). La formation du complexe Fe(SCN)2+, de couleur rouge sang, est caractéristique de laprésence des ions Fe3+.
Remarque :Il faut distinguer précipité et complexe.•Un précipité est insoluble et électriquement neutre.•Un complexe peut être chargé ou non, en solution ou au sein d'un solide.•Précipité et complexe peuvent être, ou non, colorés.•Il faut distinguer précipité et complexe.Un complexe est une entité polyatomique composée d'un ion métallique central lié à un ou plusieursions (ou molécules) appelées ligands. La réaction de formation d'un complexe est toujours réversible.Document 1Document 3Document 2
quotesdbs_dbs35.pdfusesText_40[PDF] etalonnage du permanganate de potassium par le sel de mohr
[PDF] couleur des ions mn2+
[PDF] dosage par comparaison premiere es
[PDF] qualité des sols et de l eau bac
[PDF] qualité des sols et de l eau 1ère es
[PDF] dosage par étalonnage conductimétrique
[PDF] dosage par étalonnage terminale s
[PDF] tp dosage par étalonnage avec un conductimètre correction
[PDF] protocole dosage par titrage
[PDF] titrage conductimétrique d'un sérum physiologique correction
[PDF] dosage par étalonnage def
[PDF] tp spectrophotométrie dosage par étalonnage
[PDF] dosage par spectrophotométrie uv-visible
[PDF] dosage par étalonnage tp protocole
