 Cours de Physique II Calorimétrie-Dilatation 2014-2015
Cours de Physique II Calorimétrie-Dilatation 2014-2015
Chapitre un : Notion de quantité de chaleur. 1.1. Température. 1.1.1. Equilibre thermique. 1.1.2. Notion de température. 1.1.3. Échelle Kelvin.
 F2School
F2School
Dans un calorimètre de capacité thermique µ on introduit une masse m1 d'un liquide de capacité calorifique massique c1
 Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de
Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de
Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de force de pression. Cours de thermodynamique (par Dr HENNI MANSOUR Z). 13. Au cours d'une
 Untitled
Untitled
Cours Master de Chimie. 2ème année. Calorimétrie. ; et applications. Pr. M. Mekkaoui. Année Universitaire 2007-2008. .1. Page 2. Calorimétrie et applications ..
 CALORIMETRIE
CALORIMETRIE
ENERGIE THERMIQUE-TEMPERATURE-CHALEUR-CALORIMETRIE. L'énergie thermique Eθ est due à l'agitation incessante au niveau microscopique
 BIOENERGITIQUES
BIOENERGITIQUES
La calorimétrie : est la mesure de la quantité d'énergie utilisée par un L'activité physique : la dépense énergétique augmente au cours de l'activité ...
 Chapitre 6 :Capacités thermiques calorimétrie
Chapitre 6 :Capacités thermiques calorimétrie
https://www.immae.eu/cours/. Page 2. Chapitre 6 : Capacités thermiques calorimétrie. Thermodynamique. Page 2 sur 5. Pour une transformation élémentaire
 Ageps
Ageps
en lactate au cours de la glycolyse anaérobie la synthèse de l'ATP est liée à l'oxydation des substrats avec production de trois moles d'ATP par atome
 Matériaux de référence pour les techniques danalyse thermique et
Matériaux de référence pour les techniques danalyse thermique et
développement est en cours au Japon. C'est dans ce contexte que le. BNM a commandé œ la calorimétrie avec en particulier la calorimétrie différentielle ...
 Calorimétrie Quelques formules …. Lors dun changement détat la
Calorimétrie Quelques formules …. Lors dun changement détat la
cours de sa fusion est donnée par la relation : Q = M.Lf. Q en J M en kg et Lf en J/kg. - Le coefficient de proportionnalité Lf s'appelle la chaleur latente ...
 Cours de Physique II Calorimétrie-Dilatation 2014-2015
Cours de Physique II Calorimétrie-Dilatation 2014-2015
Cours de Physique II Calorimétrie-Dilatation. 2014-2015. 3/26. Chapitre un : Notion de quantité de chaleur. 1.1. Température. 1.1.1. Equilibre thermique.
 Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de
Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de
Cours de thermodynamique (par Dr HENNI MANSOUR Z). 6. Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de force de pression.
 Corrigé fiche de TD N° 2 (Calorimétrie) 2019-2020 Exercice 1
Corrigé fiche de TD N° 2 (Calorimétrie) 2019-2020 Exercice 1
transformations au cours desquelles il n'y pas d'échanges de chaleur avec le milieu extérieur. 8- Représentation graphique d'une transformation.
 Chapitre 6 :Capacités thermiques calorimétrie
Chapitre 6 :Capacités thermiques calorimétrie
Chapitre 6 : Capacités thermiques calorimétrie. Thermodynamique. Page 1 sur 5 4.0 International”. https://www.immae.eu/cours/ ...
 La dépense énergétique
La dépense énergétique
Support de Cours (Version PDF) - II.2 La calorimétrie indirecte . ... La mesure de la consommation d'oxygène (calorimétrie indirecte).
 Plan Principes de la calorimétrie Calorimétrie électromagnétique (1/4)
Plan Principes de la calorimétrie Calorimétrie électromagnétique (1/4)
Calorimétrie. VII. Electronique et système d'acquisition. VIII.Détecteurs de physique des hautes énergie. P. Puzo / 2007-2008.
 CORRECTION DES EXERCICES DE CALORIMETRIE : exercices 1
CORRECTION DES EXERCICES DE CALORIMETRIE : exercices 1
Déterminer la capacité thermique C du calorimètre et de ses accessoires. Données: Chaleur massique de l'eau : ce= 4185 J.kg-1.K-1 ; Masse volumique de l
 Calorimétrie Quelques formules …. Lors dun changement détat la
Calorimétrie Quelques formules …. Lors dun changement détat la
La quantité de chaleur absorbée par un corps de masse M au cours de sa fusion est donnée par la relation : Q = M.Lf. Q en J M en kg et Lf en J/kg.
 Relation fondamentale de la calorimétrie
Relation fondamentale de la calorimétrie
Page 1. 1. Page 2. 2. Page 3. 3. Page 4. 4.
 COURS DE THERMODYNAMIQUE
COURS DE THERMODYNAMIQUE
Ce cours de thermodynamique est destiné aux étudiants de 1 Les mesures calorimétriques permettent de déterminer les quantités de chaleurs spécifiques.
 CALORIMETRIE INTRODUCTION AUX METHODES D’ANALYSE THERMIQUE
CALORIMETRIE INTRODUCTION AUX METHODES D’ANALYSE THERMIQUE
L’ analyse thermique désigne toute technique de mesures où le changement d’ une propriété d’ un échantillon est lié à une variation de température imposée Dans la pratique on peut distinguer : les cas où est enregistrée une grandeur suite à une évolution imposée de la température au cours du temps (échelons rampes
 Chapitre II : Thermométrie Chaleur - Calorimétrie Travail de
Chapitre II : Thermométrie Chaleur - Calorimétrie Travail de
La chaleur molaire notée Cp c’est la quantité d'énergie à apporter par échange thermique pour élever d'un (1) kelvin la température d’une mole d'une substance Exemple : chauffage de 20°C à 80°C de m = 2 kg d’eau à pression constante 2 10 3 * 4 185 80 20 502 2 kj 120 kcal
Mohamed BOUDIAF »
Faculté de Chimie
Département de Génie des Matériaux
Destiné
aux étudiants de 1ère année Génie des ProcédésRachida OUARGLI-SAKER
2015-2016
Scientifique
COURS DE
THERMODYNAMIQUE
République Algérienne Démocratique Et PopulaireAvant propos :
Ce cours de thermodynamique est destiné aux étudiants de 1ère année érieur de spécialité génie des procédés et science de la matière. Le premier chapitre introduit les notions fondamentales et les premières définitions utilisées en .Le deuxième chapitre développe
premier principe. Le troisième chapitre est consacré à la chimie. Le quatrième et dernier chapitre présente le deuxième principe de la thermodynamique, les notions et les différentes expr ainsi introduction aux machines thermiques et les cycles thermodynamiques. Cette présentation résulte de la lecture de nombreux ouvrages et documents dont la plupart ne sont pas cités dans la bibliographie.Tables des matières
CHAPITRE I : Notions fondamentales de la thermodynamiqueI. 1. Introduction générale 01
I.1.1. Notion de la température 02
I.1.2. Notion de la pression 03
05I.1.4. Unités 05
06I.2.1. Définition du système 06
I.2.3. Evolution ou transformation du système 07 08 I.2.5. Représentations graphiques des évolutions du système 10I.2.6. 11
I.2.7. Principe zéro 12
CHAPITRE II : travail, chaleur, énergie interneII.1. Introduction 13
(U) 13II.2.1. 13
II.3. La chaleur (Q) 14
II.3.1. Chaleur sensible 14
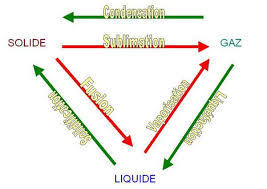
II.3.2. Chaleur latente 15
II.3.3. Calorimétrie 16
II.4. Le travail (W) 19
II.5. Convention du 21
II.6. Le 1er principe de la thermodynamique 22
II.6.1. Enoncé du 1er principe de la thermodynamique 22 23II. 8. Capacité calorifique 24
II.9. Les transformations réversibles 26
II.9.1. ransformationisochore (à volume constant) 26 II.9.2. ransformation isobare (à pression constante) 27 II.9.3. ransformationisotherme (à température constante) 29 II.9.4. ransformationadiabatique (chaleur Q constante) 30 CHAPITRE III : Thermochimie : Application du 1er principe à la chimie III. 1. Etat standard et chaleur de réaction 36III. 2. Relation entre 38
III.3. Enthalpie standard de réaction 39
III.4. Loi de HESS 40
III.5. Loi de KIRCHOFF 43
III.6. Energie de la liaison covalente 45
CHAPITRE IV : 2ème principe de la thermodynamiqueIV.1. Introduction 47
47IV.3. Enoncés du second principe 48
IV.3.1. Enoncé de CLAUSIUS 48
IV.3.2. Enoncé de KELVIN 48
IV.3.3. Enoncé mathématique 49
5153
IV.5.1. Transformation isotherme réversible 53
IV.5.2. Transformation isobare réversible 53
IV.5.3. Transformation isochore réversible 54
IV.5.4. Transformation adiabatique 54
5455
IV.7. 57
IV.8. 60
60IV.10. Les machines thermiques 62
IV.10.1. Machines thermodynamiques (T.D) 62
IV.10.2. Machines dynamo-thermiques (D.T) 63
IV.11. Cycles thermodynamiques 64
IV.11.1. Cycle de Carnot 65
IV.11.2. Cycle de Beau Rochas (OTTO) 66
IV.11.3. Cycle de Diesel 66
IV.11.4. Cycle de Rankine 67
IV.11.5. Cycle de Stirling 68
Références bibliographiques 71
1 CHAPITRE I : Notions fondamentales de la thermodynamiqueI. 1. Introduction générale
La thermodynamique est une science qui nait à la fin du 17ème siècle On rapporte que Denis PAPIN (Physicien français, 1647-1714 et ainsi fournir du travail. trouver les conditions optimales pour transformer la chaleur en travail. On trouve dans cette phrase les trois (03) mots fondateurs de la thermodynamique. Ce non (thermodynamique) vient du grec signifiant respectivement chaleur et force. On peut décrire la thermodynamique de deux (02) manières ou selon deux (02) aspects différents : a. : on s microscopique ou atomique en utilisant comme variables les grandeurs cinétiques thermodynamique classique ou statique. a. Thermodynamique classique Elle explique le comportement de la matière ou des systèmes en fonction de leurs variationsévolution et dresse le bilan énergétique du système. Le chemin suivi par la transformation du
système peut jouer un rôle (la notion de réversibilité des transformations). 2 b. Thermodynamique statique et la signification des variables macroscopiques (P, T) et chaleur.I. 1. 1. Notion de température
Vi des
molécules et donc leur énergie cinétique Ei du milieu est plus grand.A la température 0K (Zéro absolu à -273°C), les atomes et les molécules qui constituent la
matière sont figées.Exemple :
, les molécules du gaz se totalement aléatoire avec des vitesses Vi.Gaz dans une enceinte
Donc la température est définie par la relation suivante:Où :
M est la masse des particules.
V est la vitesse des particules qui constituent la matière. k est une constante.T est la température de la matière.
3 On peut définir plusieurs échelles de température, telle qui précède toute autre échelle. e (K) en kelvin en fonction du Celsius. selon une échelle prédéfinie. Il existe différents types de thermomètres utilisés dans la pratique, ci-dessous quelques exemples les plus utilisé :Les thermomètres à mercure.
Les résistances de platine utilisables entre de 200 à °C630.à 1300°C.
Les résistances à semi-conducteurs en Germanium (Ge) pour T< 77 KI. 1. 2. Notion de la pression
La pression est due aux nombreux chocs des atomes ou molécules de la matière sur les parois du récipient.Exemple :
a N molécules de gaz en agitation permanente.Pression dans une enceinte
4Soit ܖ
Donc, on définit la pression par la relation suivante:Où :
P est la nte.
M est la masse des molécules de gaz.
V est la vitesse des molécules de gaz.
On distingue entre pression absolue et relative et entre pression totale et partielleOù :
Pabs : Pression absolue.
Prel : Pression relative.
Patm : Pression atmosphérique.
Où :
Pi : Pression partielle.
Xi : Fraction molaire.
PT : Pression totale.
Donc :
5 I. 1. Les échanges de lde la matière se présentent sous deux formes possibles; la chaleur (Q) ou le travail (W). chelle microscopique comme une et des atomes sous forme désordonnée (chaleur Q), ou ordonnée (travail W).Déplacement du piston
Transfert de chaleur (Q) Transfert de travail (W) par déplacement du pistonI. 1. 4. Unités
La majorité des unités en Système international [S. I] utilisés dans ce cours sont les suivants :
Temps : en secondes [s]
Température : en degré Kelvin [K]
Pression : en Pascal [Pa] ou [N/m2]
1 Pa = 1 N/m2 ; 1atm = 1,013bar = 1,013105 Pa = 760 Torr = 76 cmHg
1 bar = 105 Pa = 750 Torr
Energie: en Joule [J] et
1 calorie = 4,184 Joules
Puissance : en Watt [W] et 1W = 1 J/s
6 I.I. 2. 1. Définition du système
Pour décrire thermodynamiquement un système, il faut à la fois : Définir le système en délimitant ses frontières par rapport au milieu extérieur.Le système est défini comme une partie de matière (de masse donnée) délimitée par rapport
space entourant le système.Milieu
Extérieur
Délimitation du système
Il existe différents types de systèmes thermodynamiques qui sont représentés dans le tableau
ci-dessous:Système Echange de
matière ExempleIsolé Non Non Calorimètre
Fermé Non Oui Piles électriques
Ouvert Oui Oui Être vivant
Système Système
7I. 2. 2. Etat du système
les macroscopiques (m, P, T, V,etc) dites aussi . possibles. des valeurs bien définies et constantes.On distingue alors selon le cas entre :
Variables ou grandeurs thermiques (P, V, T) ou calorifiques (U, H, W, Q, S). Variables extensives, -à dire proportionnelles à la quantité de matière telle que (m, V, U,..etc) ou variables intensives, -à dire indépendantes de la masse telle que (P,T, concentration,). On définit souvent des grandeurs massiques-à d système telle que : le volume massique. I. 2. 3. Evolution ou transformation du système système évolue et les variables dmodifiés. On dit que le système se initial (1) à un autre état final (2). (W ou Q cédés) Ou (W ou Q reçus)Evolution
Etat (1) Etat (2) (Q ou W) avec le milieu extérieurP1, V1, T1 P2, V2, T2
8 Au cours du système varient pour atteindre un autre (1) (2) se déroule en général hors équilibre. On distingue alors entre : Transformations réversibles ou (idéales) : ce sont les transformations infiniment lentes Transformations irréversibles (réelles) : ce sont des transformations rapides et brutales hors équilibre. intermédiaires peu -statiques). Les transformations naturelles spontanées sont irréversibles; elles ne peuvent évoluer que dans un seul sens. (a) (b) Transformations: (a) irréversible et (b) réversible I. 2. pas toutes indépendantes, mais liées entre elles par des équations dites du type : ݂:2quotesdbs_dbs50.pdfusesText_50[PDF] calorimétrie exercices
[PDF] calorimétrie exercices corrigés pdf
[PDF] calorimétrie formule
[PDF] calorimétrie tp chimie
[PDF] calorimétrie tp corrigé
[PDF] calque pixlr
[PDF] cambios fisiologicos en el embarazo pdf 2015
[PDF] cambios fisiologicos en el embarazo pdf elsevier
[PDF] cambios fisiologicos en el embarazo pdf medigraphic
[PDF] cambios fisiologicos en el embarazo pdf williams
[PDF] cambios fisiologicos en el embarazo por sistemas
[PDF] cambios fisiologicos en el embarazo por trimestre
[PDF] cambios fisiologicos en el embarazo slideshare
[PDF] cambridge flyers past exam papers
