 Cours de Physique II Calorimétrie-Dilatation 2014-2015
Cours de Physique II Calorimétrie-Dilatation 2014-2015
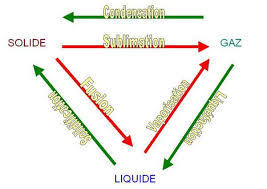
Chapitre un : Notion de quantité de chaleur. 1.1. Température. 1.1.1. Equilibre thermique. 1.1.2. Notion de température. 1.1.3. Échelle Kelvin.
 F2School
F2School
Dans un calorimètre de capacité thermique µ on introduit une masse m1 d'un liquide de capacité calorifique massique c1
 Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de
Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de
Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de force de pression. Cours de thermodynamique (par Dr HENNI MANSOUR Z). 13. Au cours d'une
 Untitled
Untitled
Cours Master de Chimie. 2ème année. Calorimétrie. ; et applications. Pr. M. Mekkaoui. Année Universitaire 2007-2008. .1. Page 2. Calorimétrie et applications ..
 CALORIMETRIE
CALORIMETRIE
ENERGIE THERMIQUE-TEMPERATURE-CHALEUR-CALORIMETRIE. L'énergie thermique Eθ est due à l'agitation incessante au niveau microscopique
 BIOENERGITIQUES
BIOENERGITIQUES
La calorimétrie : est la mesure de la quantité d'énergie utilisée par un L'activité physique : la dépense énergétique augmente au cours de l'activité ...
 Chapitre 6 :Capacités thermiques calorimétrie
Chapitre 6 :Capacités thermiques calorimétrie
https://www.immae.eu/cours/. Page 2. Chapitre 6 : Capacités thermiques calorimétrie. Thermodynamique. Page 2 sur 5. Pour une transformation élémentaire
 Ageps
Ageps
en lactate au cours de la glycolyse anaérobie la synthèse de l'ATP est liée à l'oxydation des substrats avec production de trois moles d'ATP par atome
 Matériaux de référence pour les techniques danalyse thermique et
Matériaux de référence pour les techniques danalyse thermique et
développement est en cours au Japon. C'est dans ce contexte que le. BNM a commandé œ la calorimétrie avec en particulier la calorimétrie différentielle ...
 Calorimétrie Quelques formules …. Lors dun changement détat la
Calorimétrie Quelques formules …. Lors dun changement détat la
cours de sa fusion est donnée par la relation : Q = M.Lf. Q en J M en kg et Lf en J/kg. - Le coefficient de proportionnalité Lf s'appelle la chaleur latente ...
 Cours de Physique II Calorimétrie-Dilatation 2014-2015
Cours de Physique II Calorimétrie-Dilatation 2014-2015
Cours de Physique II Calorimétrie-Dilatation. 2014-2015. 3/26. Chapitre un : Notion de quantité de chaleur. 1.1. Température. 1.1.1. Equilibre thermique.
 Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de
Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de
Cours de thermodynamique (par Dr HENNI MANSOUR Z). 6. Chapitre II : Thermométrie – Chaleur - Calorimétrie – Travail de force de pression.
 Corrigé fiche de TD N° 2 (Calorimétrie) 2019-2020 Exercice 1
Corrigé fiche de TD N° 2 (Calorimétrie) 2019-2020 Exercice 1
transformations au cours desquelles il n'y pas d'échanges de chaleur avec le milieu extérieur. 8- Représentation graphique d'une transformation.
 Chapitre 6 :Capacités thermiques calorimétrie
Chapitre 6 :Capacités thermiques calorimétrie
Chapitre 6 : Capacités thermiques calorimétrie. Thermodynamique. Page 1 sur 5 4.0 International”. https://www.immae.eu/cours/ ...
 La dépense énergétique
La dépense énergétique
Support de Cours (Version PDF) - II.2 La calorimétrie indirecte . ... La mesure de la consommation d'oxygène (calorimétrie indirecte).
 Plan Principes de la calorimétrie Calorimétrie électromagnétique (1/4)
Plan Principes de la calorimétrie Calorimétrie électromagnétique (1/4)
Calorimétrie. VII. Electronique et système d'acquisition. VIII.Détecteurs de physique des hautes énergie. P. Puzo / 2007-2008.
 CORRECTION DES EXERCICES DE CALORIMETRIE : exercices 1
CORRECTION DES EXERCICES DE CALORIMETRIE : exercices 1
Déterminer la capacité thermique C du calorimètre et de ses accessoires. Données: Chaleur massique de l'eau : ce= 4185 J.kg-1.K-1 ; Masse volumique de l
 Calorimétrie Quelques formules …. Lors dun changement détat la
Calorimétrie Quelques formules …. Lors dun changement détat la
La quantité de chaleur absorbée par un corps de masse M au cours de sa fusion est donnée par la relation : Q = M.Lf. Q en J M en kg et Lf en J/kg.
 Relation fondamentale de la calorimétrie
Relation fondamentale de la calorimétrie
Page 1. 1. Page 2. 2. Page 3. 3. Page 4. 4.
 COURS DE THERMODYNAMIQUE
COURS DE THERMODYNAMIQUE
Ce cours de thermodynamique est destiné aux étudiants de 1 Les mesures calorimétriques permettent de déterminer les quantités de chaleurs spécifiques.
 CALORIMETRIE INTRODUCTION AUX METHODES D’ANALYSE THERMIQUE
CALORIMETRIE INTRODUCTION AUX METHODES D’ANALYSE THERMIQUE
L’ analyse thermique désigne toute technique de mesures où le changement d’ une propriété d’ un échantillon est lié à une variation de température imposée Dans la pratique on peut distinguer : les cas où est enregistrée une grandeur suite à une évolution imposée de la température au cours du temps (échelons rampes
 Chapitre II : Thermométrie Chaleur - Calorimétrie Travail de
Chapitre II : Thermométrie Chaleur - Calorimétrie Travail de
La chaleur molaire notée Cp c’est la quantité d'énergie à apporter par échange thermique pour élever d'un (1) kelvin la température d’une mole d'une substance Exemple : chauffage de 20°C à 80°C de m = 2 kg d’eau à pression constante 2 10 3 * 4 185 80 20 502 2 kj 120 kcal
Un calorimètre contient une masse m1 = 250g d'eau. La température initiale de l'ensemble est 1 =18°C. On ajoute une masse m2 = 300g d'eau à la
température 2 = 80°C.1. Quelle serait la température d'équilibre thermique e de l'ensemble si la capacité thermique du calorimètre et de ses accessoires était négligeable
2. On mesure en fait une température d'équilibre thermique e=50°C. Déterminer la capacité thermique C du calorimètre et de ses accessoires.
Données: Chaleur massique de l'eau : ce= 4185 J.kg-1.K-1 ; Masse volumique de l'eau : µ=1000 kg.m-3.
: Détermination de la capacité thermique d'un calorimètre:1. Le système froid S1: 1 = 18°C, m1 = 250 g à e = ?
Ce système S1 va capter une quantité de chaleur Q1 > 0. Quantité de chaleur captée par l'eau froide: Q1=m1.ce.(e - 1). Système 2 chaud S2 : {eau chaude} 2 = 80 °C ; m2= 300 g. Température finale : e = ? Ce système S2 va perdre une quantité de chaleur Q2 < 0. Quantité de chaleur cédée par l'eau chaude: Q2=m2.ce.(e - 2 Le système {eau + calorimètre} est isolé:Q1+Q2=0 soit m1.ce.(e - 1) +m2.ce.(e - 2) =
On tire e : e = m1.1 + m2.2 A.N. : e = 250.10-3.18 + 300.10-3.80 = 51,8°C e=51,8°C m1 + m2 250.10-3 + 300.10-32. Le système froid S1: {}. Q1 > 0.
Quantité de chaleur captée par l'eau froide et le calorimètre: Q1= (m1.ce + C).(e - 1). Système 2 chaud S2 : {eau chaude} 2 = 80 °C ; m2= 300 g. Température finale : e = 50°C Ce système S2 va perdre une quantité de chaleur Q2 < 0. Quantité de chaleur cédée par l'eau chaude: Q2=m2.ce.(e - 2). Le système {eau + calorimètre} est isolé: Q1+Q2=0 (m1.ce + C).(e - 1) +m2.ce.(e - 2) = 0 C.(e - 1) = -m1.ce.(e - 1) -m2.ce.(e - 2) = 0 On tire C : C = - m1.ce.(e - 1) - m2.ce.(e - 2) = m1.ce.(e - 1) + m2.ce.(e - 2) e - 1 1 - e A.N. : C = 250.10-3.4185.(50-18) + 300.10-3.4185.(50-80) = 130,8 J.K-1 C=130,8 J.K-1 18-50EXERCICE 2 : Bain à 37°C:
On désire obtenir un bain d'eau tiède à la température = 37°C, d'un volume total V = 250 litres, en mélangeant un volume V1 d'eau chaude à la
température initiale 1 =70°C et un volume V2 d'eau froide à la température initiale 2 =15°C.
Déterminer V1 et V2 en supposant négligeables toutes les fuites thermiques lors du mélange.Données: Chaleur massique de l'eau : ce = 4185 J.kg-1.K-1 ; Masse volumique de l'eau : µ = 1000 kg.m-3.
: Bain à 37°C: Le système chaud S1: 1 = 70 °C ; V1 = ?. Température finale : e = 50°C. Q1 < 0. Soit Q1 la quantité de chaleur cédée par l'eau chaude: Q1=m1.ce.( - 1).Système 2 froid S2 : {eau froide} 2 = 15 °C ; V2 = ?. Température finale : e = 50°C. Q2 > 0.
Soit Q2 la quantité de chaleur captée par l'eau froide: Q2=m2.ce.( - 2).Le système {eau} est isolé : Q1+Q2=0
m1.ce.( - 1) + m2.ce.( - 2) = 0 soit : m1.( - 1) + m2.( - 2) = 0Application numérique:
m1.(37 - 70m2.(37 - 15 soit -33.m122.m2 = 0 soit -33.V122.V2 = 0 D'autre part, le volume total du bain est V = 250L => V1 + V 2 = 250 D'où le système: -33.V122.V2 = 0 (1)V1 + V 2 = 250 (2)
Il faut donc 150L d'eau froide à 15°C et 100L d'eau chaude à 70°C pour obtenir 250L d'un bain à 37°C
CORRECTION DES EXERCICES DE CALORIMETRIE (exercices 3 et 4)EXERCICE 3 : Chaleur massique du plomb:
On sort un bloc de plomb de masse m1=280g d'une étuve à la température 198°C. On le plonge dans un calorimètre
de capacité thermique C=209J.K-1 contenant une masse m2=350g d'eau. L'ensemble est à la température initiale
216°C. On mesure la température d'équilibre thermique e17,7°C.
Déterminer la chaleur massique du plomb.
Données: Chaleur massique de l'eau : ce = 4185 J.kg-1.K-1 ; Masse volumique de l'eau : µ = 1000 kg.m-3.
Chaleur massique du plomb:
Le système chaud S1: {bloc de plomb}. 1 = 98 °C ; m1 = 280 g. Température finale : e = 17,7°C. cPb = ? ; Q1 < 0.
Soit Q1 la quantité de chaleur cédée par le bloc de plomb: Q1=m1.cPb.(e - 1).Système 2 froid S2 : {calorimètre + eau froide} 2 = 16 °C ; m2eau = 350 g. Température finale : e = 17,7°C. Q2 > 0.
Soit Q2 la quantité de chaleur captée par l'eau froide et le calorimètre: Q2=(m2.ce + C).(e - 2).
Le système {eau + calorimètre + plomb} est isolé: Q1+Q2=0 m1.cPb.(e - 1) + (m2.ce + C).(e - 2) = 0 On tire cPb. m1.cPb.(e - 1) = - (m2.ce + C).(e - 2) cPb = (m2.ce + C).(e - 2) A.N. : cP = (350.10-3.4185 + 209).(17,7 - 16) = 126,5 J.kg-1.K-1 m1.(1 - e) 280.10-3.(98 - 17,7) cPb=126,5 J.kg-1.K-1 EXERCICE 4 : Bloc de fer plongé dans l'eau:Un morceau de fer de masse m1 = 500 g est sorti d'un congélateur à la température 1 - 30°C.
Il est plongé dans un calorimètre, de capacité thermique négligeable, contenant une masse m2 = 200g d'eau à la
température initiale 2 °C.Déterminer l'état final d'équilibre du système (température finale, masse des différents corps présents dans le calorimètre).
Données:
Chaleur massique de l'eau : ce = 4185 J.kg-1.K-1
Chaleur massique de la glace: cg = 2090 J.kg-1.K-1Chaleur massique du fer: cFe = 460 J.kg-1.K-1
Chaleur latente de fusion de la glace: Lf = 3,34.105 J.kg-1Bloc de fer plongé dans l'eau:
Système 1 froid S1 : {bloc de fer}. 1 = -30°C ; m1 = 500 g. Température finale : e = ? (on considère f = e = 0°C)
Soit Q1 l'énergie captée par le bloc de fer pour passer de -30°C à 0°C: Q1=m1.cFe.(f - i) = m1.cFe (0 - 1).
Q1=500.10-3.460.(0-(-30)) = 6900 J.
Système 2 chaud S2 : {calorimètre + eau à 4°C} : 2 = 4 °C ; m2eau = 200 g. Température finale : e = ?
(on considère f = e = 0°C)Soit Q2 l'énergie cédée par l'eau pour passer de 4°C à °0 C : Q2= m2.ce.(f - i) = m2.ce.(0 - 2) =
Q2= 200.10-3.4185.(0-4) = -3348 J.
Ici |Q1| >| Q2|. Une partie de l'eau va donc geler : solidification de Définition de la chaleur latente de fusion Lf : Chaleur latente: quantité de chaleur nécessaire pour faire passer : même relation, mais signe négatif. Le système {eau solide et liquide + bloc de fer} est isolé: Q+Q1+Q2 = 0 soit Q=-Q1-Q2 A.N. : Q=-6900+3348 = -3552 J.Soit m la masse d'eau gelée.
Q = - m.Lf m = -Q = -(-3552) = 10,6.10-3 kg (10,6 g)Lf 3,34.105
Le système est donc composé de : m1 = 500 g de fer à la température de 0°C. m = 10,6 g de glace à la température de 0°C. -10,6=189,4g d'eau à la température de 0°C.EXERCICES DE CALORIMETRIE. Exercice 5
EXERCICE 5 : Fusion d'un glaçon: (version 1)Un calorimètre de capacité thermique C=150J.K-1 contient une masse m1=200g d'eau à la température initiale 1=70°C.
On y place un glaçon de masse m2=80g sortant du congélateur à la température 2=-23°C.Déterminer l'état final d'équilibre du système (température finale, masse des différents corps présents dans le
calorimètre).Données:
Chaleur massique de l'eau : ce = 4185 J.kg-1.K-1
Chaleur massique de la glace: cg = 2090 J.kg-1.K-1 Chaleur latente de fusion de la glace: Lf =3 ,34.105 J.kg-1. On suppose que le glaçon fond dans sa totalité.Soit Q1 O
pQHUJLH ŃpGpH SMU O diminue) : Système 1 chaud : {eau chaude dans le calorimètre} 1 = 70 °C ; m1= 200 g. chaleur Q11 = 70 °Cà e = ? °C
Q1=(m1.ce + C).(e - 1).
Soit Q2 l'énergie captée par le bloc de glace :Le système froid S2: {glaçons de masse m2}.
*La température de la glace va passer de 2 = - 23 °C à 0°C, *puis la glace va fondre à 0°C, e = ?. Ce système S2 va capter une quantité de chaleur Q2 > 0 :U2 = Q2 = m2.cg (0-2) + m2.Lf + m2.ce.(e - 0)
Le système {eau + glace + calorimètre} est isolé: Q1+Q2=0 soitSi le système est isolé (c'est-à-
U = cte et donc : U = 0 soit Q1 + Q2 = 0
Q1+Q2=0
(m1.ce + C).(e - 1) + m2.cg.(0 - 2) + m2.Lf + m2.ce.(e - 0) = 0 soit m1.ce.e - m1.ce.1 + C.e - C.1- m2.cg.2 + m2.Lf + m2.ce.e = 0. soit (m1.ce + m2.ce + C).e = (m1.ce + C).1 + m2.cg.2 - m2.Lf = 0 e = (m1.ce+C).1+m2.cg.2 - m2.Lf m1.ce + m2.ce + C A.N.: e =(200.10-3.4185+150).70+80.10-3.2090.(-23)-80.10-3.3,34.105200.10-3.4185 + 80.10-3.4185 + 150
e=29,15°Cquotesdbs_dbs50.pdfusesText_50[PDF] calorimétrie exercices
[PDF] calorimétrie exercices corrigés pdf
[PDF] calorimétrie formule
[PDF] calorimétrie tp chimie
[PDF] calorimétrie tp corrigé
[PDF] calque pixlr
[PDF] cambios fisiologicos en el embarazo pdf 2015
[PDF] cambios fisiologicos en el embarazo pdf elsevier
[PDF] cambios fisiologicos en el embarazo pdf medigraphic
[PDF] cambios fisiologicos en el embarazo pdf williams
[PDF] cambios fisiologicos en el embarazo por sistemas
[PDF] cambios fisiologicos en el embarazo por trimestre
[PDF] cambios fisiologicos en el embarazo slideshare
[PDF] cambridge flyers past exam papers
