 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
Grenoble Sciences est un centre de conseil expertise et labellisation de l'ensei- gnement supérieur français. Il expertise les projets scientifiques des
 Electrochimie des solides
Electrochimie des solides
chimie du solide (Journal of Materials Science Journal. Page 7. VI. électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours of the European ...
 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices. Cinétique électrochimique – Courbes intensité-potentiel. Applications directes du cours. Potentiels standard : Couple Al3+ Al. ⁄. Zn2+ Zn. ⁄. Fe2+ Fe.
 ÉLECTROCHIMIE
ÉLECTROCHIMIE
Electrochimie des solides. Exercices corrigés avec rappels de cours (A.Hammou & S.Georges) • Elec- trochimie des solides (C. Déportes et al.) • Chimie. Le
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours. Exercice 1.9 - Etude cristallochimique et thermodynamique du dioxyde de thorium ThO2
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
En déduire la variation d'entropie créée au cours du chauffage. Exercice II. A. 3. Un kilogramme de glace sorti du réfrigérateur à –5°C est transporté dans.
 RÉPUBLIQUE ALGÉRIENNE DÉMOCRATIQUE ET POPULAIRE
RÉPUBLIQUE ALGÉRIENNE DÉMOCRATIQUE ET POPULAIRE
On appelle activité ( ) la concentration corrigée c'est une concentration apparente effective à laquelle Cours d'Electrochimie. 3ème Licence Génie des ...
 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
Chimie analytique. Electrochimie. Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate de.
 Untitled
Untitled
Epreuve d'Electrochimie (Session 22 novembre 2006). Durée : 1 heure. Exercice 1 : Calculer la force ionique de l'eau de mer dont la composition est : Composé.
 CHIMIE DE COORDINATION ET REACTIVITE REDOX DE L
CHIMIE DE COORDINATION ET REACTIVITE REDOX DE L
Au cours de ce travail de thèse la réactivité redox de l'uranium trivalent et tétravalent ont été étudiés ainsi que la chimie de coordination de l'uranyle
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
ELECTROCHIMIE DES SOLIDES. EXERCICES CORRIGÉS AVEC RAPPELS DE COURS J.M. BASSAT Directeur de recherche au CNRS
 Electrochimie des solides
Electrochimie des solides
Electrochimie des solides. Exercices corrigés avec rappels de cours. Cet ouvrage labellisé par Grenoble Sciences
 ÉLECTROCHIMIE
ÉLECTROCHIMIE
Electrochimie des solides. Exercices corrigés avec rappels de cours (A.Hammou & S.Georges) • Elec- trochimie des solides (C. Déportes et al.) • Chimie.
 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
Chimie analytique. Electrochimie. Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours. Exercice 1.9 - Etude cristallochimique et thermodynamique du dioxyde de thorium ThO2.
 li(jiI Nt)SUP
li(jiI Nt)SUP
LES FIIIÈRES TECHIIOI.OG I OUES dES EIISEIG 1{EM ENTS SUPÉRIEURS. CHIMIE. Electrochimie. Résumés de cours et exercices corrigés. Paul-Louis FABRE.
 Notions élémentaires sur les cellules électrochimiques
Notions élémentaires sur les cellules électrochimiques
Cours et exercices. G. BARRAL générateur électrochimique cellule d'électrolyse ... 1.6- Quantité maximale d'électricité récupérable au cours.
 Électrochimie
Électrochimie
2.4 Expression du potentiel d'électrode à l'équilibre électrochimique : sentés et parfois en approfondir certains une série d'exercices corrigés est ...
 Électrochimie
Électrochimie
3 Mesures électrochimiques et électrodes 1 Potentiel électrochimique ... La formulation du second principe vue dans le cours de thermodynamiquea doit ...
 Électrochimie
Électrochimie
sont à réserver pour les exercices. J'ai traité en cours l'exemple de la pile Daniell qui peut tout à fait être réutilisé comme support à cette question de
 [PDF] Electrochimie des solides - Exercices corrigés avec rappels de cours
[PDF] Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides Exercices corrigés avec rappels de cours Cet ouvrage labellisé par Grenoble Sciences est un des titres du secteur Sciences
 [PDF] Electrochimie Exercice n° 1 :
[PDF] Electrochimie Exercice n° 1 :
Chimie analytique Electrochimie Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate
 Electrochimie Exercices Corrigés PDF S5 Gratuit - eBoikcom
Electrochimie Exercices Corrigés PDF S5 Gratuit - eBoikcom
Télécharger gratuitement TD QCM exercices et examens corrigés de Electrochimie PDF S5 Bachelor / Licence Chimie SMC (3ème année L3) Pour les cours
 Eléctrochimie SMC5 Cours // Td Et Exercices // Résumés // Examens
Eléctrochimie SMC5 Cours // Td Et Exercices // Résumés // Examens
30 sept 2019 · Eléctrochimie (SMC5) Cours // Td Et Exercices // Résumés // Examens cour Electrochimie SMC5 S5 PDF MODULE D'ELECTROCHIMIE Cours+TD SMC5
 [PDF] Chimie-électrochimie-résumés-de-cours-et-exercices-corrigéspdf
[PDF] Chimie-électrochimie-résumés-de-cours-et-exercices-corrigéspdf
OG I OUES dES EIISEIG 1{EM ENTS SUPÉRIEURS CHIMIE Electrochimie Résumés de cours et exercices corrigés Paul-Louis FABRE 1 - Rappels de thermochimie
 Cours et exercices delectrochimie et applications smc s5 pdf
Cours et exercices delectrochimie et applications smc s5 pdf
29 août 2017 · Telecharger Cours et exercices d'electrochimie et applications smc s5 pdf faculté des science chimie filliére chimique semistre s5
 Electrochimie - coursexercicesexamens - Univdocs
Electrochimie - coursexercicesexamens - Univdocs
Telecharger des cours et examens corrigesexercices corrigestravaux dirigés pdf resumedes polycopie documents de module Electrochimie
 [PDF] Electrochimie des solides - Numilog
[PDF] Electrochimie des solides - Numilog
Electrochimie des solides Exercices corrigés avec rappels de cours Cet ouvrage labellisé par Grenoble Sciences est un des titres du secteur Sciences
 electrochimie cours et exercices corrigés pdf - PDFprof
electrochimie cours et exercices corrigés pdf - PDFprof
Cours de chimie de seconde année P 1 étique des réactions potentiel LA VITESSE DE LA REACTION ELECTROCHIMIQUE ET LA RELATION AVEC L'INTENSITE I [PDF]
 [PDF] Exercices : 20 -Électrochimie
[PDF] Exercices : 20 -Électrochimie
Exercices : 20 -Électrochimie A Thermodynamique de l'oxydo-réduction 1 Pile `a combustible On réalise la pile `a combustible représentée par :
2 ème année pharmacie TD N°8
Chimie analytique
Electrochimie
Exercice n° 1 :
On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 cuivre dans laquelle plonge une plaque de cuivre ; un autre bécher renfermant 100 cm3 molaire de sulfate de zinc dans la quelle plonge une lame de zinc.1) On intercale un milliampèremètre entre deux fils conducteurs reliant les deux plaques de cuivre et
zinc. Que se passe-t-il ?2) -t-il ?
Remarque pour cette question :
- Indiquer son sens.- Préciser la nature et le sens du déplacement des porteurs de charges assurant le courant électrique
dans les différents éléments de la chaine ; mettre en évidence la continuité du courant électrique.
- Indiquer les pôles de la pile.3) Calculer la force électromotrice de la pile, en précisant nettement sa définition.
E° (Cu2+/Cu) = 0,337 V ; E° (Zn2+/Zn) = -0,763 VExercice n° 2 :
Une cellule conductimétrique est constituée de deux électrodes de surface S = 2 cm2 distance
L = 1,5 cm et soumises à une tension continue U = 1,2 V. La cellule est immergée dans une solution ionique
ersant la cellule mesure : I = 7 mA.1) Exprimer et calculer la conductance et la résistance de la cellule (unité Siemens).
2) Exprimer et calculer en cm-1 et en m-1 la constante K de la cellule
3) Exprimer et calculer la conductivité de la solution en unité S.I.
4) La solution ionique a une concentration C = 5,0 mmol.L-1. Exprimer la concentration en (mol/m3)
et calculer la conductivité molaire de la solution.Exercice n° 3 :
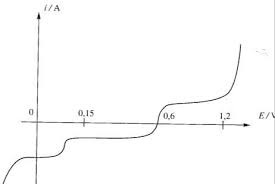
Le document ci-dessous fournit I=
cuivre CuSO4 à 0,1 mol/l.1) Préciser les réactions électrochimiques mises en jeu.
Données : SO4 -2 s électroactif.
2) Commenter la position des courbes pour I= 0.
- 0, - Șa Șc .Données : E° (Cu2+/Cu) = 0,34 V
Exercice n° 4 :
On référence au calomel(ECS) suivante à 25°C 1) 2) Une lame de platine plongeant dans une solution de fer (II) et fer (III) De concentration molaire identique égale à 0,1 mol/l. Les deux électrodes sont reliés par un pont ionique .on néglige la ddp De la jonction Hg(l) /Hg2Cl2 / KCl (1mol/l) // Fe2+, Fe3+ (0,1mol/l) /Pt a- Faire le schéma de la pileb- On place entre les deux pôles un voltmètre de très grande résistance. Calculer la valeur lue sur le
voltmètre.Données : Potentiels standard à pH = 0
E° (Hg22+/ Hg) = 0,790 V ; E° (Fe3+/ Fe2+) = 0,770 V ; Ks (Hg2Cl2) = 6, 4. 10-18Correction dexercice 1 :
: siège des réactions redox spontanées (une pile transforme une réaction chimique en énergie électrique) : (-) Red1/ Ox1 // Ox2 / Red 2 (+)1) Le circuit électrique est ouvert donc rien ne se passe.
2) Le circuit électrique est fermé par conduction ionique une réaction redox :
Réduction cathodique (pôle positif) :Cu2+ + 2 e- G Cu -Le passage des à travers le fil métallique vers la cathode : le sens du courant e- : c'est-à-. - Le passage des ions à travers le pont salin : les cations sont attirés par la cathode - Le pôle négatif ; le pôle positif est la cathode. : (-) Zn / Zn2+ // Cu2+ / Cu (+)3) Calcule de la force électromotrice (f.e.m) : ȴE = E (Cu2+/Cu) - E (Zn2+/Zn)
E (Cu2+/Cu) = E° (Cu2+/Cu) + 0,059/2 +log [Cu2+ ] = 0,337+ 0,059/2 + log 1= 0,3665 V E (Zn2+/Zn) = E° (Zn2+/Zn) + 0,059/2 +log [Zn2+] = -0,763+ 0,059/2 + log 1= -0 ,7335 V f.e.m = + 1,1 VCorrection dexercice 2 :
1) Exprimer et calculer la conductance et la résistance de la cellule.
G = I/U = 7x10-3/1, 2 = 5, 8x10-3 S (= 5, 8 m S); R = U/I = 1/C = 1,7x102 ȍ (ohm)2) Exprimer et calculer en cm-1 et en m-1 la constante K de la cellule
K = L/S = 1,5 / 2,0 = 0,75 cm-1 = 75 m-1
3) Exprimer et calculer la conductivité(Ȗ) de la solution en unité S.I.
G= Ȗ . S/L ; Ȗ = L/S .G = K.G = 75. 5,8 x10-3 = 0,435 S.m-14) La solution ionique a une concentration C = 5 mmol.L-1. Exprimer la concentration en mol/m3.
Et calculer la conductivité molaire(Ȝ) de la solution (résultat en unité S.m2.mol-1)C = 5 x10-3 mol/L= 5 x10-3
ܵ = Ȝ . C ; Ȝ = ܵ
Correction dexercice 3 :
produit une oxydation, or les seules espèces pouvant être oxydées dans la solution sont Cu et SO42-,
- La cathode correspond au courant compté négativement (partie inférieure de la courbe) à la cathode
se produit une réduction, or les seules espèces pouvant être réduites dans la solution sont Cu2+ et
SO42--, or SO42- est électro-inactif seul Cu2+ est réduit : Cu2+ + 2 e- G Cu cathode (I < 0)
2- Pour I = 0 , on retrouve le potentiel de Nernst du couple Cu2+/Cu : Cu2+ + 2 e- G Cu (S)
El = E° + 0,06/2 log [Cu2+] = 0,34 + 0,03 log (10-1) = 0,31 V. Graphiquement on lit El = 0,31 V pour I = 0, ce qui cohérent. On notant El le potentiel de Nernst du couple ; on a : - Șc = E(I c) - El < 0 surtension cathodique. (I c <0) est rapide car la courbe anodique varie rapidement avec le potentiel en revanche la réduction est lente.Correction dexercice 4 :
1- Le :Hg2Cl2 + 2 e- G 2 Hg + 2 Cl- (1)
Elle est la combinaison des deux équations suivantes :Hg22+ + 2 e- G 2 Hg ; Hg2Cl2 G Hg22+ + 2 Cl- : KS = [Hg22+]. [Cl-] 2
E (Hg22+/ Hg) = E (Hg2Cl2/ Hg) = E (Hg(1)/ Hg(0))La relation de :
E (ECS/ESH) = E° (Hg2Cl2/ Hg) + 0,059/2 log 1/ [Cl-] 2 = E° (Hg22+/ Hg) + 0, 059/2 log [Hg22+] E (ECS) = E° (Hg22+/ Hg) + 0,059/2 log Ks /[ Cl- ] 2On peut conclure à partir des réactions (1) et (2) : E (Hg2Cl2/ Hg) = E° (Hg22+/ Hg) + 0,06/2 log Ks
E° (Hg2Cl2/ Hg) = 0,79 +(0,059/2) log(6,4.10-18) = 0,282 V. (1) ȮE(ECS/ESH) = 0,282 + 0,059/2 log 1/1 = 0,282 V ( KCl =1M ) Șa nc s Cl- pour une température fixée.2.a) Figure: schéma de la pile
a) Le po3+/Fe2+ : ȴE = E (Fe3+/Fe2+) / calomel = E ( Fe3+/Fe2+)/ESH E(ECS/ESH) E (Fe3+/Fe2+)/ESH = E°( Fe3+/Fe2+) + 0,059log [Fe3+]/ [Fe2+] = 0,77 V.E (ECS/ESH) = 0,282 V.
ȴE = 0,49 V.
quotesdbs_dbs13.pdfusesText_19[PDF] examen corrigé electrochimie
[PDF] cours electrochimie s5 pdf
[PDF] electrocinetique exercices corrigés gratuit
[PDF] electrostatique et electrocinétique rappel de cours et exercices corrigés de physique
[PDF] electrocinétique mpsi cours
[PDF] resumé d'un cours d'électrocinétique
[PDF] electrocinetique mpsi pdf
[PDF] electrocinetique exercices corrigés pdf s2
[PDF] électrode de travail électrochimie
[PDF] électrode de référence ag/agcl
[PDF] potentiel d'électrode définition
[PDF] pont salin
[PDF] potentiel électrode de référence ag/agcl
[PDF] electrode 1ere espece
