 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
Grenoble Sciences est un centre de conseil expertise et labellisation de l'ensei- gnement supérieur français. Il expertise les projets scientifiques des
 Electrochimie des solides
Electrochimie des solides
chimie du solide (Journal of Materials Science Journal. Page 7. VI. électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours of the European ...
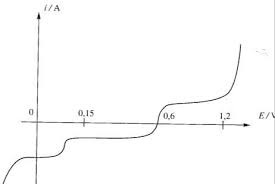 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices. Cinétique électrochimique – Courbes intensité-potentiel. Applications directes du cours. Potentiels standard : Couple Al3+ Al. ⁄. Zn2+ Zn. ⁄. Fe2+ Fe.
 ÉLECTROCHIMIE
ÉLECTROCHIMIE
Electrochimie des solides. Exercices corrigés avec rappels de cours (A.Hammou & S.Georges) • Elec- trochimie des solides (C. Déportes et al.) • Chimie. Le
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours. Exercice 1.9 - Etude cristallochimique et thermodynamique du dioxyde de thorium ThO2
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
En déduire la variation d'entropie créée au cours du chauffage. Exercice II. A. 3. Un kilogramme de glace sorti du réfrigérateur à –5°C est transporté dans.
 RÉPUBLIQUE ALGÉRIENNE DÉMOCRATIQUE ET POPULAIRE
RÉPUBLIQUE ALGÉRIENNE DÉMOCRATIQUE ET POPULAIRE
On appelle activité ( ) la concentration corrigée c'est une concentration apparente effective à laquelle Cours d'Electrochimie. 3ème Licence Génie des ...
 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
Chimie analytique. Electrochimie. Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate de.
 Untitled
Untitled
Epreuve d'Electrochimie (Session 22 novembre 2006). Durée : 1 heure. Exercice 1 : Calculer la force ionique de l'eau de mer dont la composition est : Composé.
 CHIMIE DE COORDINATION ET REACTIVITE REDOX DE L
CHIMIE DE COORDINATION ET REACTIVITE REDOX DE L
Au cours de ce travail de thèse la réactivité redox de l'uranium trivalent et tétravalent ont été étudiés ainsi que la chimie de coordination de l'uranyle
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
ELECTROCHIMIE DES SOLIDES. EXERCICES CORRIGÉS AVEC RAPPELS DE COURS J.M. BASSAT Directeur de recherche au CNRS
 Electrochimie des solides
Electrochimie des solides
Electrochimie des solides. Exercices corrigés avec rappels de cours. Cet ouvrage labellisé par Grenoble Sciences
 ÉLECTROCHIMIE
ÉLECTROCHIMIE
Electrochimie des solides. Exercices corrigés avec rappels de cours (A.Hammou & S.Georges) • Elec- trochimie des solides (C. Déportes et al.) • Chimie.
 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
Chimie analytique. Electrochimie. Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours. Exercice 1.9 - Etude cristallochimique et thermodynamique du dioxyde de thorium ThO2.
 li(jiI Nt)SUP
li(jiI Nt)SUP
LES FIIIÈRES TECHIIOI.OG I OUES dES EIISEIG 1{EM ENTS SUPÉRIEURS. CHIMIE. Electrochimie. Résumés de cours et exercices corrigés. Paul-Louis FABRE.
 Notions élémentaires sur les cellules électrochimiques
Notions élémentaires sur les cellules électrochimiques
Cours et exercices. G. BARRAL générateur électrochimique cellule d'électrolyse ... 1.6- Quantité maximale d'électricité récupérable au cours.
 Électrochimie
Électrochimie
2.4 Expression du potentiel d'électrode à l'équilibre électrochimique : sentés et parfois en approfondir certains une série d'exercices corrigés est ...
 Électrochimie
Électrochimie
3 Mesures électrochimiques et électrodes 1 Potentiel électrochimique ... La formulation du second principe vue dans le cours de thermodynamiquea doit ...
 Électrochimie
Électrochimie
sont à réserver pour les exercices. J'ai traité en cours l'exemple de la pile Daniell qui peut tout à fait être réutilisé comme support à cette question de
 [PDF] Electrochimie des solides - Exercices corrigés avec rappels de cours
[PDF] Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides Exercices corrigés avec rappels de cours Cet ouvrage labellisé par Grenoble Sciences est un des titres du secteur Sciences
 [PDF] Electrochimie Exercice n° 1 :
[PDF] Electrochimie Exercice n° 1 :
Chimie analytique Electrochimie Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate
 Electrochimie Exercices Corrigés PDF S5 Gratuit - eBoikcom
Electrochimie Exercices Corrigés PDF S5 Gratuit - eBoikcom
Télécharger gratuitement TD QCM exercices et examens corrigés de Electrochimie PDF S5 Bachelor / Licence Chimie SMC (3ème année L3) Pour les cours
 Eléctrochimie SMC5 Cours // Td Et Exercices // Résumés // Examens
Eléctrochimie SMC5 Cours // Td Et Exercices // Résumés // Examens
30 sept 2019 · Eléctrochimie (SMC5) Cours // Td Et Exercices // Résumés // Examens cour Electrochimie SMC5 S5 PDF MODULE D'ELECTROCHIMIE Cours+TD SMC5
 [PDF] Chimie-électrochimie-résumés-de-cours-et-exercices-corrigéspdf
[PDF] Chimie-électrochimie-résumés-de-cours-et-exercices-corrigéspdf
OG I OUES dES EIISEIG 1{EM ENTS SUPÉRIEURS CHIMIE Electrochimie Résumés de cours et exercices corrigés Paul-Louis FABRE 1 - Rappels de thermochimie
 Cours et exercices delectrochimie et applications smc s5 pdf
Cours et exercices delectrochimie et applications smc s5 pdf
29 août 2017 · Telecharger Cours et exercices d'electrochimie et applications smc s5 pdf faculté des science chimie filliére chimique semistre s5
 Electrochimie - coursexercicesexamens - Univdocs
Electrochimie - coursexercicesexamens - Univdocs
Telecharger des cours et examens corrigesexercices corrigestravaux dirigés pdf resumedes polycopie documents de module Electrochimie
 [PDF] Electrochimie des solides - Numilog
[PDF] Electrochimie des solides - Numilog
Electrochimie des solides Exercices corrigés avec rappels de cours Cet ouvrage labellisé par Grenoble Sciences est un des titres du secteur Sciences
 electrochimie cours et exercices corrigés pdf - PDFprof
electrochimie cours et exercices corrigés pdf - PDFprof
Cours de chimie de seconde année P 1 étique des réactions potentiel LA VITESSE DE LA REACTION ELECTROCHIMIQUE ET LA RELATION AVEC L'INTENSITE I [PDF]
 [PDF] Exercices : 20 -Électrochimie
[PDF] Exercices : 20 -Électrochimie
Exercices : 20 -Électrochimie A Thermodynamique de l'oxydo-réduction 1 Pile `a combustible On réalise la pile `a combustible représentée par :
Martin VÉROT
Électrochimie
Thermodynamique, Cinétique, Piles, Accumulateurs, Diagrammes, Titrages option physique à l"ENS de Lyon. Cependant, il convient également aux personnes préparant les concours pour l"enseignement supérieur(CAPES de physique-chimie) et plus généralementà tous les étudiants en sciences physiques, aussi bien à l"université qu"en classe préparatoire.
Ces notes sont mises à disposition selon les termes de la Licence Creative Commons Attri- bution - Pas d"Utilisation Commerciale, version 3.0 non transposé. Si vous voyez des erreurs ou si vous avez des réflexions sur ces notes, vous pouvez m"envoyez un e-mail à martin.verot#ens- lyon.fr avec un @ à la place du #. J"y répondrai avec plaisir.Je tiens à remercier Raymond Grüber qui m"a transmis ses propres notes suite à son départ.
Table des matières
I Notions de base
81 Degré d"oxydation
82 Notion de couple/demi-couple réd-ox
92.1 Conservation de la charge et combinaison de demi-équations rédox
103 Mesures électrochimiques et électrodes
103.1 Anodes et cathodes
113.2 Types d"électrodes
113.3 Électrodes de référence
113.3.1 L"électrode standard à hydrogène (ESH)
123.3.2 L"électrode normale à hydrogène (ENH)
123.3.3 L"électrode AgCl/Ag
123.3.4 L"électrode au calomel saturée
133.3.5 Tableau récapitulatif des électrodes
134 Ce qu"il faut retenir
15II Thermodynamique de l"oxydoréduction
1 61 Potentiel électrochimique
161.1 Condition d"évolution
171.2 Relation de Nernst
171.2.1 DémonstrationHP. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .1 7
1.2.2 Potentiel et équilibre chimique
181.2.3 Influencedelacomplexation,réactiond"oxydo-réductionetconstanted"équi-
libre 1 82 Diagrammes en électrochimie
192.1 Notion de potentiel apparent
192.2 Diagramme potentiel/pH
202.2.1 Quelques diagrammes
212.3 Diagramme de Frost
233 Coefficient d"activité en solution
253.1 Coefficient d"activité moyen
253.2 Modèle de Debye-Hückel
253.3 Lien avec la mesure de potentiel
273.4 Comportement réel de l"activitéHP. . . . . . . . . . . . . . . . . . . . . . . . . . .2 7
4 Ce qu"il faut retenir
28III Transport en solution
2 91 Nombre de transport
29Page 4
2 Modes de transport29
2.1 Migration
302.2 Diffusion
302.3 Convection
313 Phénomènes non-faradiques
313.1 Existence d"une double-couche
313.2 Modélisation
313.2.1 Modèle de Helmholtz
313.2.2 Modèle de Gouy-Chapman
323.2.3 Modèle de Stern
324 Conductimétrie
324.1 Appareillage
324.2 Conductivité molaire ionique
335 Mobilité et tension de jonction
345.1 Évolution de la conductivité molaire ionique avec la concentration
345.1.1 Pour un électrolyte fort
345.1.2 Pour un électrolyte faible
356 Ce qu"il faut retenir
37IV Cinétique électrochimique
3 81 Cinétique et mesure de courant
382 Mesure pratique : montage à trois électrodes
393 Allure globale des courbes intensité potentiel
393.1 Étapes élémentaires de la réaction
394 Contrôle par le transfert électronique
414.1 Loi de Butler-Volmer
424.2 Droites de Tafel
434.3 Phénomène de surtension
435 Contrôle par le transport de matière
445.1 Modèle de convection diffusion de Nernst
446 Potentiel mixte47
7 Courbe intensité potentiel pour l"eau
478 Titrages sous toutes leurs formes
499 Dosage du fer par le cérium
49V Applications
5 3Page 5
1 Piles, accumulateurs, électrolyseurs53
1.1 Définitions
531.2 Tension à vide/force électromotrice
531.3 Évolution en mode générateur
541.4 Évolution en mode récepteur
561.5 Rendement faradique
572 Exemples d"importance industrielle et historique
572.1 Les piles et accumulateurs
572.1.1 La pile Volta
572.1.2 La pile Daniell
582.1.3 La pile Leclanché
582.1.4 Accumulateur au plomb
582.1.5 Accumulateur lithium/ion
582.2 Électrolyses
592.2.1 Électrolyse de l"eau ou water-splitting
592.2.2 Le procédé chlore soude
592.2.3 Production d"éléments métalliques en milieu aqueux (Cu, Ni, Zn)
612.2.4 Production d"éléments métalliques en milieu non-aqueux (Al, Na)
623 Capteurs électrochimiques
633.1 Électrodes sélectives
633.1.1 Électrode de verre
644 Titrage coulométrique
645 Corrosion64
5.1 Aspect thermodynamique
655.2 Aspect cinétique
665.2.1 Comportement du fer seul
665.2.2 Corrosion en milieu aqueux
665.2.3 Métaux nobles
665.3 Aggravation de la corrosion
675.3.1 Mise en contact de deux métaux
675.3.2 Mise en contact de deux métaux et effet de la surface
675.3.3 Composition du milieu
675.4 Protection contre la corrosion
695.4.1 Courant imposé
695.4.2 Passivation
695.4.3 Anode sacrificielle
695.4.4 Revêtement
69VI Bibliographie
7 0Oraux en lien avec l"électrochimie
L C11 C apteursél ectrochimiques
Page 6
-L C19 Oxy doréductionL C21 An alysec himiqueq uantitative
L C24 D iagrammespot entiel-pH(con structionex clue)L C26 C orrosionhumi ded esmétaux
L C27 C onversionrécipr oqued"én ergieél ectriqueen én ergiech imiqueL C29 C inétiqueél ectrochimique
Page 7
Première partie
Notions de base
que la cinétique des transferts impliqués. L"intrication entre atomistique, thermodynamique,processus chimique et cinétique trouve tout son sens lors de la description des processus élec-
trochimiques.1 Degré d"oxydation
Le degré d"oxydation vise à attribuer un nombre d"électronnmoléculeà chaque atome. Ledegré d"oxydation correspond à l"opposé de l"écart entre ce nombre d"électron et celui de l"élé-
ment pur neutre :D.O.AE¡(nmolécule¡Z)(1)
oùZest le nombre atomique. Tout l"enjeu vient alors de la manière de partitionner les élec- trons. En effet, le concept même de degré d"oxydation entre en contradiction avec la notion de liaison chimique qui correspond à une mise en commun d"électrons. Il existe ainsi plusieursmanières de partitionner les électrons et aucune n"est intrinsèquement meilleure que l"autre.
Quelques règles sont tout de même communément admises (IUPAC) : L edeg réd "oxydationd "unélément en t antqu ecorps pu rsimp lev autz éro; P ourune esp ècemonoat omique,le d egréd "oxydationest ég alà l ac hargede l "ion; L aplupar tdu t emps,l "hydrogènee stau degré d "oxydation(I) et l "oxygènee stau degré (-II). Les hydrures étant un contre-exemple (degré -I pour l"hydrogène) tout comme les peroxydes (degré -I pour l"oxygène). De la définition découle la propriété suivante : X iD.O.(i)AEz(2) oùzest la charge totale de la molécule. En général, les degrés d"oxydation extrêmes correspondent au remplissage complet desélectrons de valence (degré d"oxydation le plus faible) ou à l"absence totale d"électron de va-
lence (degré d"oxydation le plus élevé). Dans le cas les cas simples et pour des exemples moléculaires, il est courant de partir dela formule de Lewis, puis chaque paire d"électrons liante est répartie de manière à attribuer
les deux électrons de la liaison à l"atome le plus électronégatif sauf si les deux atomes sont
identiques auquel cas un électron est attribué à chaque atome.D. O. -IV -III -II -I 0 I II III IV V VI VII
C CH4C CH3OH CO CH3COOH CO2
N NH3NH2NH2NH2OH N2NO NO¡2NO2NO¡3O H2O H2O2O2Cl Cl¡Cl2ClO¡ClO¡2ClO¡3ClO¡4
S H2S S8S2O2¡3* H2SO3S2O2¡6SO2¡4
Fe Fe(CO)42¡Fe2(CO)82¡Fe(CO)5FeO Fe2O3Tableau 1- Quelques degrés d"oxydation possibles avec des exemples simples pour différents
éléments. * indique que le degré d"oxydation est un degré d"oxydation moyen.Page 8
Si le degré d"oxydation est normalement entier, il peut arriver qu"il soit fractionnaire si plu- célèbre est la magnétite Fe3O4où le degré d"oxydation moyen vaut83
. En fait, il y a deux atomes de fer au degré III et un au degré II ce qui donne un degré d"oxydation moyen non entier.2 Notion de couple/demi-couple réd-ox
L"échange d"électrons implique généralement une variation de la charge et donc indirecte-
ment du degré d"oxydation.L"oxydationcorrespond généralement à :
l aper ted "unou plu sieursélect rons; l "augmentationdu degré d "oxydationau sei nde l amol écule; l eg aind "oxygèneo ula per ted "hydrogènepour u nem oléculeor ganique.Les deux premiers critères sont tout le temps vérifiés même si cela peut être difficile à prouver
mais le dernier critère est moins systématique. Laréductionest définie par opposition à l"oxydation. Cela permet ainsi de définir un demi-couple d"oxydo-réduction comme les deux entités ob-tenues par ajout/perte d"électron. L"oxydant étant l"espèce au plus haut degré d"oxydation et le
réducteur celle au plus petit degré d"oxydation. Un couple rédox correspond aux deux espèces, le couple est noté avec l"oxydant à gauche et le réducteur à droite (couples MnO ¡4/Mn2Åou Fe3Å/Fe2Å). Lademi équation rédoxcorres-pond à une équation de réaction permettant de passer de l"oxydant au réducteur par échange
d"électron tout en respectant : l ep rincipede conser vationde l ac harge; l aconser vationdes él éments. Par exemple, la demi-équation pour le couple permanganate/manganèse(II) : MnO4(aq)Å8 HÅ
(aq)Å5 e¡AEMn2Å (aq)Å4 H2O(l)(3)L"oxydant est le permanganate et le manganèse y est au degré d"oxydation VII, le réducteur du
couple est le manganèse(II) au degré ... II. Pour équilibrer la demi-équation rédox, il faut : 1.équ ilibrerl "élémentp rincipal;
2.équ ilibrerl esautr eél éments;
3. équ ilibrerl "oxygène,cela se fa itav ecl "ajoutde molé culesd "eau; 4. équ ilibrerl "hydrogène,cela se fait av ecl "ajoutd "ionshy dronium; 5.équ ilibrerl ac hargeav ecdes éle ctrons.L esélectr onsdoiv enttoujoursêtre du côté de
l"oxydant du couple.BSi le milieu est basique, il reste préférable detoujours commencer par écrire l"équation
bilan en milieu acidepuis de rajouter des ions hydroxydes de manière à ne plus avoir d"ions hydronium apparaissant dans l"équation bilan. En effet, toutes les données sont tabulées en milieu acide, donc il faut ensuite prendre explicitement en compte le fait d"être en milieu ba- sique pour obtenir des grandeurs pertinents en milieu basique.Page 9
2.1 Conservation de la charge et combinaison de demi-équations rédox
Un des grands principes physique est la conservation de la charge pour un système isolé.Ce principe implique que s"il y a perte d"un électron quelque part, il y a forcément gain ailleurs.
influencé plus ou moins directement par l"autre moitié. Comme il n"est pas possible d"étudier un couple en oxydation seul, il faut combiner deuxdemi-équation rédox. Pour cela, un couple va aller dans le sens de l"oxydation et l"autre dans le
sens de la réduction. De plus, comme le système est généralement isolé, il n"y a pas d"accumu-
lation de charge. Il faut donc faire en sorte que la combinaison des deux couples ne fasse pas apparaître explicitement de consommation ou de production nette d"électron. Pour le dosage des ions fer par le permanganate, les deux demi-couples sont les suivantset il faut les combiner de manière à ce que le nombre d"électrons échangés soit égal :
MnO4(aq)Å8 HÅ
(aq)Å5 e¡AEMn2Å (aq)Å4 H2O(l)(£1) Fe 2Å (aq)AEFe3Å (aq)Åe¡(£5) MnO4(aq)Å8 HÅ
(aq)Å5 Fe2Å (aq)AEMn2Å (aq)Å4 H2O(l)Å5 Fe3Å (aq)(4)Dans l"équation bilan globale, il n"y a plus d"électrons qui apparaisse de manière explicite.
3 Mesures électrochimiques et électrodesV
ZnCu Zn 2+ Cu 2+Pont salin
(KNO 3 )Figure 1- Mesure de potentiel pour la pile Daniell. Les contre-ions sont des ions sulfate. La mesure du potentiel, en électrochimie se fait généralement avec un système complet impliquant in-fine une mesure de différence de potentiel entre deux conducteurs métalliques identiques (figure 30).L adéfin itionmême d "électrodeest un peu subt ile,gén éralement,c "est"
le truc métallique plongé dans la solution », mais ça peut aussi être une demi-pile du système
de mesure. L"ensemble du montage est appeléchaîne électrochimique. Plutôt que d"avoir un dessin, cette chaîne est représentée par une écriture de la forme suivante :ZnjZnSO4(aq)jKNO3(aq)jCuSO4(aq)jCu (5)
ZnjZnSO4(aq)jjCuSO4(aq)jCu (6)
Page 10
Chaque barre verticale représente une interface. La deuxième forme est simplifiée avec les complète implique une différence de potentiel entre deux conducteurs métalliques de même nature. Il manque donc une partie de la chaîne de mesure. De même, en toute rigueur, il faut décrire la nature des phases séparant les solutions, ce qui n"est pas toujours simple.La mesure de la différence de potentiel permet de définir la polarité de chaque électrode (+
pour l"électrode de potentiel le plus élevé et¡pour l"autre).3.1 Anodes et cathodes
À partir du moment où un courant circule à travers le montage, cela indique qu"il y a pro- duction d"électrons à une électrode et consommation à l"autre. l "anodeest le siège de l"oxydation; l acathodeest le siège de la réduction .BIl n"y a aucun lien entre la polarité de l"électrode et le fait d"être cathode ou anode. Si le
système électrochimique est utilisé en tant que générateur (pile/accumulateur) alors la borne
+ est la cathode (siège de la réduction) alors que c"est l"anode si le système fonctionne en élec-
trolyse. (voir 1 .33.2 Types d"électrodes
Le potentiel du couple peut correspondre à différents cas. Cela a entraîné une classification
des lien entre mesure de potentiel et couple rédox. L esélectrodes de première espècecorrespondent à la mesure d"un potentiel pour un demi-couple comprenant le métal et un ion soluble (Cu2Å/Cu par exemple);
L esélectrodes de seconde espècecorrespondent à la mesure d"un potentiel pour un demi-couple comprenant le métal et une espèce peu soluble (AgCl/Ag par exemple); L esélectrodes de troisième espècecorrespondent à la mesure d"un potentiel par un métal inerte et un demi-couple d"espèces en solution (Fil de platine dans une solution avec le demi-couple Fe(CN)63¡/Fe(CN)64¡);
3.3 Électrodes de référence
absolue. Il faut alors différencier deux situations : L amesur ed "uned ifférencede poten tielen tredeux é lectrodesde poten tielarbit raire, c"est alors unetensionUqui est mesurée;l amesur ed "unediff érencede p otentielp arr apportà u neélectr odede p otentielfix é,il
est alors possible de placer les différents potentiels par rapport au potentiel du systèmede référence. Cette grandeur est généralement notéeEet il est préférable de spécifier le
système de référence choisi.Pour se ramener à la mesure de potentiel par rapport à des systèmes de références, il a fallu
trouver des systèmes qui puisse répondre aux exigences suivante : pot entielin tégralementdéfini par l ac ompositiondu systèm e,la comp ositionét antdepréférence simple à obtenir. Le plus souvent, cela correspond à des solutions saturées
en solide; u npot entieltrès peu dépen dantdu cou rant;Page 11
3.3.1 L"électrode standard à hydrogène (ESH)
C"est cette électrode qui sert de référence " absolue »,son potentiel est fixé à0,0V quelle
que soit la température. Toutes les données tabulées le sont par rapport à cette électrode.
L"acronyme pour cette électrode est ESH ou SHE (standard hydrogen electrode). Cette électrode hypothétique est définie par le potentiel du couple HÅ/H2, chaque espèce
étant dans son état standard de référence. Cela correspond donc au dihydrogène à une pres-
sion de 1 bar avec un comportement de gaz parfait et une concentration en ion hydronium de1 mol¢L¡1avec un comportement de soluté idéalaHÅAE1. Comme les comportements idéaux
ne sont pas réalistes, il faut procéder à des extrapolations des grandeurs en faisant varier les
activités du dihydrogène et des ions hydronium.Plutôt que d"utiliser cette électrode " théorique », il est plus facile d"utiliser l"électrode nor-
male à hydrogène.3.3.2 L"électrode normale à hydrogène (ENH)
L"électrode normale à hydrogène correspond à la mise en pratique la plus proche possible de l"ESH sans le comportement idéal (figure 2 ). Ainsi, la pression en dihydrogène est de 1 bar etle potentiel soit plus proche de celui de l"ESH, la concentration en acide doit être légèrement
supérieure à 1 mol¢L¡1. L"ENH est une électrode de troisième espèce.H 2 (1 bar) fil de platine platine platiné solution acide avec [H ] = 1 M verre frittéFigure 2- Électrode normale à hydrogène.3.3.3 L"électrode AgCl/Ag
L"électrode argent/chlorure d"argent est une électrode de deuxième espèce. Comme l"oxy-dant et le réducteur du couple sont peu solubles, elle est très utilisée car la construction est très
reproductible. En général, la solution de KCl est concentrée maisnon saturée(pour éviter la
Page 12
formation de chlorure solubles AgCl ¡2ou AgCl3¡). Elle est construite par électrolyse très lenteafin de créer un dépôt uniforme et adhérent de chlorure d"argent. Son potentiel est égal à 0,21
V/ESH pour une concentration en ions chlorure de 3 mol¢L¡1.orifice de remplissage fil de platine argent chlorure d"argent déposé sur l"argent verre fritté solution de KCl orifice de remplissage fil de platine mercure calomel verre fritté cristaux de KCl verre frittésolution saturée de KClFigure 3- À gauche, l"électrode argent/chlorure d"argent. à droite, l"électrode au calomel
saturée.3.3.4 L"électrode au calomel saturée
C"est également une électrode de deuxième espèce impliquant le demi-couple Hg2Cl2/Hg.
Son potentiel est égal à 0,24 V/ESH pour une solution saturée de chlorure de potassium à 25 °C.
Comme elle utilise du mercure, elle tend à être remplacée par des électrodes d"argent en lycée.
Dans tous les cas, il fautveiller à saturer l"électrode avant toute utilisation.BPour l"ECS et l"électrode d"argent, l"électrolyte étant une solution concentrée de KCl,il
faut protéger les électrodes avec une allonge remplie de nitrate de potassiumpour toute ex- périence impliquant des ions Ag Å. En effet, sans cette précaution, il peut se former du chlorured"argent dans le fritté ce qui bouche les pores! Il est également possible d"utiliser une électrode
au sulfate mercureux.3.3.5 Tableau récapitulatif des électrodes
La zoologie des électrodes de référence est bien évidemment beaucoup plus développée et
marin où l"eau de mer sert de solution de composition connue.BToutes ces électrodes doivent tout de même être en contact électrique avec le système
quotesdbs_dbs19.pdfusesText_25[PDF] examen corrigé electrochimie
[PDF] cours electrochimie s5 pdf
[PDF] electrocinetique exercices corrigés gratuit
[PDF] electrostatique et electrocinétique rappel de cours et exercices corrigés de physique
[PDF] electrocinétique mpsi cours
[PDF] resumé d'un cours d'électrocinétique
[PDF] electrocinetique mpsi pdf
[PDF] electrocinetique exercices corrigés pdf s2
[PDF] électrode de travail électrochimie
[PDF] électrode de référence ag/agcl
[PDF] potentiel d'électrode définition
[PDF] pont salin
[PDF] potentiel électrode de référence ag/agcl
[PDF] electrode 1ere espece
