 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
TD N°8. Chimie analytique. Electrochimie. Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de
 Corrigé de lexamen du 20 juin 2007 2 heures
Corrigé de lexamen du 20 juin 2007 2 heures
20 juin 2007 On se propose d'étudier une pile électrochimique dont la représentation est donnée par. Zn(s)
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides. Exercices corrigés avec rappels de cours. Cet ouvrage labellisé par Grenoble Sciences
 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Rappeler et établir la relation entre vitesse d'une réaction électrochimique et intensité du courant. 2. Quels phénomènes peuvent limiter cinétiquement une
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Corrigé. Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) Exercices de révision- Oxydo-réduction et Piles électrochimiques
 Corrigés dexercices doxydoréduction : TD Echi1-1 et TD Echi1-2
Corrigés dexercices doxydoréduction : TD Echi1-1 et TD Echi1-2
Le précipité est donc stable ou en d'autres termes le cuivre (I) a été stabilisé par précipitation. Exercice. Exercice 1 : Pile argent-zinc. [ 1
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
électrochimie des solides - eXercices corrigés avec rappels de cours énoncés des exercices. 82. Exercice 4.1 - Electrode à diffusion d'oxygène limitante
 Electrochimie des solides
Electrochimie des solides
State Ionics Ionics) et de chimie du solide (Journal of Materials Science
 Copie de chi541.xlsx
Copie de chi541.xlsx
25 Chimie générale : avec 500 exercices corrigés. Kotz John C. 541/00025/1-541/00025/4. 26 Chimie générale : Cours et exercices résolus. Didier
 Faculté de médecine 2011/
Faculté de médecine 2011/
TD n°6 : équilibre d'oxydoréduction et électrochimie. EXERCICE N°1 : Pour Corrigé type. Page 4. 4. Page 5. 5. Page 6. 6. Page 7. 7.
 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
TD N°8. Chimie analytique. Electrochimie. Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de
 Master 1Chimie physique & électrochimie 2019/2020 Corrigé
Master 1Chimie physique & électrochimie 2019/2020 Corrigé
Master 1Chimie physique & électrochimie 2019/2020. Corrigé examen. Répondre sur la feuille. Partie A (10pts) a- Répondre par vrai ou faux (chaque question
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides. Exercices corrigés avec rappels de cours. Cet ouvrage labellisé par Grenoble Sciences
 Corrigé de lexamen du 20 juin 2007 2 heures
Corrigé de lexamen du 20 juin 2007 2 heures
20 juin 2007 On se propose d'étudier une pile électrochimique dont la représentation est donnée par. Zn(s)
 Examen final de Chimie 3 Durée: 02 heures
Examen final de Chimie 3 Durée: 02 heures
On réalise une pile électrochimique afin de déterminer le produit de solubilité du sulfate d'argent Ag2SO4. Corrigé examen final chimie 03 2015-2016.
 Corrigé type Examen Energie S3 2018-2019
Corrigé type Examen Energie S3 2018-2019
A quelle catégorie appartient ce schéma : Il appartient à la catégorie Stockage électrochimique. 2018-2019. Enseignant: Ghédiri Abdelhalim. Page 2. c. Expliquer
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours. Exercice 1.9 - Etude cristallochimique et thermodynamique du dioxyde de thorium ThO2.
 EXAMEN DE CHIMIE ANALYTIQUE
EXAMEN DE CHIMIE ANALYTIQUE
UNIVERSITE A.MIRA BEJAIA. Année universitaire 2012/2013. FACULTE DE LA TECHNOLOGIE. 2ème Année ST/Génie des procédés. EXAMEN DE CHIMIE ANALYTIQUE.
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Réactions d'oxydo-réduction et piles électrochimiques. (Exercices de révision). Exercice I Corrigé. Exercice I. On considère la pile symbolisée par:.
 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Rappeler et établir la relation entre vitesse d'une réaction électrochimique et intensité du courant. 2. Quels phénomènes peuvent limiter cinétiquement une
 [PDF] Electrochimie Exercice n° 1 :
[PDF] Electrochimie Exercice n° 1 :
TD N°8 Chimie analytique Electrochimie Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de
 Electrochimie - coursexercicesexamens - Univdocs
Electrochimie - coursexercicesexamens - Univdocs
Telecharger des cours et examens corrigesexercices corrigestravaux dirigés pdf resumedes polycopie documents de module Electrochimie
 Electrochimie Exercices Corrigés PDF S5 Gratuit - eBoikcom
Electrochimie Exercices Corrigés PDF S5 Gratuit - eBoikcom
Télécharger gratuitement TD QCM exercices et examens corrigés de Electrochimie PDF S5 Bachelor / Licence Chimie SMC (3ème année L3) Pour les cours
 exercice avec solution electrochimie Examens Corriges PDF
exercice avec solution electrochimie Examens Corriges PDF
Electrochimie des solides - Exercices corrigés avec rappels de cours ARNAUD Paul - Cours et exercices corrigés de chimie physique 6ième édition
 Examen corrige exercices corrige electrochimie
Examen corrige exercices corrige electrochimie
Corrigé Exercice I Electrochimie - Concepts fondamentaux illustrés - Rackcdn com Exercices corrigés avec rappels de cours (A Hammou S
 Examen corrige examens électrochimie
Examen corrige examens électrochimie
Electrochimie ? exercices - correction 2 Réduction : Fe+3 + 1e- ? Fe+2 ?x2 Oxydation : AsO3 -3 + H2O
 Eléctrochimie SMC5 Cours // Td Et Exercices // Résumés // Examens
Eléctrochimie SMC5 Cours // Td Et Exercices // Résumés // Examens
30 sept 2019 · Eléctrochimie (SMC5) Cours // Td Et Exercices // Résumés // Examens cour Electrochimie SMC5 S5 PDF MODULE D'ELECTROCHIMIE Cours+TD SMC5
 PDF Télécharger examen corrigé electrochimie Gratuit PDF - PDFprof
PDF Télécharger examen corrigé electrochimie Gratuit PDF - PDFprof
PDF Télécharger Electrochimie - Exercices - élèves -correction -2015 examen corrigés d'électrochimie pdf exercice corrige de cinetique electrochimique
 [PDF] Corrigé de lexamen du 20 juin 2007 2 heures
[PDF] Corrigé de lexamen du 20 juin 2007 2 heures
20 jui 2007 · On se propose d'étudier une pile électrochimique dont la représentation est donnée par Zn(s)ZnSO4(aq)CuSO4(aq)Cu(s)
Quels phénomènes peuvent limiter Cinétiquement une réaction électrochimique ?
migration des ions sous l'influence du champ électrique diffusion des ions due au gradient de concentration que provoq ction à l'électrode : voir exercice du TD convection due à toute forme d'agitation (mécanique,…) e ces transferts peut être le processus cinétiquement limitant.Comment fonctionne une pile électrochimique ?
La pile électrolytique
L'application d'un courant à la réaction par le biais d'électrodes provoquera une oxydation à une électrode et une réduction à l'autre électrode. Le courant, qui est un flux d'électrons, fournit de l'énergie et fait pencher l'équilibre de la réaction d'un côté.- Science et technique des transformations réciproques de l'énergie chimique et de l'énergie électrique. L'électrochimie analyse les liens qui existent entre la chimie et l'électricité. Elle constitue la base théorique des processus d'oxydoréduction, de corrosion et d'électrolyse.
U.E. LC102
Année 2006-07
2nd Semestre
Corrigé de l'examen du 20 juin 2007
2 heures Calculatrice type " collège » autorisée - Documents interdits
Préciser votre parcours sur votre copie.
Exercice I: oxydo-réduction et précipitationI Oxydo-réduction
On se propose d'étudier une pile électrochimique dont la représentation est donnée parZn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s).
1. On dispose d'une solution de Zn2+ de concentration C = 10-1 mol.L-1, d'une solution de
Cu2+ de concentration C' = 10-1 mol.L-1 et de lames métalliques en zinc et en cuivre. a) - Écrire la demi-équation électronique de chaque couple d'oxydo-réductionZn2+(aq) + 2e- = Zn(s)
Cu2+(aq) + 2e- = Cu(s)
b) - Donner l'expression du potentiel d'électrode et calculer sa valeur pour chaque couple d'oxydo-réduction.EZn = E0Zn + RT/nF ln([Zn2+])
E Zn = -0,76 + 0,06/2 log ([Zn2+]) = -0.76 + 0,03 log(0,1) = -0,79 V.ECu = E0Cu + RT/nF ln([Cu2+])
E Cu = -0,76 + 0,06/2 log ([Cu2+]) = 0.34 + 0,03 log(0,1) = 0,31 V.2. On réalise avec ces éléments une pile.
a) - Compléter le schéma ci-dessous en précisant : la nature des électrodes et des solutions, la
polarité des électrodes, le sens de déplacement des électrons et de circulation du courant.
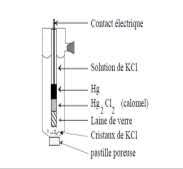
b) - Le pont salin est une solution de KCl. Quel est son rôle et comment les ions du sel KCl migrent ils lors du fonctionnement de la pile ? Le rajouter sur le schéma ci-dessus. Il assure la fermeture du circuit électrique en permettant le passage du courant par déplacement des ions.K+ migre à la cathode
Cl- migre à l'anode
c) - Préciser les réactions qui se produisent dans chaque compartiment en précisant s'il s'agit
d'une réaction d'oxydation ou de réduction.Anode : Zn(s) = Zn2+(aq) + 2e-: oxydation
Cathode : Cu2+(aq) + 2e- = Cu(s) : réduction
d) - Ecrire l'équation bilan de la réaction se produisant lors du fonctionnement de la pile.Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
e) - Calculer la force électromotrice initiale de la pile. fem de la pile : E = ECu - EZn = 0,31 + 0,79 = 1,1V
3. Préciser comment varient au cours du temps :
a) - Les concentrations C de Zn2+ et C' de Cu2+. [Zn2+] augmente, [Cu2+] diminue b) - La force électromotrice de la pile.E diminue
4. Dans le cas où la pile se décharge complètement à 25 0C :
a) - Quelle sera la force électromotrice finale de la pile ? E = 0b) - Utiliser cette valeur pour calculer la constante d'équilibre, K, associée à l'équation bilan
de la réaction se produisant lors du fonctionnement de la pile. ECu = EZn
E0Cu + RT/nF ln([Cu2+]) = E0Zn + RT/nF ln([Zn2+])
Log K = (E0Cu - E0Zn)/0,03 = 36,7
K = 1036,7
c) - Le volume de la solution dans chaque compartiment est égal à 0,5L ; Quelles seront les concentrations finales en Zn2+ et Cu2+ ? transformation quantitative ce qui implique [Zn2+]f ˜ C0 + C'0 = 0,2 M [Cu2+]f = [Zn2+]f / K= 0,2 / 1036,7 = 4.10-38M d) - Les masses molaires du zinc et du cuivre sont respectivement 65,3 et 63,5 g.mol-1. Quelle sera la variation de masse finale de l'électrode de zinc ? et de l'électrode de cuivre ?DmCu = C'0 * V * MCu = 0,1 * 0,5 * 63,5 = 3,175 g
DmZn = - C'0 * V * MZn = - 0,1 * 0,5 * 65,3 = - 3,265 gII Précipitation
On remplace la solution d'ions Zn2+ par une solution saturée de Zn(OH)2.1. Donner l'équation de réaction associée à la constante de solubilité (Ks) de l'hydroxyde de
zinc Zn(OH)2 et donner l'expression de la solubilité de Zn(OH)2 dans l'eau pure.Zn(OH)
2(s) = Zn2+(aq) + 2HO-(aq)
Ks = [Zn2+] [HO-]2 = s*(2s)2 = 4s3
s = (Ks/4)1/32. Dans ce cas, le potentiel de l'électrode de zinc par rapport à l'ENH est égal à -0,93V ; en
déduire la valeur du produit de solubilité Ks de Zn(OH)2.EZn = E0Zn + RT/nF ln([Zn2+])
EZn = E0Zn + RT/nF ln((Ks/4)1/3)
EZn = E0Zn + 0,06/2 log((Ks/4)1/3)
EZn = E0Zn + 0,01 log(Ks/4) = - 0,93 V
log(Ks/4) = (-0,93- E0Zn) / 0,01 = (-0,93+0,76)/0,01 = -17Ks = 4.10-17
3. Préciser les réactions qui ont lieu et les variations éventuelles de la force électromotrice de
la pile dessinée I.2 a) dans les cas suivants : a) - On ajoute du solide Zn(OH)2 dans le compartiment contenant la solution saturée deZn(OH)2.
Le solide tombe au fond.
Pas de variation de la fem.
b) - On ajoute du NaOH sans changement notable de volume dans le compartiment contenant la solution saturée de Zn(OH)2. On déplace l'équilibre dans le sens de la formation de Zn(OH)2 [Zn2+] diminue, EZn diminue donc fem augmente.Données à 25 °C :
Potentiels redox standard : Zn2+/Zn : -0,76 V ; Cu2+/Cu : 0,34 V V06,0FRT 3,2=Exercice II : pHmétrie
1. On dispose d'une solution (S) d'un acide AH de concentration Ca = 2.10-2 mol/L.
a) - Le pH de la solution (S) est égal à 2,9. L'acide AH est il un acide fort ou faible? Justifier
la réponse. Si AH est un acide fort, il est totalement dissocié : [H3O+] = Ca = 2.10-2 mol/L
pH = -log [H3O+] = -log(2.10-2) = 1,7Ici pH = 2,9 donc AH est un acide faible
b) - Ecrire l'équation bilan de la réaction entre l'acide AH et l'eau.. AH (aq) + H2O(l) = A-(aq) + H3O+(aq)c) - Montrer que, pour la solution (S), le coefficient de dissociation de l'acide AH défini par [][][]AHAA
a, peut s'exprimer comme []a COH+ =3a.Electroneutralité : [A-] + [OH-] = [H3O+]
pH < 7,5 donc OH- négligeable devant H3O+ : [A-] = [H3O+]Conservation de la matière : [A-] + [AH] = Ca
D'où
[][][]AHA Aa+ = [H3O+] / Ca d) En déduire, pour la solution (S), l'expression en fonction de a du rapport : [][]AH Ar- [A -] = [H3O+] = a.Ca [AH] = C a - [A-] = Ca - a.Ca = Ca(1- a) r = a.Ca / Ca(1- a) = a /(1- a) e) Calculer numériquement a et r. a = 10-2,9/0,02 = 6,3.10-2 r = a/(1-a) = 6,7.10-2 f) En déduire la valeur du pKa de l'acide AH. K a = [A-][H3O+]/[AH] = r * [H3O+]Ka = 0,0629 * 10-2,9 = 7,92.10-5
pKa = 4,1 2. a) - Quel volume de soude 1,0.10-1 mol L-1 faut-il ajouter à 100 mL de la solution (S) pour que tout l'acide AH ait réagi ? nAH = nOH
Ca * Vp = COH * VOH
VOH = Ca * Vp / COH = 2.10-2*0,1/0,1 = 2.10-2 L = 20 mL b) - Quelle est l'espèce acido-basique qui impose alors son pH ?Il s'agit de la base conjuguée A-
c) - Donner la formule permettant de calculer le pH de la solution obtenue. Quelles hypothèses doit-on vérifier pour qu'elle soit valide. Effectuer l'application numérique et vérifier les hypothèses. On prendra soin de tenir compte de la dilution. pH d'une solution de base faible [A-]0 = Ca * Vp / (Vp+VOH) = 2.10-2 * 0,1 / 0,12 = 0,0167 M pH = 7 + 0,5pKa + 0,5Log [A-]0 pH = 7 + 0.5*4,1 + 0.5Log (0,0167) = 8,2 pH > 7,5 [H3O+] négligeable devant [OH-] OK pH > pKa + 1 = 5,1 [AH] négligeable devant [A-] OK3. On prépare une solution (S') en mélangeant 50 ml d'une solution 0,07 mol L-1 de la base
conjuguée NaA avec V ml d'une solution d'acide AH 0,1 mol L-1. Le pH de cette solution est de 5. Calculer V. a) - Comment nomme-t-on une telle solution ? Quelles sont ses propriétés ?Solution tampon
pH stable vis-à-vis d'ajouts modérés d'acide et de base, de la dilution b) - Calculer V pH = pKa + Log [A-]/[AH]5 = 4,1 + Log [A-]/[AH]
Log [A-]/[AH] = 0,9 = Log (CA-*VA-)/(CAH*VAH)
VAH = (CA-*VA-) / (CAH*100.9)
VAH = (0,07 * 50) / (0,1*100.9) = 4,4 mL
Données à 25 °C :
pKe = 14.quotesdbs_dbs11.pdfusesText_17[PDF] electrocinetique exercices corrigés gratuit
[PDF] electrostatique et electrocinétique rappel de cours et exercices corrigés de physique
[PDF] electrocinétique mpsi cours
[PDF] resumé d'un cours d'électrocinétique
[PDF] electrocinetique mpsi pdf
[PDF] electrocinetique exercices corrigés pdf s2
[PDF] électrode de travail électrochimie
[PDF] électrode de référence ag/agcl
[PDF] potentiel d'électrode définition
[PDF] pont salin
[PDF] potentiel électrode de référence ag/agcl
[PDF] electrode 1ere espece
[PDF] électrode au chlorure d'argent
[PDF] electrode de platine
