 Physique-chimie pour la santé
Physique-chimie pour la santé
Test à la liqueur de Fehling (solution basique bleue contenant des ions Cuivre (II) complexés). Protocole : • Verser 2 à 3 mL de liqueur de Fehling dans un tube
 Atelier de biologie mise en évidence de glucides
Atelier de biologie mise en évidence de glucides
On additionne de la liqueur de Fehling (liquide bleu) à la solution que l'on veut tester. On chauffe à l'aide d'un bec bunsen pendant quelques minutes. Le test
 Fiche de Données de Sécurité: Liqueur de Fehling I
Fiche de Données de Sécurité: Liqueur de Fehling I
1.1. Identificateur de produit. Identification de la substance. Liqueur de Fehling I Reag. Ph. Eur. pour la dé- termination du sucre. Numéro d'article.
 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
Liqueur de Fehling. Solution 1. CuSO4 5H2O. 40 g. Eau. 300 mL. (prévoir un excès de 5-10% de CuSO4). Solution 2. NaOH. 130 g. Tartrate de K et Na. 160 g. Eau.
 Kit identification des molécules du vivant
Kit identification des molécules du vivant
1) Mise en évidence de la présence de glucides dans la pomme. Pour mettre en évidence la présence de glucides dans la pomme un test à la liqueur de Fehling
 1 L A 04 Les glucides B version prof
1 L A 04 Les glucides B version prof
Faire le test avec la liqueur de Fehling. Conclure. (Il faudra bien préciser les aliments choisis). Liqueur de Fehling + solution de glucose. Liqueur de Fehling
 2 : Mise en évidence de lactivité enzymatique de lamylase
2 : Mise en évidence de lactivité enzymatique de lamylase
Le test à la liqueur de Fehling permet de détecter la présence de sucres réducteurs (maltose ou glucose). En effet la solution reste bleue en leur absence et
 LIQUEUR DE FEHLING A ET B
LIQUEUR DE FEHLING A ET B
En cas d'arrêt respiratoire pratiquer la respiration artificielle. Consulter un médecin. Page 3. Page 3 sur 8. LIQUEUR DE FEHLING A ET
 FICHE DE DONNÉES DE SÉCURITÉ
FICHE DE DONNÉES DE SÉCURITÉ
Nom du produit : Liqueur de Fehling prête à l'emploi. V 16.5. Page 2 / 11 Action mutagène bactérienne (test de cellules de mammifères) : test micronucleus.
 Fiche technique dutilisation de réactifs spécifiques de différents
Fiche technique dutilisation de réactifs spécifiques de différents
B : test positif en présence d'amidon ;. C : test positif en présence de glycogène. Page 2. Liqueur de Fehling. Propriété. Mise en œuvre. Il s'agit d'un réactif
 Atelier de biologie mise en évidence de glucides
Atelier de biologie mise en évidence de glucides
En suivant le principe du test à la liqueur de Fehling déterminer quels aliments contiennent du glucose. Liqueur de. Fehling. Solution à tester. Page 3. 3.
 Physique-chimie pour la santé
Physique-chimie pour la santé
Test positif ou négatif. Liqueur de. Fehling aldéhyde. À chaud. Solution bleue. Précipité rouge brique. + cétone. Solution bleue. -. Réactif de Schiff.
 1 L A 04 Les glucides B version prof
1 L A 04 Les glucides B version prof
1.1. Test du glucose et du fructose. Réactif utilisé : la liqueur de Fehling. Mode opératoire : Dans un tube à essai contenant de la liqueur de Fehling de
 S3-Corps humain et santé : glycémie et diabète LINTOLERANCE
S3-Corps humain et santé : glycémie et diabète LINTOLERANCE
(non test négatif). Placer au bain marie à 37°C pendant 10min puis réaliser le test à la liqueur de Fehling pour voir si glucose est présent (oui car.
 LA NATURE CHIMIQUE DES RÉSERVES CONTENUES DANS LES
LA NATURE CHIMIQUE DES RÉSERVES CONTENUES DANS LES
permettra de mettre en évidence l'amidon la liqueur de Fehling les sucres ... d'autres réagiront au test de biuret en devenant violet (présence de ...
 Etude expérimentale de lhydrolyse de lamidon par lamylase
Etude expérimentale de lhydrolyse de lamidon par lamylase
Réalisez sur un prélèvement de chaque solution un test à la liqueur de Fehling. ? Etape 2 : Préparation des différentes conditions expérimentales.
 2 : Mise en évidence de lactivité enzymatique de lamylase
2 : Mise en évidence de lactivité enzymatique de lamylase
Le test à la liqueur de Fehling permet de détecter la présence de sucres réducteurs (maltose ou glucose). En effet la solution reste bleue en leur absence
 TP09 – Les enzymes des catalyseurs biologiques
TP09 – Les enzymes des catalyseurs biologiques
Cette réaction d'hydrolyse est mise en évidence par la présence des molécules de maltose révélées par le test à la liqueur de Fehling.
 1ère PARTIE : FONCTIONNEMENT DE LORGANISME ET BESOIN
1ère PARTIE : FONCTIONNEMENT DE LORGANISME ET BESOIN
Dans le tube n°2 nous faisons un test à la liqueur de Fehling et nous observons que le mélange liqueur et empois d'amidon initial devient rouge brique.
 Tests de reconnaissance de produits organiques
Tests de reconnaissance de produits organiques
réaliser des tests permettant d'identifier les groupes fonctionnels des espèces chimiques Test. Résultat. Aldéhyde. DNPH. Liqueur de Fehling.
 [PDF] dosage des sucres réducteurs: méthode de Fehling - Sites ENSFEA
[PDF] dosage des sucres réducteurs: méthode de Fehling - Sites ENSFEA
Liqueur de Fehling Solution 1 CuSO4 5H2O 40 g Eau 300 mL (prévoir un excès de 5-10 de CuSO4) Solution 2 NaOH 130 g Tartrate de K et Na 160 g Eau
 [PDF] Fiche de Données de Sécurité: Liqueur de Fehling I - Carl Roth
[PDF] Fiche de Données de Sécurité: Liqueur de Fehling I - Carl Roth
Fiche de données de sécurité selon le Règlement (CE) no 1907/2006 (REACH) Liqueur de Fehling I Reag Ph Eur pour la détermination du sucre
 [PDF] LIQUEUR DE FEHLING A ET B - SORDALAB
[PDF] LIQUEUR DE FEHLING A ET B - SORDALAB
LIQUEUR DE FEHLING A ET B 253203 1611 FICHE DE DONNÉES DE SÉCURITÉ Conformément au Règlement (CE) No 453/2010 Version 1 - Date de révision 02 11 2017
 [PDF] Atelier de biologie mise en évidence de glucides - Franciaoktataseu
[PDF] Atelier de biologie mise en évidence de glucides - Franciaoktataseu
En suivant le principe du test à la liqueur de Fehling déterminer quels aliments contiennent du glucose Liqueur de Fehling Solution à tester Page 3 3
 [PDF] Fiche technique dutilisation de réactifs spécifiques de différents
[PDF] Fiche technique dutilisation de réactifs spécifiques de différents
Liqueur de Fehling Propriété Mise en œuvre Il s'agit d'un réactif de couleur bleue contenant des ions cuivre (Cu 2+) complexés à d'autres ions en milieu
 [PDF] Expérience de biochimie : Analyser des aliments Biologie
[PDF] Expérience de biochimie : Analyser des aliments Biologie
Test à la liqueur de Fehling : mise en évidence des sucres réducteurs La liqueur de Fehling est une solution renfermant des ions Cu2+ de couleur bleue en
 [PDF] Enquête scientifique : les tests didentification des sucres
[PDF] Enquête scientifique : les tests didentification des sucres
Pour cela rien de plus simple il existe 2 tests simples : - le test à la liqueur de Fehling - le test à l'iode Les 3 suspects (qui font la même pointure
 [PDF] Résultats des tests pour lensemble de la classe
[PDF] Résultats des tests pour lensemble de la classe
Résultats des tests pour l'ensemble de la classe Pomme de terre Pomme oignon Noix Blanc d'œuf Sel Test à la liqueur de Fehling Glucose
 [PDF] La catalyse enzymatique - AlloSchool
[PDF] La catalyse enzymatique - AlloSchool
Test des glucides simples grâce à la liqueur de Fehling : La liqueur de Fehling est un liquide bleu qui par chauffage en présence de glucides simples
 [PDF] 1 L A 04 Les glucides B version prof
[PDF] 1 L A 04 Les glucides B version prof
1 1 Test du glucose et du fructose Réactif utilisé : la liqueur de Fehling Mode opératoire : Dans un tube à essai contenant de la liqueur de Fehling de
Comment tester la liqueur de Fehling ?
Lors du test à la liqueur de Fehling, le milieu est basique et chaud ce qui permet au fructose de s'isomériser en glucose, la fonction cétone se transforme en fonction aldéhyde et donc le test est positif.Quel est le résultat d'un test positif à la liqueur de Fehling ?
Plus spécifiquement, en biochimie, la réaction de Fehling permet de mettre en évidence la présence d'aldoses et de sucres réducteurs. Les oses renfermant un groupe aldéhydique libre réduisent en milieu alcalin et à chaud, les complexes (tartrates par exemple) de métaux (dont le cuivre).Pourquoi on utilise le test de Fehling ?
Lors d'un chauffage, la liqueur de Fehling change de couleur pour devenir rouge-brique en présence d'un sucre « simple » (comme le glucose par exemple). La liqueur de Fehling est le réactif des sucres « petits » (ou simples ou rapides).
TP09 - Les enzymes, des catalyseurs biologiques
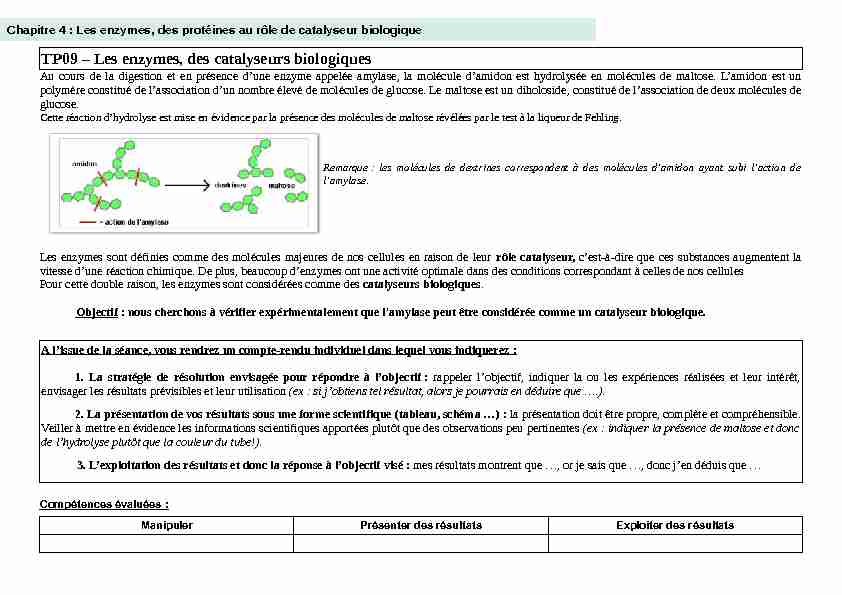
Au cours de la digestion et en présence d'une enzyme appelée amylase, la molécule d'amidon est hydrolysée en molécules de maltose. L'amidon est un
polymère constitué de l'association d'un nombre élevé de molécules de glucose. Le maltose est un diholoside, constitué de l'association de deux molécules de
glucose.Cette réaction d'hydrolyse est mise en évidence par la présence des molécules de maltose révélées par le test à la liqueur de Fehling.
Remarque : les molécules de dextrines correspondent à des molécules d'amidon ayant subi l'action de
l'amylase.Les enzymes sont définies comme des molécules majeures de nos cellules en raison de leur rôle catalyseur, c'est-à-dire que ces substances augmentent la
vitesse d'une réaction chimique. De plus, beaucoup d'enzymes ont une activité optimale dans des conditions correspondant à celles de nos cellules
Pour cette double raison, les enzymes sont considérées comme des catalyseurs biologiques.Objectif : nous cherchons à vérifier expérimentalement que l'amylase peut être considérée comme un catalyseur biologique.
A l'issue de la séance, vous rendrez un compte-rendu individuel dans lequel vous indiquerez :
1. La stratégie de résolution envisagée pour répondre à l'objectif : rappeler l'objectif, indiquer la ou les expériences réalisées et leur intérêt,
envisager les résultats prévisibles et leur utilisation (ex : si j'obtiens tel résultat, alors je pourrais en déduire que ....).
2. La présentation de vos résultats sous une forme scientifique (tableau, schéma ...) : la présentation doit être propre, complète et compréhensible.
Veiller à mettre en évidence les informations scientifiques apportées plutôt que des observations peu pertinentes (ex : indiquer la présence de maltose et donc
de l'hydrolyse plutôt que la couleur du tube!).3. L'exploitation des résultats et donc la réponse à l'objectif visé : mes résultats montrent que ..., or je sais que ..., donc j'en déduis que ...
Compétences évaluées :
ManipulerPrésenter des résultatsExploiter des résultats Chapitre 4 : Les enzymes, des protéines au rôle de catalyseur biologique Matériel et protocole d'utilisation du matérielMatériel à utiliser :
-12 tubes à essais -3 pipettes avec petit bécher (pour rinçage des pipettes) -bain-marie 37° + thermomètre -bain-marie 70° + thermomètre -grand bécher avec eau froide (ou glaçons) -plaque coloration -chronomètre -liqueur de Fehling : réactif spécifique des sucres réducteurs, comme le glucose, le maltose -eau iodée : réactif spécifique de l'amidon -solution d'amylase (+ pipette 5 mL) -eau distillée -solution d'empois d'amidon (avec pipette 10 mL) -feutres -fiche technique relative à la mise en évidence des glucides par la liqueur de Fehling et l'eau iodéeTableau des réactifs de certains glucides :Le tableau ci-dessous indique pour différentes molécules et différents réactifs utilisés, les
résultats obtenus.Par exemple, l'utilisation du réactif " eau iodée » permet de révéler la présence d'amidon par
une coloration violet-noir. En revanche, l'eau iodée ne permet pas de révéler la présence de
maltose (dans ce cas, la coloration reste jaune).Voir fiche technique jointe
Conseils pour la réalisation du protocole :
1. Préparer 3 tubes par binôme :
Tube 1 : 10 mL d'amidon + 3 mL d'amylase à placer au bain-marie 37°C Tube 2 : 10 mL d'amidon + 3 mL d'eau distillée à placer au bain-marie 37°C Tube 3 : 10 mL d'amidon + 3 mL d'amylase à placer dans le bécher d'eau froideNB : Introduire l'enzyme uniquement lorsque tout le matériel est prêt et faire immédiatement les premiers tests.
Penser à repérer vos tubes à l'aide des feutres !2. Tester la présence d'amidon (avec l'eau iodée) et la présence de sucres réducteurs (avec la liqueur de Fehling) de vos 3 tubes à t=0.
3. Replacer les 3 tubes au bain-marie à 37°C (tubes 1 et 2) et dans l'eau froide (tube 3).
4. Recommencer les deux tests (amidon et sucres réducteurs) de vos 3 tubes à t=15 min, t=30 min et t=45 minutes.
Attention de bien mélanger le contenu des tubes avant les prélèvements et de rincer vos pipettes !!!+ : test positif
- : test négatifCorrection
1. La stratégie de résolution envisagée pour répondre à l'objectif : rappeler l'objectif, indiquer la ou les expériences réalisées et leur intérêt, envisager les
résultats prévisibles et leur utilisation (ex : si j'obtiens tel résultat, alors je pourrais en déduire que ....).
Nous cherchons à vérifier expérimentalement que l'amylase peut être considérée comme un catalyseur biologique, c'est-à-dire que cette enzyme
permet d'accélérer l'hydrolyse de l'amidon en molécules de maltose dans des conditions compatibles avec celles du fonctionnement de nos cellules.
- pour vérifier que l'amylase est effectivement un catalyseur, nous allons comparer la vitesse d'hydrolyse d'une solution d'amidon en présence
ou en absence d'amylase,- pour vérifier que l'amylase agit dans des conditions biologiques, nous allons comparer la vitesse d'hydrolyse d'une solution d'amidon en
présence d'amylase, à 37°C (conditions proches de l'organisme) et dans des conditions très différentes (à 0°C).
Pour évaluer l'hydrolyse de l'amidon, nous allons d'une part tester la présence d'amidon (avec de l'eau iodée) et d'autre part tester la formation de
maltose (produits de l'hydrolyse) avec le test à la liqueur de Fehling.Si la disparition d'amidon et la formation de maltose est plus rapide en présence d'amylase, nous pourrons en déduire que l'amylase est un
catalyseur de l'hydrolyse de l'amidon.De la même façon, si la disparition d'amidon et la formation de maltose est plus rapide à 37°C qu'à 0°C, nous pourrons en déduire que l'amylase agit
préférentiellement dans des conditions biologiques.2. La présentation de vos résultats sous une forme scientifique (tableau, schéma ...) : la présentation doit être propre, complète et compréhensible. Veiller
à mettre en évidence les informations scientifiques apportées plutôt que des observations peu pertinentes (ex : indiquer la présence de maltose et donc de
l'hydrolyse plutôt que la couleur du tube!).Résultats expérimentaux obtenus
Tube 1 : Amidon + eau distillée
37°CTube 2 : Amidon + amylase
37°CTube 3 : Amidon + amylase
0°C
Test amidonTest liqueur de FTest amidonTest liqueur de FTest amidonTest liqueur de F t = 0 minutes++-++-++- t = 15 minutes++-++++- t = 30 minutes++--+++- t = 45 minutes++--+++- Légendes Test Amidon : ++ : beaucoup d'amidon+ : quantité moyenne d'amidon- : absence d'amidon Légendes Test Liqueur de Fehling: +: présence de maltose- : absence de maltose3. L'exploitation des résultats et donc la réponse à l'objectif visé : mes résultats montrent que ..., or je sais que ..., donc j'en déduis que ...
Nos résultats montrent qu'en absence d'amylase (tube 1) l'amidon est toujours présent et aucune molécule de maltose n'est produite. Il n'y a donc pas
d'hydrolyse de l'amidon. En revanche, en présence d'amylase (tube 2), les molécules d'amidon disparaissent au bout de 15 minutes et simultanément des
molécules de maltose sont produites.L'hydrolyse de l'amidon s'est donc réalisée.On en déduit donc, qu'en présence d'amylase, l'hydrolyse de l'amidon est plus rapide. L'amylase est donc bien un catalyseur.
Nos résultats montrent qu'en présence d'amylase mais dans des conditions froides (tube 3), l'hydrolyse de l'amidon ne s'effectue pas après 45 minutes, alors
qu'elle se produit en 15 minutes lorsque le tube se trouve dans des conditions proches de celles de l'organisme. Nous en déduisons donc que l'amylase agit
préférentiellement dans des conditions proches de celles de l'organisme. L'amylase est donc bien un catalyseur biologique.
quotesdbs_dbs7.pdfusesText_5[PDF] administration industrielle et générale fayol
[PDF] henri fayol management
[PDF] quizz petit déjeuner
[PDF] questionnaire petit déjeuner
[PDF] séparation des principaux constituants du lait
[PDF] questionnaire enquête petit déjeuner
[PDF] mise en évidence du calcium dans le lait
[PDF] enquete petit dejeuner
[PDF] questionnaire sécurité informatique entreprise
[PDF] campagne de sensibilisation sécurité informatique
[PDF] questionnaire sur l importance du petit dejeuner
[PDF] qcm sécurité informatique corrigé
[PDF] qcm paces avec corrigé
[PDF] tp facteurs cinétiques et catalyse
