 Untitled
Untitled
b) Dans la représentation suivante du modèle atomique de Rutherford-Bohr indiquez le nom Calcium. 17. Un atome possède 26 protons et 30 neutrons.
 Latome et les éléments
Latome et les éléments
Dans ce modèle on devrait indiquer le nombre de neutrons présents dans le noyau. b). Oui
 Le tableau de Mendeleïev
Le tableau de Mendeleïev
Calcium. Rubidium. Strontium. Césium. Baryum. Francium chimiques selon leur numéro atomique et leurs propriétés chimiques. Quatre éléments ont été ...
 Chapitre 1 - LATOME ET LES ÉLÉMENTS
Chapitre 1 - LATOME ET LES ÉLÉMENTS
modèle atomique simplifié. a. Un noyau très petit composé de protons. ? chargés positivement et de neutrons qui ne possèdent aucune charge électrique.
 THESE de DOCTORAT Interaction des Silicates de Calcium
THESE de DOCTORAT Interaction des Silicates de Calcium
Dans l'espace interfeuillet aucun atome de calcium n'est présent. peut être attribuée à la simplification sans doute excessive du modèle de surface des ...
 Ions calcium uniques pour un étalon de fréquence optique
Ions calcium uniques pour un étalon de fréquence optique
2005?6?29? Les étalons atomiques de fréquences s'avèrent également très utiles pour des ap- plications plus quotidiennes. Par exemple ils servent à ...
 EXERCICES CHAPITRE 1 -SECTION STE-
EXERCICES CHAPITRE 1 -SECTION STE-
8. Illustrez chacun des éléments suivants selon le modèle atomique simplifié. a) Calcium b) Chlore. 9. Déterminez la masse molaire de chacune des substances
 EXERCICES CHAPITRE 1 -SECTION STE-
EXERCICES CHAPITRE 1 -SECTION STE-
8. Illustrez chacun des éléments suivants selon le modèle atomique simplifié. a) Calcium b) Chlore. 9. Déterminez la masse molaire de chacune des substances
 3. Modèle atomique de Dalton
3. Modèle atomique de Dalton
à l'aide de la notation simplifiée puis réponds aux questions posées ! Selon le modèle atomique de Dalton
 Corrigé
Corrigé
Le titane est l'élément de numéro atomique Z = 22 de symbole Ti. Le calcium est un alcalinoterreux et donc il cède facilement ses 2 électrons 4s pour.
 [PDF] cahiercorrigech1pdf
[PDF] cahiercorrigech1pdf
Représentez les mêmes éléments qu'à la question précédente mais à l'aide du modèle atomique simplifié a) Calcium c) Phosphore b) Béryllium 20 p
 [PDF] le modèle de latome - AlloSchool
[PDF] le modèle de latome - AlloSchool
Animation sur l'histoire du modèle atomique L'atome est constitué d'un noyau et d'électrons qui se déplacent autour vidéo un ion calcium Ca2+ pour
 [PDF] Latome et les éléments
[PDF] Latome et les éléments
Indiquez si chacun des atomes suivants respecte le modèle atomique simplifié Si ce n'est pas le cas expliquez pourquoi a) b) 15 Indiquez si chacun des
 [PDF] Latome et les éléments
[PDF] Latome et les éléments
Indiquez si chacun des atomes suivants respecte le modèle atomique simplifié Si ce n'est pas le cas expliquez pourquoi a) Non il ne respecte pas le modèle
 Le modèle atomique simplifié Alloprof
Le modèle atomique simplifié Alloprof
Le modèle atomique simplifié représente l'atome avec le nombre de protons et de neutrons dans le noyau ainsi que le nombre d'électrons sur chacune des
 Calcium - Wikipédia
Calcium - Wikipédia
modifier · Consultez la documentation du modèle Le calcium est l'élément chimique de numéro atomique 20 de symbole Ca De façon simplifiée :
 [PDF] Le tableau de Mendeleïev - CEA
[PDF] Le tableau de Mendeleïev - CEA
Calcium Rubidium Strontium Césium Baryum Francium chimiques selon leur numéro atomique et leurs propriétés chimiques Quatre éléments ont été
 [PDF] Le tableau périodique simplifié des éléments
[PDF] Le tableau périodique simplifié des éléments
ex Ge désigne tous les atomes de germanium ou un atome de germanium Masse atomique Symbole Nom français Numéro atomique 101 H hydrogène
 [PDF] Chapitre 2 - Constitution de la matière - Lycée dAdultes
[PDF] Chapitre 2 - Constitution de la matière - Lycée dAdultes
Rutherford propose un modèle planétaire de l'atome (disposition analogue au système Exemple L'atome d'hydrogène est composées d'1 proton et 0 neutrons
 1
1 EXERCICES CHAPITRE 1 -SECTION STE-
1. Observez la notation suivante :
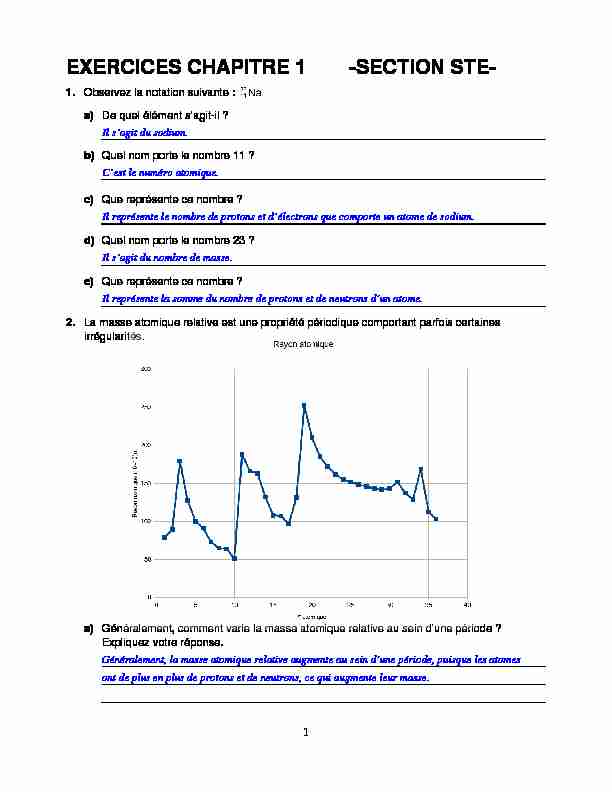
a) De quel élément s"agit-il ? b) Quel nom porte le nombre 11 ? c) Que représente ce nombre ? d) Quel nom porte le nombre 23 ? e) Que représente ce nombre ?2. La masse atomique relative est une propriété périodique comportant parfois certaines
irrégularités. a) Généralement, comment varie la masse atomique relative au sein d"une période ?Expliquez votre réponse.
Généralement, la masse atomique relative augmente au sein d"une période, puisque les atomes ont de plus en plus de protons et de neutrons, ce qui augmente leur masse. Il représente la somme du nombre de protons et de neutrons d"un atome.Il s"agit du nombre de masse.
Il représente le nombre de protons et d"électrons que comporte un atome de sodium. C"est le numéro atomique.
Il s"agit du sodium.
2 b) Comparez la masse atomique relative du cobalt et du nickel. Expliquez la différence observée.3. L"énergie de première ionisation est l"énergie nécessaire pour arracher un électron
à un atome.
a) Comment varie l"énergie de première ionisation au sein d"une période ? Expliquez pourquoi. (Consultez au besoin l"annexe 1 à la page 514 du manuel.) b) Comment varie l"énergie de première ionisation au sein d"une famille ?4. Observez le diagramme suivant, qui illustre la variation de la conductibilité électrique en
fonction du numéro atomique. LA CONDUCTIBILITÉ ÉLECTRIQUE EN FONCTION DU NUMÉRO ATOMIQUEL"énergie de première ionisation diminue au sein d"une famille puisque les électrons de valence
sont de moins en moins attirés par le noyau, car ils en sont de plus en plus éloignés.L"énergie de première ionisation augmente au sein d"une période parce que les électrons sont de
plus en plus attirés par le noyau qui comporte de plus en plus de protons. La masse atomique relative du cobalt est de 58,93 u, tandis que celle du nickel est de 58,69 u. Lamasse atomique relative du nickel est plus petite que celle du cobalt à cause du nombre de neutrons
qu"il comporte. 3 Pourquoi la conductibilité électrique de certains éléments est-elle presque nulle ?5. Un atome possède 17 protons et 20 neutrons. De quel élément s"agit-il ? Expliquez votre
réponse.6. Observez l"élément hypothétique suivant :
Indiquez si chacun des énoncés suivants est vrai ou faux et expliquez pourquoi. a) Un atome de cet élément comporte un seul neutron. b) Le nombre de masse de cet élément est 2. c) est un isotope de cet élément. d) Le numéro atomique de cet élément est 1.7. Illustrez chacun des éléments suivants selon la notation de Lewis.
a) Krypton b) Gallium c) Sélénium d) BaryumLa conductibilité électrique de ces éléments est presque nulle puisque ce sont des non-métaux.
Il s"agit de chlore, puisque son numéro atomique est 17. Faux. Un atome de cet élément ne comporte aucun neutron. Le nombre de neutrons est égal au nombre de masse moins le nombre de protons. Donc 1 - 1 = 0. Faux. Le nombre de masse est le chiffre supérieur de la notation ci-dessus.Vrai. En effet, le numéro atomique correspond au chiffre inférieur de la notation ci-dessus. Vrai. En effet, tous les isotopes d"un élément comportent le même nombre de protons. Ils ont donc
le même numéro atomique. 48. Illustrez chacun des éléments suivants selon le modèle atomique simplifié.
a) Calcium b) Chlore9. Déterminez la masse molaire de chacune des substances suivantes.
a) Co b) CO c) (NH4)2CrO4 d) Ca(OH)210. Alexis recueille un échantillon de 2,5 mol de carbonate de calcium (CaCO3).
a) Combien de molécules contient cet échantillon ? b) Combien d"atomes contient cet échantillon ?58,93 g/mol
28,01 g/mol
152,1 g/mol
74,1 g/mol
1,505 × 1024 molécules × 5 atomes / molécules = 7,525 × 1024 atomes
6,02 × 1023 molécules = ? molécules
1 mol 2,5 mol
2,5 mol × 6,02 × 10
23 molécules = 1,505 × 1024 molécules
1 mol L"échantillon contient 1,505 × 1024 molécules. 5 c) Quelle est la masse de cet échantillon ?11. Remplissez le tableau suivant.
Substance Masse molaire
(g/mol) Masse (g) Nombre de moles (mol)Ar 0,25
Mg 0,49
Al2(CO3)3 4,25
CH3COOH 25
12. Quelle est la masse de 4,25 x 1024 atomes de cuivre ?
1. m = ?
2. n = 2,5 mol
M = 100,09 g/mol
3. M = m d"où m = Mn
n4. m = 100,09 g/mol × 2,5 mol = 250,2 g
5. La masse de cet échantillon est de 250,2 g.
39,95 9,99
24,31 0,02
233,99 994,5
60,06 0,42
m = ?M = m d"où m = Mn
n6,02 × 10
23 atomes = 4,25 × 1024 atomes
1 mol ? mol
1 mol × 4,25 × 10
24 atomes = 7,06 mol
6,02 × 1023 atomes
m = 63,55 g/mol × 7,06 mol = 448,66 g La masse de 4,25 × 1024 atomes de cuivre est de 448,66 g. 613. Quelle est la masse de 8,2 x 1022 molécules de H3PO4 ?
14. Vincent gonfle un ballon avec 0,25 g d"hélium. Combien de moles d"hélium contient ce ballon ?
15. Combien y a-t-il de moles de molécules dans 59,2 g de Mg(NO
3)2 ? m = ?M = m d"où m = Mn
n6,02 × 10
23 molécules = 8,2 × 1022 molécules
1 mol ? mol
1 mol × 8,2 × 10
22 molécules = 0,136 mol
6,02 × 1023 molécules
m = 98,00 g/mol × 0,136 mol = 13,3 g1. n = ?
2. m = 0,25 g
M = 4,00 g/mol
3. M = m d"où n = m
n M4. n = 0,25 g = 0,0625 mol
4,00 g/mol
5. Le ballon contient 0,0625 mol.
1. n = ?
2. m = 59,2 g
M = 148,33 g/mol
3. M = m d"où n = m
n M4. n = 59,2 g = 0,399 mol
148,33 g/mol
5. Il y a 0,399 mol dans 59,2 g de Mg(NO3)2.
La masse de 8,2 × 1022 atomes de cuivre est de 13,3 g. 716. Noémie dissout 30 g de sucre (C12H22O11) dans un verre d"eau. Combien de moles de sucre
contient le verre ?17. Un échantillon de 25 g d"un élément contient 0,232 mol d"atomes. Quel est cet élément ?
1. n = ?
2. m = 30 g
M = 342,34 g/mol
3. M = m d"où n = m
n M4. n = 30 g = 0,088 mol
342,34 g/mol
1. M = ?
2. m = 25 g
n = 0,232 mol3. M = m
n4. M = 25 g = 107,8 g/mol
0,232 mol
5. La masse molaire de l"élément est de 107,8 mol. Il s"agit donc de l"argent.
818- Calculez la masse atomique relative du Chlore en vous fiant aux données suivantes :
Élément Nombre de masse % dans la nature
Chlore 35 65
36 35
35u x 0,65 = 22,75 u
36u x 0,35 = 12,6u
Total: 35,35u
19- Calculez ma masse atomique relative de l'azote en vous fiant aux données suivantes :
Élément Nombre de masse % dans la nature
AZOTE14 99,64
15 0,36
14u x 0,9964 = 13,95 u
15u x 0,0036u = 0,054u
Total: 14,004u
20- Calculez ma masse atomique relative de l'azote en vous fiant aux données suivantes :Élément Nombre de masse % dans la nature
Potassium 39 93.10
40 0.01
41 6.89
39u x 0,931 = 36,31u
40u x 0,0001 =0,004u
41u x 0,0689 = 2,756u
Total: 39,14u
quotesdbs_dbs33.pdfusesText_39[PDF] modèle atomique simplifié hydrogène
[PDF] notation de lewis
[PDF] protocole infirmier medecine du travail
[PDF] attestation de vigilance rsi
[PDF] attestation niveau langue
[PDF] audit ressources humaines pdf
[PDF] rapport audit social pdf
[PDF] cours publisher 2013 pdf
[PDF] comment utiliser microsoft publisher
[PDF] tutoriel publisher 2013 pdf
[PDF] arrêt blanco pdf
[PDF] arret blanco commentaire d'arret pdf
[PDF] dissertation arrêt blanco
[PDF] arrêt blanco gaja
