 CLASSIFICATION QUALITATIVE DES COUPLES OXYDANT/REDUCTEUR
CLASSIFICATION QUALITATIVE DES COUPLES OXYDANT/REDUCTEUR
CLASSIFICATION QUALITATIVE DES COUPLES OXYDANT/REDUCTEUR Exercice 1 : Connaissances du cours Répondre par vrai et faux aux affirmations suivantes : 1 Lorsqu’on met en présence une solution de sulfate de cuivre (II) et du mercure, il y a dépôt métallique 2
 classification qualitative des couples red ox en kh
classification qualitative des couples red ox en kh
classification qualitative des couples red ox en kh Author: HARTMANN Created Date: 6/23/2008 12:00:00 AM
 Classification qualitative des couples on métalique métal
Classification qualitative des couples on métalique métal
Classification qualitative des couples on métalique_métal - 1er s _ sunudaara Author: user Created Date: 7/24/2020 11:21:02 AM
 o x yd a n t - r é d u c t e u r i o n / m é t a l - 1e r s S
o x yd a n t - r é d u c t e u r i o n / m é t a l - 1e r s S
Exercice 3 O n r é a l i s e l e s e xp é r i e n c e s s u i va n t e s : O n ob s e r v e u n d é p ôt d e c u i v r e s u r l a p a r t i e i m m e r g é e d
 Exercices et cours de Sciences PhysiquesEpreuves BACCALAUREATS
Exercices et cours de Sciences PhysiquesEpreuves BACCALAUREATS
Author: user Created Date: 1/21/2017 10:39:13 PM
 La classification quantitative des couples oxydants réducteurs
La classification quantitative des couples oxydants réducteurs
Activités du professeur Activités des élèves La classification quantitative des couples oxydants réducteurs Niveau : 12 Durée Pré requis : - Oxydoréduction - couple oxydant-réducteur Objectifs : connaissances de la notion de potentiel d’un couple oxydant réducteur et
 SERIE 8 : CLASSIFICATION QUANTITATIVE DES COUPLES OXYDANT
SERIE 8 : CLASSIFICATION QUANTITATIVE DES COUPLES OXYDANT
SERIE 8 : CLASSIFICATION QUANTITATIVE DES COUPLES OXYDANT-REDUCTEUR ION METALLIQUE / METAL harge d’une mole d’électrons = - 1F = -96500 C EXERCICE 1 : , ’ A 1-Comment constituer une pile faisant intervenir les couples Cu2+/ Cu et Ni2+/ Ni ? 2-Indiquer les polarités de la pile Que vaut sa force électromotrice f é m ?
 RECUEIL D’EXERCICES PREMIERE S1 S2 CHIMIE
RECUEIL D’EXERCICES PREMIERE S1 S2 CHIMIE
Série 7 : Classification qualitative des couples oxydant- réducteur (ion métallique/métal) Série 8 : Classification quantitative des couples oxydant-réducteur (ion métallique/métal) Série 9 : Généralisation de l’oxydoréduction en solution aqueuse Série 10 : Electrolyse, bilan quantitatif Série 11 : Oxydoréduction par voie sèche
 Classification électrochimique des métaux
Classification électrochimique des métaux
Classification électrochimique des métaux I Réaction entre le métal fer et une solution de sulfate de cuivre II A lame de ferMode opératoire solution de sulfate de cuivre (SO , Cu 2+) (minimum 0,5 mol/L) B Observations : Après quelques instants : La lame de fer se couvre d’un dépôt rouge de cuivre
 NOMENCLATURE ET CLASSIFICATION DES ENZYMES
NOMENCLATURE ET CLASSIFICATION DES ENZYMES
Dans la cellule il y a des déshydrogénases à NADH,H +/NAD et des déshydrogénases à NADPH,H +/NADP bien que certaines acceptent les deux Ces deux couples sont rarement interchangeables car les produits peuvent êtres très différents Exemple de deux réactions sont catalysées par 2 malate déshydrogénases
[PDF] couple redox exercice
[PDF] couple redox h2o/h2
[PDF] groupe emboité exercice
[PDF] groupe emboité definition
[PDF] comprendre et enseigner la classification du vivant pdf
[PDF] tableau périodique pdf noir et blanc
[PDF] classification périodique des éléments ? imprimer
[PDF] l'élément chimique seconde exercices corrigés
[PDF] exercice corrigé configuration électronique pdf
[PDF] classification périodique des éléments cours
[PDF] classification phylogénétique homme
[PDF] classification phylogénétique des animaux cycle 3
[PDF] classification phylogénétique simplifiée
[PDF] classification phylogénétique definition
Page 1 sur 3
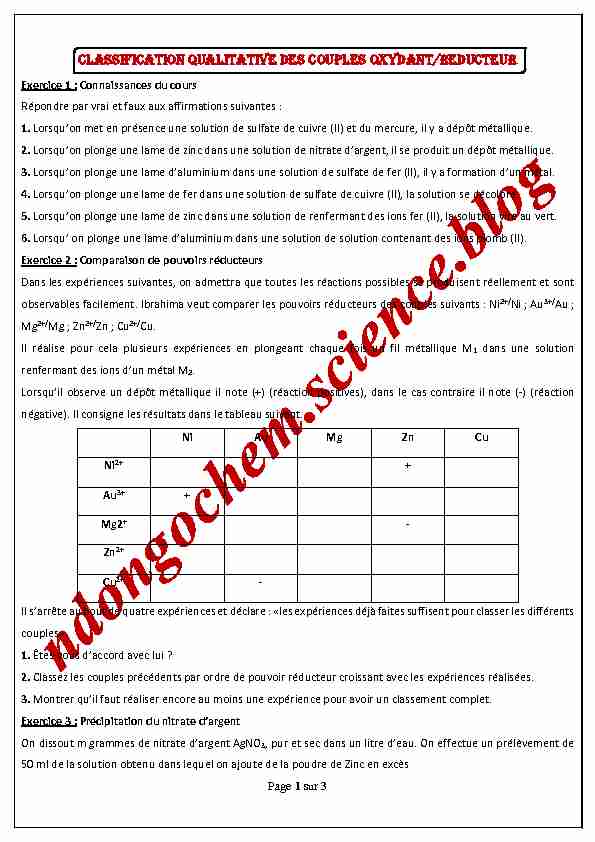
CLASSIFICATION QUALITATIVE DES COUPLES OXYDANT/REDUCTEURExercice 1 : Connaissances du cours
Répondre par vrai et faux aux affirmations suivantes :1. Lorsqu'on met en présence une solution de sulfate de cuivre (II) et du mercure, il y a dépôt métallique.
2. Lorsqu'on plonge une lame de zinc dans une solution de nitrate d'argent, il se produit un dépôt métallique.
3. Lorsqu'on plonge une lame d'aluminium dans une solution de sulfate de fer (II), il y a formation d'un métal.
4. Lorsqu'on plonge une lame de fer dans une solution de sulfate de cuivre (II), la solution se décolore.
5. Lorsqu'on plonge une lame de zinc dans une solution de renfermant des ions fer (II), la solution vire au vert.
6. Lorsqu' on plonge une lame d'aluminium dans une solution de solution contenant des ions plomb (II).
Exercice 2 : Comparaison de pouvoirs réducteursDans les expériences suivantes, on admettra que toutes les réactions possibles se produisent réellement et sont
observables facilement. Ibrahima veut comparer les pouvoirs réducteurs des couples suivants : Ni 2+/Ni ; Au
3+/ Au ; Mg 2+/Mg ; Zn
2+/Zn ; Cu
2+/ Cu. Il réali se pour cela plusieur s expériences en plongeant c haque fois un fil métallique M 1 dans une solu tion renfermant des ions d'un métal M 2Lorsqu'il observe un dépôt métallique il note (+) (réaction positives), dans le cas contraire il note (-) (réaction
négative). Il consigne les résultats dans le tableau suivant.Ni Au Mg Zn Cu
Ni 2+ Au 3+ Mg2 Zn 2+ Cu 2+Il s'arrête au bout de quatre expériences et déclare : "les expériences déjà faites suffisent pour classer les différents
couples».1. Êtes-vous d'accord avec lui ?
2. Classez les couples précédents par ordre de pouvoir réducteur croissant avec les expériences réalisées.
3. Montrer qu'il faut réaliser encore au moins une expérience pour avoir un classement complet.
Exercice 3 : Précipitation du nitrate d'argent
On dissout m grammes de nitrate d'argent AgNO
3 , pur et sec dans un litre d'eau. On effectue un prélèvement de50 ml de la solution obtenu dans lequel on ajoute de la poudre de Zinc en excès
Page 2 sur 3
1. Ecrire l'équation bilan de la réaction ?
2. Sachant que la masse d'argent libérée est de 0,33 g, calculer la valeur de m.
3. On ajoute ensuite, dans le prélèvement après réaction et filtration de la soude. Qu'observe-t-on ? Quelle masse
de précipité peut-on théoriquement obtenir ? Exercice 4 : Expérience de classification de réducteurs1. Au cours d'une expérience, un groupe d'élèves note les observations suivantes :
§ Une lame d'argent plongée dans une solution de chlorure d'or (AuCl 3 ) se recouvre d'or. § Une lame de cuivre plongée dans une solution de nitrate d'argent (AgNO 3 ) se recouvre d'argent. § Une lame de fer pongée dans une solution de sulfate de cuivre (II) se recouvre de cuivre. a) Interpréter ces différents résultats.b) En déduire une classification suivant le pouvoir réducteur croissant des couples ion métallique/métal mis
en jeu au cours de cette expérience. c) Sachant que l'acide chlorhydri que attaque le fer et non le cuivre, placer le couple H /H 2 dans la classification précédente.2. On verse dans un bêcher une petite quantité d'une solution de nitrate d'argent et on y fait barboter du
dihydrogène. Il apparaît de l'argent finement divisé, noir. a) Ecrire l'équation bilan de la réaction d'oxydoréduction qui s'est produite. b) Préciser les espèces oxydée et réduite.3. Sachant que le dihydrogène a été préparé par action de l'acide chlorhydrique sur le zinc avec un rendement de
100% et que seulement 10% du dihydrogène formé réagissent avec le nitrate d'argent le reste s'échappe), quelle
masse d'argent peut-on obtenir si on consomme 4g de zinc ? Exercice 5 : Préparation d'une solution aqueuse Une solution aqueuse S est obtenue en mélangeant du nitrate de cuivre Cu(NO 3 2 et du nitrate d'argent AgNO 3Lorsqu'on plonge une lame de zinc dans un litre de cette solution, on recueille 28 g d'un dépôt solide. D'autre part,
lorsqu'on plonge une lame de cuivre dans un autre litre de cette même solution, on recueille 21,6 g de solide.
1. Préciser la nature des solides recueillis dans chaque cas. Ecrire les équations bilan des réactions dans chaque
cas.2. Calculer les concentrations, dans la solution initiale, des ions Cu
2+ , Ag+ et NO 33. Calculer la concentration de ces mêmes ions après chacune des expériences.
Page 3 sur 3
Exercice 6 :
On donne la classification suivante : - Ag- M
2 - M 1 - Al→ pouvoir réducteur croissant. On effectue les expériences décrites dans les schémas suivants :1. Décrire ce qui se passe dans chaque tube et écrire l'équation-bilan dans le cas où une réaction chimique se
produit.2. L'un des métaux (M
1 ou M 2 ) représente le plomb Pb, l'autre le cuivre Cu. a) Sachant qu'une solution d'acide chlorhydrique (H 3 0 + Cl ) attaque le plomb et ne réagit pas avec le cuivre.Placer le dihydrogène H
2 sur la classification décrite ci-dessus. b) Des deux métaux M 1 et M 2 identifier celui qui représente le plomb puis, le cuivre. Justifier.3. On réalise une pile en associant les demi-piles constituées des couples M
2+ /M 1 et M 2+ /M 2 a) Faire un schéma de la pile faisant intervenir ces couples.b) Préciser la borne positive et la borne négative ainsi que le sens de circulation des électrons. Justifier.
c) Ecrire la demi-équation électronique qui se produit dans chaque demi-pile, lorsque la pile débite du courant.
d) A partir des questions précédentes décrire le fonctionnement de la pile et écrire l'équation bilan qui
correspond.quotesdbs_dbs30.pdfusesText_36