La combustion du soufre et les pluies acides La pollution
La combustion du soufre et les pluies acides La pollution
La combustion du soufre est une réaction chimique d’oxydoréduction par voie sèche de bilan: L’aspiration observée résulte de la dissolution du dioxyde de soufre SO2 dans l’eau Au contact de l’eau SO2 se transforme en HSO3- + H3O + Les fumées blanches sont du trioxyde de soufre SO3 qui elles sont insolubles dans l’eau
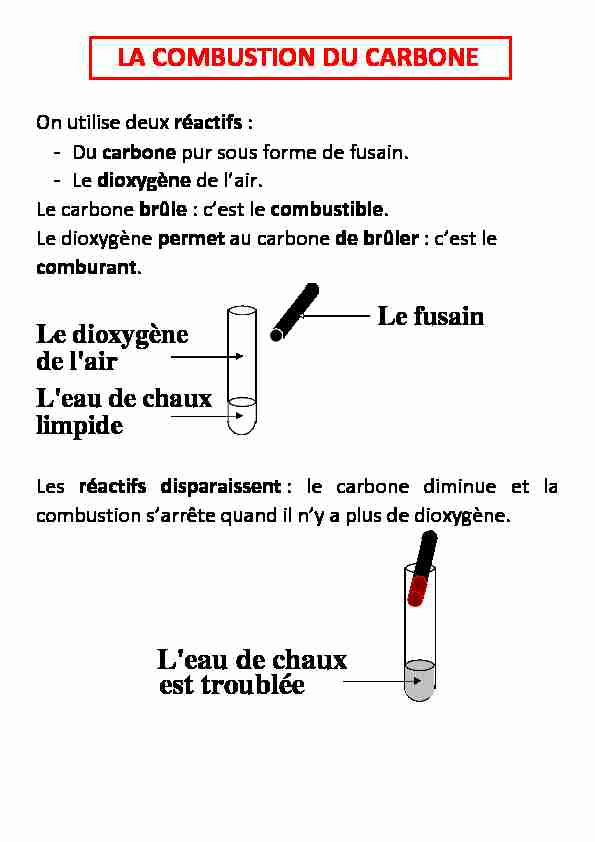
 carbone de lair
carbone de lair
Dans une combustion, celui qui brûle s’appelle le _____ Le _____ permet au combustible de brûler Le comburant est généralement le dioxygène de l’air 2) La combustion du soufre dans le dioxygène de l’air: Le combustible est le _____ Le comburant est le _____ de l’air
 1 Formation du soufre - chaurandfr
1 Formation du soufre - chaurandfr
du dioxyde de carbone présent dans l’atmosphère Par ailleurs, la combustion des matières fossiles (charbon, pé-trole et gaz) produit du dioxyde de soufre et des oxydes d’azote qui s’associent à l’humidité de l’air pour libé-rer de l’acide sulfurique et de l’acide nitrique Ces acides
 Niveau : ةيوقتلاو معدلا سورد Matière : 2 Année collège La
Niveau : ةيوقتلاو معدلا سورد Matière : 2 Année collège La
La combustion du soufre dans l’air entraine la formation du gaz de dioxyde de soufre Le dioxyde de soufre réagit à son tour avec le dioxygène de l’air, sous l’influence des rayons ultraviolets du soleil, se transformant en trioxyde de soufre 1 Ecrivez l’équation de chacune des réactions chimiques citées ci-dessus 2
 DIOXYDE DE SOUFRE (S O2 - iseregouvfr
DIOXYDE DE SOUFRE (S O2 - iseregouvfr
Le dioxyde de soufre (SO 2) est un gaz qui est fabriqué à partir des minerais soufrés, de la combustion du soufre, ou dans l’industrie pétrolière Il est utilisé dans la synthèse d’acide sulfurique, du dioxyde de chlore, dans les industries pétrolières et dans la synthèse des sulfites (traitement du vin)
 Groupe Scolaire Série : 3 Science Henri Matisse physique
Groupe Scolaire Série : 3 Science Henri Matisse physique
Il est nécessaire à la combustion Gaz de dioxygène Elle se condense en fines gouttelettes d’eau sur une paroi froide Exercice 4: La combustion du soufre dans le dioxygène produit un gaz toxique, appelé dioxyde de soufre 1) Déterminer :
 SO2 – Dioxyde de soufre
SO2 – Dioxyde de soufre
soufre (SO3) pur par oxydation catalytique dans l'air Le SO3 ainsi obtenu permet la fabrication directe d'acide sulfurique très concentré par simple hydratation Les rejets industriels de dioxyde de soufre peuvent être réduits grâce à la mise en place de procédés de désulfuration (pré ou post-combustion) La combustion du charbon est
 EXERCICE 1 EXERCICE 3 teneur en soufre d’un fioul
EXERCICE 1 EXERCICE 3 teneur en soufre d’un fioul
La combustion d'un fioul libère dans l'atmosphère du dioxyde de soufre (SO2) qui participe à la formation des pluies acides, responsables notamment du dépérissement des forêts et de la dégradation des pierres des monuments historiques La teneur en soufre (pourcentage massique) maximale autorisée dans un fioul est 0,3 Pour
[PDF] pouvoir comburivore definition
[PDF] effet thermique définition
[PDF] calorimètre
[PDF] exothermique
[PDF] epreuve commune 4eme physique chimie 2015
[PDF] combustion du butane exercice
[PDF] exercice sur la combustion des hydrocarbures
[PDF] on fait bruler du carbone dans du dioxygène
[PDF] équation combustion incomplète
[PDF] combustion du monoxyde de carbone
[PDF] cours combustion pdf
[PDF] cours combustion 4ème
[PDF] comedie classique regles
[PDF] la comédie classique définition