 Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Une solution est toujours constituée : ✓ d'un solvant (constituant majoritaire). ✓ d'un ou plusieurs solutés. Les solutions liquides (dites aqueuses lorsque
 Chimie des solutions
Chimie des solutions
Objectifs : Niveau CPGE PC en chimie des solutions : - Maîtriser les calculs des concentrations des espèces en solution à l'aide des données théoriques et.
 La Chimie en solution
La Chimie en solution
On pourra calculer la différence de pH observée dans deux solutions acides de même concentration en H+ (mais de force ionique différente liée à la présence ou
 République Algérienne Démocratique et Populaire COURS DE
République Algérienne Démocratique et Populaire COURS DE
LMD Licences Chimie Analytique et Chimie pharmaceutique… Il couvre en cinq chapitres les bases de la Chimie en Solution. Ce module s'inscrit dans le
 F2School
F2School
CHIMIE DES SOLUTIONS. 10. III- pH de solutions aqueuses. La mesure du pH d'une solution aqueuse permet de la classer comme solution acide ou basique. Par ...
 Cours module : CHIMIE DES SOLUTIONS- S2 -2021-2022 – Pr M
Cours module : CHIMIE DES SOLUTIONS- S2 -2021-2022 – Pr M
Le thème central est le calcul du pH d'une solution en fonction de la concentration en acide ou en base. *Définir la complexation et la solubilité d'un soluté.
 La chimie une solution pour lavion de demain ?
La chimie une solution pour lavion de demain ?
7 févr. 2020 LA CHIMIE UNE SOLUTION. POUR L'AVION DE DEMAIN ? Arnaud Charles
 Stéphane Mathé
Stéphane Mathé
Pour cette raison le premier chapitre est consacré à l'exposé des notions importantes pour la chimie des solutions. Définition : pH
 Cours et exercices de chimie des solutions
Cours et exercices de chimie des solutions
On parle ainsi d'une solution aqueuse lorsque le solvant est de l'eau. Ceci est particulièrement le cas des solutions dans tous les systèmes vivants.
 L1 Chimie
L1 Chimie
28 sept. 2023 Cette UE introduit les notions de base de la chimie générale (thermochimie et réactions en solution aqueuse). A l'issue de cet enseignement ...
 Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Département de Chimie Cours Chimie des Solutions ... La concentration molaire d'une espèce chimique en solution CA est la quantité de matière de.
 La Chimie en solution
La Chimie en solution
On pourra calculer la différence de pH observée dans deux solutions acides de même concentration en H+ (mais de force ionique différente liée à la présence ou
 Cours de chimie en solution Les acides et les bases
Cours de chimie en solution Les acides et les bases
Une solution aqueuse est toujours le siège d'un équilibre chimique appelé équilibre d'autoprotolyse de l'eau. Cet équilibre s'interprète donc comme une
 Cours et exercices de chimie des solutions
Cours et exercices de chimie des solutions
On parle ainsi d'une solution aqueuse lorsque le solvant est de l'eau. Ceci est particulièrement le cas des solutions dans tous les systèmes vivants.
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Force des acides et des bases. 1.5. Constantes d'acidité et de basicité. 1.6. Coefficient de dissociation d'un acide faible : 2. CALCUL DE PH DES SOLUTIONS
 La chimie une solution pour lavion de demain ?
La chimie une solution pour lavion de demain ?
LA CHIMIE UNE SOLUTION. POUR L'AVION DE DEMAIN ? Arnaud Charles
 République Algérienne Démocratique et Populaire COURS DE
République Algérienne Démocratique et Populaire COURS DE
LMD Licences Chimie Analytique et Chimie pharmaceutique… Il couvre en cinq chapitres les bases de la Chimie en Solution. Ce module s'inscrit dans le
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
au cours « chimie des solutions » nécessaires à la compréhension des réactions en solution aqueuse
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
CHIMIE DES SOLUTIONS AQUEUSES Solution aqueuse : le solvant est l'eau . ... néiser la solution : on dit que l'eau à un caractère dispersant. Conclusion:.
 La chimie des solutions
La chimie des solutions
LA CHIMIE DES SOLUTIONS Si X est un soluté miscible en solution alors
COURS DE CHIMIE-PCSI/MPSI/TSI-
elfilalisaid@yahoo.fr Page -2- -SAID EL FILAI-Première partie
CHIMIE DES SOLUTIONS AQUEUSES
3CHAPITRE1
CHIMIE DES SOLUTIONS AQUEUSES
1.1 Description d'un système fermé en transformation chi-
mique1.1.1 États de la matière . Notion de transformation
- On rappelle que les trois états de la matière sont : solide,liquide et gaz. - On appelle phase un état d'un corps à une température et pression données.- On appelle transformation une évolution d'un système physicochimique d'un état d'équilibre
vers un autre état d'équilibre.On distingue trois types de transformation :
- Transformation chimique : C'est une transformation aux cours de laquelle il y a cassure de cer- taines liaisons et formation d'autres liaisons .CH4+2O2--??--2H2O+CO2
ExempleOxydation du methane
- Transformation nucléaire :C'est une transformation dansle noyau de l'atome.AZX--→A-4Z-2Y+42He
ExempleRadioactivitéα
- Transformation physique :C'est une transformation sans cassure de liaison entre les différents constituants du système physicochimique.SolideLiquideGaz
SublimationCondensation
Fusion
Solidification LiquéfactionVaporisation
ExempleTransformations physiques
51.1. DESCRIPTION D'UN SYSTÈME FERMÉ EN TRANSFORMATION CHIMIQUECOURS DE CHIMIE-PCSI/MPSI/TSI-
Dans le diagramme (P,T) on a :
TC P T TTTCP TP CSolide
Liquide
Gaz dPdT<0dPdT>0 T: point triple : coexistence des trois phases.C: Point critique, Au de là deTcon ne peut pas distinguer les phases liquide et vapeur; on parle
de l'état fluide.Pour l'eau :
T??????T
T=273,16K
PT=613PaC??????T
C=647,3K
PC=22,1.106Pa
Exemple
Pour tout changement d'état en diagramme (P,T) on adPdT>0 sauf pour l'eau, germanium, silicium,bismuth et l'antimoine où pour l'équilibre (S-L)on adP dT<0 (Voir courbe précédente)1.1.2 Grandeurs extensives et intensives
1.1.2.1 Définitions
Un système est dit :
?Isolé: s'il n'échange avec le milieu extérieur ni énergie ni matière. ?Fermé: s'il ne peut échanger avec le milieu extérieur que de l'énergie. ?Ouvert: s'il échange de la matière avec le milieu extérieur . ?Homogène: si toutes les variables thermodynamiques varient de manière continues ( eau+sel avant la saturation).?Hétérogène: certains paramètres varient de manière discontinus (exemple : eau+glace :varia-
tion de la masse volumiqueρ).?Isotrope: aucunes propriétés physiques ne dépendent de la direction(localement le système
présente une symétrie sphérique). ?Simple:ne possède pas de propriétés magnétiques et diéléctrique.1.1.2.2 Grandeurs extensives
Une variable est dite extensive s'elle peut être définie pourle système entier ou une partie
et qui dépend des dimensions du système, elles sont en général additives.D´efinitionVariable extensive
elfilalisaid@yahoo.fr Page -6- -SAID EL FILAI-1.1. DESCRIPTION D'UN SYSTÈME FERMÉ EN TRANSFORMATION CHIMIQUECOURS DE CHIMIE-PCSI/MPSI/TSI-
masse, volume, charge,le courant électrique nombre de particule, longueur, surface,ExempleVariable intensive
1.1.2.3 Grandeurs intensives
Une variable intensive est définie en chaque point du système(déduite d'une valeur moyenne )et elles ne sont pas additives.D´efinitionVariable intensive
T,P,σ,ρ, l'indice de réfraction,concentration, pH,···ExempleVariable intensive
1.1.2.4 Grandeurs intensives de composition d'une phase
Soit un système chimique (Σ) contenant les espècesAidont le nombre de moles estni.On définit :
- Concentration molaire de l'espèceAipar :C(Ai)=[Ai]=n(Ai)V=niV
AvecVle volume du systèmeΣ. La concentration molaire est exprimée en mole/L - Fraction molaire par : xi=x(Ai)=n(Ai)nT=ninTAvecnT=?
inile nombre de mole total du systèmeΣ.N.B :xisans unité
- Pression partielle du gazAi Pour un mélange de gaz parfait , formé des gazAi:Pi=niRTV
?T: la température absolue du système exprimé en kelvin (K) ?R: la constante des gaz parfaits exprimé dans le système internationale par : Jmol -1K-1 ?Comme nT=? inialors P=PT=? iPi ?De mêmePi=xiPT
C'est la loi de Dalton
Valable pour le gaz parfaits
RemarquesLoi de Dalton
elfilalisaid@yahoo.fr Page -7- -SAID EL FILAI-1.2. QUOTIENT DE LA RÉACTIONQR. CONSTANTE D'ÉQUILIBREKCOURS DE CHIMIE-PCSI/MPSI/TSI-
1.1.3 Transformation d'un système chimique
On modélise la transformation chimique entre les constituantsAetBpar une réaction chimique au cours de laquelle ils se forment les constituantsCetD; qu'on représente mathématiquement par :αA+βB(1)?(2)γC+δD
Avec :
?AetBles réactifs. ?CetDles produits. ?α,β,γetδles coefficients stoechiométriques. ?(1) le sens direct et (2) le sens indirect. Parfois on utilise l'écriture conventionnelle suivante : N? i=1ν iAi=0Avec la convention :
?νipositif pourAiproduit. ?νinégatif pourAiréactif.1.2 Quotient de la réactionQr. Constante d'équilibre K
1.2.1 L'avancement de la réactionξ
Soit la réaction :αA+βB(1)?(2)γC+δD(R) Lorsque le système évolue pendant le tempsdt, la quantité de matière varie. prenons l'exemple suivant :αA+βB(1)?(2)γC+δD
tonA(to)nB(to)nC(to)nD(to) to+dt nA(to+dt)nB(to+dt)nC(to+dt)nD(to+dt)Sinr´eactif(to)
Sinr´eactif(to)>nr´eactif(to+dt)??nproduit(to) la variation élémentaire de la quantité de matière de l'élémentX, qui peut être positiveou négative. Cette quantité est indépendante des constituantsAi; elle caractérise le déroulement de la réaction On appelle le quotient de la réaction avectoutes les espèces sont en solution diluéela grandeur On tire que le quotient de la réaction est une grandeur sans dimension qui dépend des concentra- Lorsque le système évolue alors les concentrations varientjusqu'à l'avancement de la réaction atteint sa valeur limiteξ∞et les concentrations restent constantes : on dit que le système est dans K(T) : est une grandeur sans unité qui ne dépend que de la température , appelée constante d'équi- Soit une réaction chimique dont le quotient de la réaction estQret de constante d'équilibreK: Soient deux réactions chimiquesR1etR2chacune est caractérisée par sa constante d'équilibre ?Critère 100%: Un réaction est quantitative si 100% des réactifs vont réagir (c'est à direa=0). ?Critère 99%: Un réaction est quantitative si 99% des réactifs vont réagir (c'est à direa=1). ?Critère 90%: Un réaction est quantitative si 90% des réactifs vont réagir (c'est à direa=10). ?Critère 97%: Un réaction est quantitative si 97% des réactifs vont réagir (c'est à direa=3). Grâce a son moment dipolaire-→μ, l'eau solvate les particules chargées (cations et anions) Lorsque on met une soluté dans l'eau ces constituants (molécule ou ions)diffuse afin d'homogé- Grâce à son moment dipolaire-→μet sa constante diélectriqueεrélevés , l'eau est unOn pose :
dn(X)=nX(to+dt)-nX(to) 1.2. QUOTIENT DE LA RÉACTIONQR. CONSTANTE D'ÉQUILIBREKCOURS DE CHIMIE-PCSI/MPSI/TSI-
avecν >0 pour les produits etν <0 pour les réactifs. Donc pour la réaction (R) on a :
(α,β,γ,δ)?R?4+. 1.2.2 Le quotient de la réactionQr
Soit la réaction chimique :
ν?1?[A?2]Co?
ν?2···?[A1]
Co? ν1?[A2]Co?
ν2···=N
i=1? [A?i] Co? ν?i
N?i=1?
[Ai] Co? νi=Qr(T,t)
Avec :Co=1 mole/L la concentration standard.
Remarque
1.2.3 La constante d'équilibre K
On pose :
Qr(T,t→+∞)=Qeq(T)=N
i=1[A?i]ν?ieqN?i=1[Ai]νieq=K(T) C'est la loi d'action de masse dite aussi loi de Gulderberg etWaage . On définit lepKpar
pK=-logK??K=10-pK SiKest grand alorspKest petit et vice versa
elfilalisaid@yahoo.fr Page -9- -SAID EL FILAI- 1.3. PROPRIÉTÉS DE L'EAUCOURS DE CHIMIE-PCSI/MPSI/TSI-
1.2.4 Critère de l'évolution
Soit la réaction chimique :
αA+βB(1)?(2)γC+δD
Kdirect=1Kindirect
?Si on multiplie cette équation par un réelpalors :Kp=(K)p 1etK2alors :
?K(R1+R2)=K1×K2et?K(R1-R2)=K1K2Soitξl'avancement d'une réaction chimique : ?Siξ→ξmaxalors la réaction est dite totale ou quantitative. ?Siξ→ξmin=0 alors le système n'évolue pas : il est dans un état d'équilibre. Autrement dit :soit la réaction chimique :
A+B(1)?(2)C+D
n(t=0)100 100 0 0 n(t→ ∞)a a100-a100-a 100→+∞
99=99×99
1×1≈104
90=90×90
10×10≈100
97=97×97
3×3≈103
elfilalisaid@yahoo.fr Page -10- -SAID EL FILAI- 1.3. PROPRIÉTÉS DE L'EAUCOURS DE CHIMIE-PCSI/MPSI/TSI-
1.3 Propriétés de l'eau
8O:K(2)L(6)
?HOH=104.5◦,O-H=0.96Ao μ=1.86Davec 1D=1
310-29Cm?moment dipolaire est non nul : L'eau est une molécule polaire.
?La valeur du moment dipolaire est importante donc son pouvoir ionisant important. εr?80=?Feau=Fair
80: pouvoir dissociant important
Exemple:
Exemple:
solvatation de l'ion ferreuxFe2+par les les molécules d'eaux [Fe(H2O)6]2+ ABeau--→A+aq+B-aq
AB: électrolyte ou soluté
H 2O: solvant
Solution aqueuse : le solvant est l'eau .
Conclusion:
1.3. PROPRIÉTÉS DE L'EAUCOURS DE CHIMIE-PCSI/MPSI/TSI-
Pour le proton H+en solution aqueuse est toujours entouré par une molécule d'eau (hy- draté) selon la réaction : H ++H2OGGGGGGB F GGGGGG H3O+ Remarque
elfilalisaid@yahoo.fr Page -12- -SAID EL FILAI- 1.4. RÉACTIONS ACIDO-BASIQUESCOURS DE CHIMIE-PCSI/MPSI/TSI-
1.4 RÉACTIONS ACIDO-BASIQUES
1.4.1 Définitions
?un acide de Bronsted est une espèce moléculaire ou ionique susceptiblede donner un proton H+ ou de provoquer la liberation d'un proton du solvant . A?H++B
acide particule´echang´ee base A et B forment un couple acide base qu'on noteA/B
HBr--??--H++Br-
HNO 3--??--H++NO-
3 NH+4--??--H++NH3
C 6H5OH--??--H++C6H5O-
CO 2+H2O--??--H++HCO-
3 Cu2++2H2O--??--2H++Cu(OH)2
Exemples
Remarque
?L'acide phosphorique est un triacide (polyacide). H 3PO4H+--??--+H2PO-
4 H 2PO- 4--??--H++HPO2-
4 HPO2- 4--??--H++PO3-
4 ?l'acide sulfurique H2SO4est diacide. H 2SO4--??--H++HSO-
4 HSO-4--??--H++SO2-4
?une base de Bronsted est une espèce moléculaire ou ionique susceptible de capter un proton. Exemple
NH3+H+?NH+
4CO2- H2PO-
4, HPO2-
4jouent le rôle d'un acide et d'une base :ampholyte ou amphotère
CO2-
3est une dibase.
Conclusion:
Toute réaction acido-basique résulte de l'échange de la particuleH+entre l'acide d'un couple et la base d'un autre couple. elfilalisaid@yahoo.fr Page -13- -SAID EL FILAI- 1.4. RÉACTIONS ACIDO-BASIQUESCOURS DE CHIMIE-PCSI/MPSI/TSI-
Exemple
CH3COOH?H++CH3COO-
NH 4?NH3+H+?
=?CH3COOH+NH3?NH+ 4+CH3COO-
D'une façon générale l'équation d'une réaction acidobasique s'écrit : A1+B2?B1+A2
?L'eau qui joue le rôle du solvant présente deux couples acide-base : ?H3O+/H2O : H3O+--??--H++H2O ?H2O/OH-: H2O--??--H++OH- On conclut que l'eau est un amphotère (ou ampholyte) ?pH d'une solution: On définit le pH d'un solution dilué par :
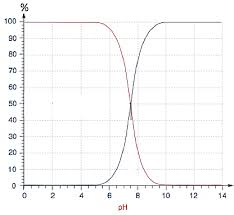
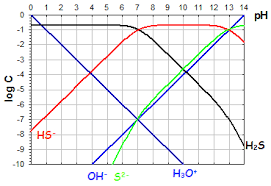
pH=-log[H3O+]Co avecCo=1molL-1; Qu'on peut écrire : pH=-log[H3O+]=-logh avech=[H3O+]. Remarque
H3O+]en molL-1.
H3O+représente H+solvaté en effet
H3O+--??--H++H2O
LepHde l'eau pure à 25oCest égal à 7. donc [H3O+]=[OH-]=10-7molL-1 Le produit ionique de l'eauKe=[H3O+][OH-]=10-14ne dépend que de la température pKe=-logKe=pH+pOH(=14à 25oC) avecpOH=-log[OH-] pH+pOH=pKe 1.4.2 Constante d'acidité KA
Soit la réaction acide-base :HA+H2O--??--H3O++A- K[H2O]=[H3O+][A-][HA]=KA
elfilalisaid@yahoo.fr Page -14- -SAID EL FILAI- 1.4. RÉACTIONS ACIDO-BASIQUESCOURS DE CHIMIE-PCSI/MPSI/TSI-
les concentrations en molL-1et le solvant est l'eau. K Aconstante d'acidité fonction uniquement de la température. On définit lepKAd'un couple A/B comme :
pKA=-logKA=?KA=10-pKA Exemple:l'eau est un amphotère
?(H3O+/H2O) :?H3O++H2O--??--H3O++H2O A 1+B2--??--A2+B1
K A(H3O+/H2O)=[H3O+]
[H3O+]=1=? pKA(H3O+/H2O)=0 ?(H2O/OH-) :???????H 2O+H2O--??--H3O++OH-
A 1+B2GGGGGGB F GGGGGG A2+B1
K A(H2O/OH-)=[H3O+][OH-]=10-14=?
pKA(H2O/OH-)=14 Remarque
quotesdbs_dbs27.pdfusesText_33
[PDF] Chimie organique_exercices - Chimie - PCSI
[PDF] Licence de Chimie
[PDF] Chimie inorganique - Numilog
[PDF] Chimie 1ère année INTRODUCTION
[PDF] Nomenclature en chimie minérale
[PDF] Chimie MP PT
[PDF] Chimie Tout-en-un MPSI-PTSI - 2e éd
[PDF] chimie organic #259
[PDF] CHIMIE ORGANIQUE PCEM1 Isomérie - Chimie Sup
[PDF] CHM 2520 Chimie organique II
[PDF] COR 301 Chimie Organique II La Chimie du Carbonyle et des
[PDF] Chimie organique en 25 fiches - Numilog
[PDF] organique - Fides Éducation
[PDF] Science de la Matiere ChimieS5 Chimie organique fonctionnelle
