Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions -.
 I. SITUATION DAPPRENTISSAGE II. CONTENU DE LA LEÇON
I. SITUATION DAPPRENTISSAGE II. CONTENU DE LA LEÇON
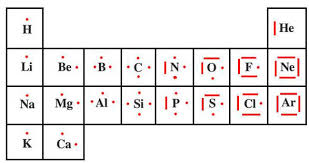
Au cours des réactions chimiques les atomes réagissent pour obtenir une structure électronique plus Cite les ions polyatomiques parmi les ions suivants : SO4.
 Spectrométrie démission dions secondaires. Secondary Ions Mass
Spectrométrie démission dions secondaires. Secondary Ions Mass
.ions polyatomiques hétéronucléaires (composés): (AmBn). +. . (AmBn). -. (< 1 .Canons à ions (émission thermo-ionique) - Ions de gaz rares. Ar. +.
 Atome molécule et ion - Guillotine et tsunami
Atome molécule et ion - Guillotine et tsunami
Il existe aussi des ions polyatomiques : c'est une molécule qui a gagné ou perdu un ou plusieurs électrons. Voici quelques exemples : Nom ion nitrate ion
 Les matériaux et lélectricité
Les matériaux et lélectricité
Un ion monoatomique est constitué d'un seul atome. ○ Un ion polyatomique est constitué par un ensemble d'atomes. * Exemples : Les cations.
 Untitled
Untitled
- un ion polyatomique est un groupe d'atome ayant perdu ou capturé un ou plusieurs électrons. - Les ions monoatomiques. - Les cations. Un cation est un ion
 cours : Atomes et molécules
cours : Atomes et molécules
On ne regarde que la géométrie de l'atome considéré avec ses liaisons. Une double liaison compte comme une simple liaison. V- ions poly-atomiques. Pour
 Grandeurs physiques pour caractériser un système initial
Grandeurs physiques pour caractériser un système initial
Pour un ion polyatomique la masse molaire est égale à la somme des masses molaires des atomes qui composent l'ion. Exemple : M(H+) = 1 g.mol-1 ; M(S2-) 32
 Chapitre 4 : Structure et polarité des espèces chimiques
Chapitre 4 : Structure et polarité des espèces chimiques
ion polyatomique . . . . . . . . . . . 33. 4.2 Géométrie des molécules et ions polyatomiques . . . . . . . . . . . . . . . 33. 4.3 Polarité d'une molécule ...
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions
 Chapitre 4 : Structure et polarité des espèces chimiques
Chapitre 4 : Structure et polarité des espèces chimiques
4.1.3 Schéma de Lewis d'une molécule ou d'un ion polyatomique . . . . . . . . . . . 33. 4.2 Géométrie des molécules et ions polyatomiques .
 Fiche de synthèse n°3.a Nombres doxydation
Fiche de synthèse n°3.a Nombres doxydation
Page 2. ? Pour les ions polyatomiques la somme des nombres d'oxydation est égale à la charge portée par cet ion. Exemple : ion hydroxyde HO-. n.o(H) = +I.
 MÉCANISME DE FORMATION DIONS POLYATOMIQUES
MÉCANISME DE FORMATION DIONS POLYATOMIQUES
01?/01?/1984 MÉCANISME DE FORMATION D'IONS POLYATOMIQUES SECONDAIRES. ... (1) On suppose qu'il existp tout au cours du phénomène un centre de nucléation ...
 CH III) Constitution de la matière : les ions
CH III) Constitution de la matière : les ions
D. GENELLE Cours Constitution de la matière Les ions Page 1/3 Un ion polyatomique est un édifice chimique électriquement chargé formé de plusieurs.
 QCM relatif au « Cours 16 Lénergie »
QCM relatif au « Cours 16 Lénergie »
QCM relatif au cours « STRUCTURE ELECTRONIQUE DES IONS » Dans un ion il existe autant de charge positive que négative : ... d - un cation polyatomique.
 Structure de Lewis II
Structure de Lewis II
tridimensionnelles des molécules ou des ions polyatomiques dont on a d'abord construit les diagrammes de Lewis. Au cours d'une séance de travail on peut.
 1ére Année de lenseignement secondaire
1ére Année de lenseignement secondaire
un cours illustré de nombreux documents (schémas
 02.schema-de-lewis.pdf
02.schema-de-lewis.pdf
Représentation de Lewis des ions. B : Mésomérie Un atome faisant partie d'un ion polyatomique va porter une charge formelle s'il n'est pas entouré.
 Chapitre 4 : le modèle de latome
Chapitre 4 : le modèle de latome
2) les ions polyatomiques Un ion monoatomique est un atome qui a perdu ou ... Au cours du XX° siècle les scientifiques ont élaboré.
Isabelle Prigent
Chimie et développement durable Terminale STL SPCL Partie 2/ Synthèses chimiques
A : Représentation de Lewis
1. Représentation de Lewis des atomes
2. Représentation de Lewis des molécules
3. Représentation de Lewis des ions
B : Mésomérie
1. Délocalisation des électrons
2. Forme la plus stable
P 1 P 1 P 2 P 3 P 4A : Représentation de Lewis
Gilbert Newton Lewis 1875-1946) professeur à
deux atomes point : ils sont dits " célibataires ». regroupés par 2 et sont représentés par des traits, appelés " doublets non liants ». Ź Ź2). Représentation de Lewis des molécules tous les électrons externes de ces atomes, regroupés par paires, par doublets : covalentes) sont appelés " doublets liants ». externes ne participant pas à une liaison chimique, sont appelés " doublets non liants »Isabelle Prigent
Ź Ź3). Représentation de Lewis des ions
Pour déterminer la charge formelle :
ionique (3) On en déduit le nombre total de doublets (liants en non liants) :électrons de valence
doubletsnbnb2 (5) On positionne les charges formelles formelles sont les moins nombreusesH Z = 1 K1 1s1 1 électron de valence
O Z = 8 K2L6 1s22s22p4 6 électrons de valence
3 (1) 1 (6) 1 8
Dans le calcul du nombre total de valence, on doit tenir compte : chacun 1 électron de valence)électrons de valence)
Nombre de doublets :
électrons de valence
doublets nb8nb 4 doublets22Isabelle Prigent
Position des charges formelles
Électrons de valence dans
Electrons " en propre » dans
H 1 e- 1 liaison : 1 e- 1 ʹ 1 = 0
O 6 e- 3 liaisons : 3 e-
1 doublet : 2 e- 6 ʹ 5 = 1
Ź Ź1). Délocalisation des électrons
des doubles liaisons et des atomes avec des doublets non-liants.Dans ces édifices, les électrons des doubles liaisons et des doublets non liants peuvent se déplacer :
on parle de délocalisation des électronsLes différentes formes mésomères sont obtenues par des déplacements successifs de doublet d'électrons
symbolisés par des flèches.(C, N, O, F), et de 2 autour de H. Les éléments de la 3ième période (et les suivantes) peuvent être
hypervalents (plus de 4 doublets) - On peut être amené à modifier le schéma de Lewis des éléments = 5 e-Isabelle Prigent
Ź Ź2). Forme la plus probable
plus probable ; Les autres formes ont parfois un intérêt pour expliquer la réactivité des composés.
Parmi les différentes formes mésomères écrites, la forme la plus probable : mésomères, certains atomes ont 6 e-)- est la forme possédant le moins de charge formelle. Les charges formelles doivent être réduites
au maximum. Les charges formelles négatives doivent être portées par les atomes les plus
électronégatifs.
Exemple 1 : Le butadiène
Il existe donc 2 représentations de Lewis pour le butadièneLa forme mésomère la plus probable est la 1ère car elle ne contient pas de charges et dans la 2nde forme le
carbone C+ ne possède que 6 électronsExemple 2 : Le but-3-èn-2-one
La forme la plus probable est la 1ère car :
- la 1ère forme ne possède pas de charge. - la 3ième forme possède un atome de carbone entouré que de 6 électronsquotesdbs_dbs46.pdfusesText_46[PDF] Les ions probleme 3eme
[PDF] Les ions, pour les pro
[PDF] les ions-interactions fondamentale
[PDF] les isitopes ; element chimique
[PDF] Les isomères d'une molécules
[PDF] Les isotopes d'hydrogene
[PDF] Les isotopes de l'hydrogène
[PDF] les isotopes de l'uranium
[PDF] les isotopes de l'hydrogène exercice
[PDF] les italiens a new york
[PDF] les italiens victimes de la xenophobie caricature
[PDF] les jardins d'agadir club marmara
[PDF] les jardins d'agadir contact
[PDF] les jardins d'agadir immobilier