 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions -.
 I. SITUATION DAPPRENTISSAGE II. CONTENU DE LA LEÇON
I. SITUATION DAPPRENTISSAGE II. CONTENU DE LA LEÇON
Au cours des réactions chimiques les atomes réagissent pour obtenir une structure électronique plus Cite les ions polyatomiques parmi les ions suivants : SO4.
 Spectrométrie démission dions secondaires. Secondary Ions Mass
Spectrométrie démission dions secondaires. Secondary Ions Mass
.ions polyatomiques hétéronucléaires (composés): (AmBn). +. . (AmBn). -. (< 1 .Canons à ions (émission thermo-ionique) - Ions de gaz rares. Ar. +.
 Fiche 2: Représentation de Lewis des espèces chimiques
Fiche 2: Représentation de Lewis des espèces chimiques
Représentation de Lewis des ions. • Un atome faisant partie d'un ion polyatomique va porter une charge formelle s'il n'est pas entouré du même nombre d
 Atome molécule et ion - Guillotine et tsunami
Atome molécule et ion - Guillotine et tsunami
Il existe aussi des ions polyatomiques : c'est une molécule qui a gagné ou perdu un ou plusieurs électrons. Voici quelques exemples : Nom ion nitrate ion
 Les matériaux et lélectricité
Les matériaux et lélectricité
Un ion monoatomique est constitué d'un seul atome. ○ Un ion polyatomique est constitué par un ensemble d'atomes. * Exemples : Les cations.
 Untitled
Untitled
- un ion polyatomique est un groupe d'atome ayant perdu ou capturé un ou plusieurs électrons. - Les ions monoatomiques. - Les cations. Un cation est un ion
 cours : Atomes et molécules
cours : Atomes et molécules
On ne regarde que la géométrie de l'atome considéré avec ses liaisons. Une double liaison compte comme une simple liaison. V- ions poly-atomiques. Pour
 Grandeurs physiques pour caractériser un système initial
Grandeurs physiques pour caractériser un système initial
Pour un ion polyatomique la masse molaire est égale à la somme des masses molaires des atomes qui composent l'ion. Exemple : M(H+) = 1 g.mol-1 ; M(S2-) 32
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions
 Chapitre 4 : Structure et polarité des espèces chimiques
Chapitre 4 : Structure et polarité des espèces chimiques
4.1.3 Schéma de Lewis d'une molécule ou d'un ion polyatomique . . . . . . . . . . . 33. 4.2 Géométrie des molécules et ions polyatomiques .
 Fiche de synthèse n°3.a Nombres doxydation
Fiche de synthèse n°3.a Nombres doxydation
Page 2. ? Pour les ions polyatomiques la somme des nombres d'oxydation est égale à la charge portée par cet ion. Exemple : ion hydroxyde HO-. n.o(H) = +I.
 MÉCANISME DE FORMATION DIONS POLYATOMIQUES
MÉCANISME DE FORMATION DIONS POLYATOMIQUES
01?/01?/1984 MÉCANISME DE FORMATION D'IONS POLYATOMIQUES SECONDAIRES. ... (1) On suppose qu'il existp tout au cours du phénomène un centre de nucléation ...
 CH III) Constitution de la matière : les ions
CH III) Constitution de la matière : les ions
D. GENELLE Cours Constitution de la matière Les ions Page 1/3 Un ion polyatomique est un édifice chimique électriquement chargé formé de plusieurs.
 QCM relatif au « Cours 16 Lénergie »
QCM relatif au « Cours 16 Lénergie »
QCM relatif au cours « STRUCTURE ELECTRONIQUE DES IONS » Dans un ion il existe autant de charge positive que négative : ... d - un cation polyatomique.
 Structure de Lewis II
Structure de Lewis II
tridimensionnelles des molécules ou des ions polyatomiques dont on a d'abord construit les diagrammes de Lewis. Au cours d'une séance de travail on peut.
 1ére Année de lenseignement secondaire
1ére Année de lenseignement secondaire
un cours illustré de nombreux documents (schémas
 02.schema-de-lewis.pdf
02.schema-de-lewis.pdf
Représentation de Lewis des ions. B : Mésomérie Un atome faisant partie d'un ion polyatomique va porter une charge formelle s'il n'est pas entouré.
 Chapitre 4 : le modèle de latome
Chapitre 4 : le modèle de latome
2) les ions polyatomiques Un ion monoatomique est un atome qui a perdu ou ... Au cours du XX° siècle les scientifiques ont élaboré.
Chapitre 4
Structure et polarité des espèces
chimiques4.1 Structure et schéma de Lewis des espèces chimiques . . . . . . . . . . . .324.1.1 Configuration électronique des éléments chimiques . . . . . . . . . . . . . . . .
324.1.2 Schéma de Lewis d"un atome ou d"un ion monoatomique . . . . . . . . . . . . .
324.1.3 Schéma de Lewis d"une molécule ou d"un ion polyatomique . . . . . . . . . . .
334.2 Géométrie des molécules et ions polyatomiques . . . . . . . . . . . . . . .
334.3 Polarité d"une molécule . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
344.3.1 Electronégativité d"un atome . . . . . . . . . . . . . . . . . . . . . . . . . . . .
344.3.2 Polarisation d"une liaison covalente . . . . . . . . . . . . . . . . . . . . . . . . .
354.3.3 Polarité d"une molécule . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3534Chapitre 4.Structure et polarité des espèces chimiquesC
echapitre est le premier d"un ensemble portant sur la structure et les propriétés de la matière.
Les connaissances de seconde concernant la structure des atomes et des ions sont indispensablesà la compréhension de cette partie.
Dans un premier temps il sera rappelé comment se définit la structure électronique d"un élément chi-
mique ou d"un ion monoatomique, notamment en précisant la notation exigible du nouveau programme.La structure des molécules et des ions polyatomiques sera détaillée, en particulier leur géométrie. Enfin
la notion de polarité d"une molécule chimique sera expliquée, posant ainsi les bases permettant d"ap-
préhender certaines propriétés des espèces chimiques, de leur cohésion et de leur capacité à interagir
entre elles.Tous les phénomènes décrits ici et dans les deux chapitres suivants permettent, sans le dire, d"amorcer
la compréhension des interactions entre les différentes espèces chimiques pouvant mener à certaines
réactions chimiques. Le lien s"établit alors avec les premiers chapitres de l"année concernant l"étude et
le suivi des transformations chimiques.4.1 Structure et schéma de Lewis des espèces chimiques
4.1.1 Configuration électronique des éléments chimiques
Dans l"ancien programme de seconde, la configuration électronique des éléments chimiques était intro-
duite avec les couchesK,LetM, qui correspondaient respectivement aux trois premières périodes de
la classification périodique. Le modèle réel, dicté par la règle de Klechkowski, décrit de manière plus
fine la façon dont se remplissent les sous-couches électroniques pour chaque élément chimique.
On fait correspondre les numéros 1, 2, 3 etc. correspondant aux couches principalesK,LetM(pé- riodes du tableau périodique). Ensuite pour chaque couche il y a des sous-couches :spour les deuxpremières colonnes,ppour les six dernières, mais aussid,fpour les blocs centraux de la classification
(hors programme).On se limitera ici aux trois premières périodes (1, 2 et 3) et aux sous-couchessetp. Les sous-couchess
peuvent accueillir deux électrons, alors que les sous-couchesppeuvent en accueillir six. Le remplissage
pour chaque élément chimique se fait comme pour les couchesK,LetMde l"ancien modèle, à savoir
de la couche la plus basse à la couche la plus haute :1s22s22p63s23p6comme le montre la classification
périodique réduite aux trois premières périodes sur la figure 4.3à la fin du c hapitre.
4.1.2 Schéma de Lewis d"un atome ou d"un ion monoatomique
Comme vu dans le programme de seconde, tous les éléments chimiques de la classification périodique
sont des atomes, constitués d"un noyau (protons et neutrons) et d"électrons.Les ions monoatomiques sont des atomes ayant perdu ou gagné un ou plusieurs électrons, de sorte à
obtenir la configuration électronique du gaz rare le plus proche dans la classification, avec une couche
externe saturée en électrons.Afin de représenter les atomes ou les ions monoatomiques en tenant compte de la structure électronique
de lacouche externe, on utilise lareprésentation de Lewis. Undoublet non liantcorrespond à un doublet d"électrons de la couche externe d"un atome,qui n"intervient pas dans une liaison avec une autre espèce. On représente les doublets non-liants
dans la représentation de Lewis par un trait(-).Poisson Florian Spécialité Physique-Chimie 1
ère
4.2.Géométrie des molécules et ions polyatomiques35Unélectron célibataire(donc pas un doublet), est un électron de la couche externe qui
n"intervient pas dans une liaison chimique, on le représente par un point().Unelacune électroniquecorrespond à une couche électronique restée vide pour un atome ou
un ion. La représentation de Lewis met en évidence ces lacunes à l"aide d"un rectangle.Exemples:
Atome ou ionSymboleStructure électroniqueFormule de LewisIon magnésiumMg
2+1s22s22p6Mg
2+CarboneC1s22s22p2C
Ion oxygèneO
2-1s22s22p6O2-
4.1.3 Schéma de Lewis d"une molécule ou d"un ion polyatomique
A plus grande échelle, les atomes et les ions monoatomiques peuvent s"associer pour former des molé-
cules par l"intermédiaire de liaisons. Il existe plusieurs types de liaisons selon la nature de l"interaction
entre les deux entités : lesliaisons covalentes: deux atomes fournissent chacun un électron pour former un doublet liant. lesliaisons ioniques: un cation et un anion se lient entre eux par l"intermédiaire d"une interaction électrostatique.lesliaisons métalliques:Hors Programme
lesliaisons hydrogène:voir chapitre suivant lesliaisons de Van der Waals:voir chapitre suivantLorsque les atomes ou ions monoatomiques s"associent pour former des molécules, ils le font de manière
à ce que chaque atome ait laconfiguration électronique du gaz rare le plus proche.Les ions polyatomiques sont des molécules possédant une charge car un ou plusieurs atomes la com-
posant ont gagné ou perdu un ou plusieurs électrons.Exemples:
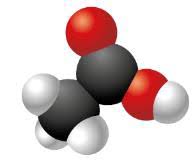
Molécule ou ionEthanolIon carbonateIon éthanoateAlanine ZwitterionFormule bruteC
2H6OCO
32-C2H3O2-C
3H7NO2±Formule de LewisH
3CCH 2OHC? O? OO C CH 3O OCH N ?H 3CH 3C O? O4.2 Géométrie des molécules et ions polyatomiques
Au sein d"une molécule, les doublets liants et non liants se répartissent dans l"espace de sorte à être
les plus éloignés les uns des autres. Ainsi, pour une entité donnée, la géométrie autour d"un atome
donné va dépendre du nombre de doublets liants et non liants qui l"entourent, ainsi que du nombre de
liaisons simples, doubles ou triples. Dans le cas des éléments chimiques des trois premières périodes,
le nombre maximal de doublets autour d"un atome est de 4 (soit4×2 = 8électrons) (règle de l"octet
dans l"ancien programme).Les liaisons covalentes entre les différents atomes peuvent êtresimples, doubles ou triples.Spécialité Physique-Chimie 1
èrePoisson Florian
36Chapitre 4.Structure et polarité des espèces chimiquesLe tableau suivant présente la géométrie autour d"un atome en fonction du nombre de doublets en-
tourant l"atome, et de la nature de la liaison, à savoir si elle est simple, double ou triple. On noteD
le nombre de doublets entourant l"atome,DNLle nombre de doublets non-liants,DLle nombre de doublets liants.Nombre de doubletsD= 2dont2DLet0DNLD= 3dont
3DLet0DNLD= 4dont
4DLet0DNLNom de la
géométrieLinéaireTriangulaire planeTétraédriqueReprésentation
spatialeNombre de doubletsD= 4dont3DLet1DNLD= 4dont
2DLet2DNLNom de la
géométriePyramidale triangulaireCoudéeReprésentation
spatialeDans le cas où l"on a 4 doublets liants (donc 0 non liants) avec une double liaison, la géométrie sera
triangulaire plane :C HH CH HSi l"on a 4 doublets liants (dont 0 non liants) avec une triple liaison, la géométrie sera linéaire :
HCCH4.3 Polarité d"une molécule
4.3.1 Electronégativité d"un atomeElectronégativité
L"Electronégativitéχ(prononcée " khi » ) d"un atome est la grandeur qui caractérise la capacité
de cet atome à attirer les électrons vers lui au sein d"une liaison chimique avec un autre atome.
Plus l"électronégativité est élevée, plus l"atome attire les électrons vers lui.Poisson Florian Spécialité Physique-Chimie 1
ère
4.3.Polarité d"une molécule37Figure 4.1- Evolution de l"électronégativité pour les éléments des trois premières périodes de la classification
périodique4.3.2 Polarisation d"une liaison covalentePolarisation d"une liaison covalente
Lorsque la différence d"électronégativité entre deux atomesAetBest supérieure à 0,4 on dit
que la liaison estpolarisée.L"atome le plus électronégatif porte alors une charge partielle notéeδ-et l"atome le moins
électronégatif porte une charge partielle notéeδ+.Exemples : Polarisation de quelques liaisons
Figure 4.2- Polarisation des liaisons carbone-oxygène, carbone-hydrogène et oxygène-hydrogène
4.3.3 Polarité d"une molécule
Au sein d"une molécule, plusieurs liaisons peuvent être polarisées. On définit lesbarycentres géo-
métriquesG+etG-respectivement des charges partiellesδ+etδ-.Polarité d"une molécule Une molécule est ditepolairesi elle vérifie deux critères : La molécule possède des liaisons polarisées. Les barycentresG+etG-ne sont pas confondus par symétrie. Dans le cas contraire, on dit que la molécule estapolaire.Spécialité Physique-Chimie 1èrePoisson Florian
38Chapitre 4.Structure et polarité des espèces chimiquesExemples:
Nom de la moléculeTétrachlorométhane
CCl 4Eau H2OReprésentation de la
moléculeLiaisons polarisées et centres de symétrieLiaisons polarisées G +=G-Liaisons polarisées G +?=G-Polarité de la moléculeApolairePolaire Poisson Florian Spécialité Physique-Chimie 1ère
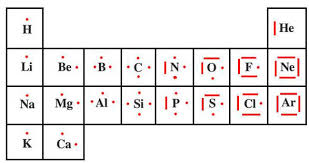
4.3.Polarité d"une molécule39Classification périodique réduite aux trois premières périodes
11.0079
HHydrog`ene
1s136.941
LiLithium
[He]2s11122.990 NaSodium
[Ne]3s149.0122 BeB´eryllium
[He]2s21224.305 MgMagn´esium
[Ne]3s2510.811 B Bore [He]2s22p11326.982 AlAluminium
[Ne]3s23p1612.011 CCarbone
[He]2s22p21428.086 SiSilicone
[Ne]3s23p2714.007 N Azote [He]2s22p31530.974 PPhosphore
[Ne]3s23p3815.999 OOxyg`ene
[He]2s22p41632.065 SSoufre
[Ne]3s23p4918.998 F Fluor [He]2s22p51735.453 ClChlore
[Ne]3s23p51020.180 NeN´eon
[He]2s22p624.0025 HeH´elium
1s21839.948
Ar Argon [Ne]3s23p61 2 3Zmasse
Symbole
Nom config. electr.Tableau p´eriodiqueFigure 4.3
Spécialité Physique-Chimie 1
èrePoisson Florian
quotesdbs_dbs46.pdfusesText_46[PDF] Les ions probleme 3eme
[PDF] Les ions, pour les pro
[PDF] les ions-interactions fondamentale
[PDF] les isitopes ; element chimique
[PDF] Les isomères d'une molécules
[PDF] Les isotopes d'hydrogene
[PDF] Les isotopes de l'hydrogène
[PDF] les isotopes de l'uranium
[PDF] les isotopes de l'hydrogène exercice
[PDF] les italiens a new york
[PDF] les italiens victimes de la xenophobie caricature
[PDF] les jardins d'agadir club marmara
[PDF] les jardins d'agadir contact
[PDF] les jardins d'agadir immobilier
