 La polarité de la liaison covalente
La polarité de la liaison covalente
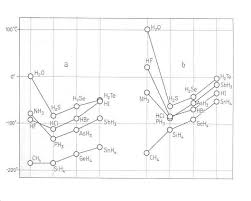
Liaisons polaires : Une liaison covalente est polaire si la différence des électronégativités des deux atomes formant la liaison n'est pas nulle . Exemples
 Liaisons chimiques
Liaisons chimiques
La liaison COVALENTE NORMALE POLARISÉE (05 < Δχ < 1
 La construction du concept de liaison covalente: une ingénierie
La construction du concept de liaison covalente: une ingénierie
11 oct. 2021 Une autre conception est décrite selon laquelle pour les élèves
 – Chapitre II – Les différents types de liaisons et leur influence sur
– Chapitre II – Les différents types de liaisons et leur influence sur
Ainsi la liaison covalente peut être vue comme le partage de deux électrons par les atomes liés
 la liaison covalente
la liaison covalente
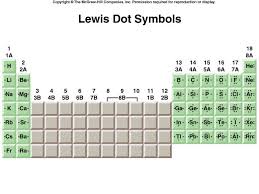
une structure de Lewis est une représentation des liaisons covalentes par la notation de Lewis où les doublets liants sont illustrés.
 Les liaisons chimiques
Les liaisons chimiques
Une liaison covalente est une liaison dans laquelle deux électrons sont partagés par deux atomes. Les composés covalents sont des composés qui ne contiennent
 Chapitre III : La liaison chimique (première partie )
Chapitre III : La liaison chimique (première partie )
Il existe deux types de liaison covalente a-Liaison covalente simple : Une liaison dont deux atomes A et B partagent deux électrons de leur couche externe (
 La liaison chimique Propriétés mécaniques
La liaison chimique Propriétés mécaniques
Solide dont la cohésion est due à la liaison covalente = solide covalent. Exemple : Caractéristiques : - matériaux résistants température de fusion élevée.
 Corrélation entre la liaison chimique et la structure des états vitreux
Corrélation entre la liaison chimique et la structure des états vitreux
4 févr. 2008 forme d'un verre céramique. 1. Rigidité des liaisons covalentes et ioniques. -. L'énergie des liaisons ioniques est aussi importante.
 ch.ci.3: la liaison covalente localisee (theorie de lewis)
ch.ci.3: la liaison covalente localisee (theorie de lewis)
Ce chapitre a pour but de décrire un modèle des liaisons chimiques covalentes. La première interprétation de la notion de liaison chimique dans les composés
 La polarité de la liaison covalente
La polarité de la liaison covalente
Liaisons polaires : Une liaison covalente est polaire si la différence des électronégativités des deux atomes formant la liaison n'est pas nulle . Exemples
 Liaisons chimiques
Liaisons chimiques
Liaison covalente normale polarisée. Mise en commun non équilibrée d'électrons (charges partielles). ?? >19. Liaison ionique. Formations d'ions et liens.
 Chapitre 3 41 Azote et fluor 1. a. Latome dazote établit trois liaisons
Chapitre 3 41 Azote et fluor 1. a. Latome dazote établit trois liaisons
1. a. L'atome d'azote établit trois liaisons covalentes et comporte un doublet non liant. Dans l'ion azoture trois atomes d
 – Chapitre II – Les différents types de liaisons et leur influence sur
– Chapitre II – Les différents types de liaisons et leur influence sur
La liaison covalente est obtenue par le recouvrement d'orbitales atomiques associées aux électrons de valence1 des atomes liés. Le recouvrement donne lieu à des
 Liaison covalente et géométrie
Liaison covalente et géométrie
Il forme alors une ou plusieurs liaisons covalentes. I) Modèle de Lewis. Le modèle de LEWIS permet de représenter les électrons de la couche externe des atomes.
 Science des matériaux
Science des matériaux
Solides atomiques à liaisons covalentes et ioniques Solide dont la cohésion est due à la liaison covalente = solide covalent. Exemple :.
 Liaison covalente : Illustration : Conséquence importante
Liaison covalente : Illustration : Conséquence importante
DE L'ATOME AUX MOLÉCULES. COMPRENDRE LES RÈGLES DE BASE DE CONSTRUCTION DES MOLÉCULES. I. LES LIAISONS ENTRE ATOMES : LA LIAISON COVALENTE.
 La chimie des polymères
La chimie des polymères
monomères (ou motifs monomères) reliées par des liaisons covalentes. La liaison covalente fonctionnelle du monomère est elle aussi schématisée dans la ...
 Chapitre 4 :La liaison chimique
Chapitre 4 :La liaison chimique
I La liaison de covalence. A) Définition. Une liaison covalente c'est la mise en commun d'une ou plusieurs paires d'électrons par deux atomes.
Chapitre 3
41 Azote et fluor
non liant se transforme en doublet liant, il porte donc une charge positive. Sur les deuxéléments azote des extrémités, un des doublets liants se transforme en doublet non liant ;
polyatomique comporte une charge négative. Le schéma de Lewis de ǯ azoture est le suivant :électrostatique, ces liaisons ǯ±- au maximum, et ǯ azoture est plan et linéaire.
2. Pour ǯ-" de fluor, on peut reprendre le schéma de Lewis établi précédemment,
avec un doublet non liant ǯ des deux éléments azote extrêmes qui devient liant avec
doublets non liants. Le schéma de Lewis du fluorure ǯ- est le suivant :3. a. ǯ""° ce qui a été écrit précédemment, on établit le schéma de Lewis du difluorure
de diazote :b. Autour de chaque atome ǯ-ǡ les liaisons et les doublets non liants sont au nombre
de trois : une liaison simple, une liaison double et un doublet non liant. Par répulsionélectrostatique, les liaisons et le doublet ǯ"-- dans un plan, espacés ǯ angle
ǯ" 120° les uns des autres. La molécule est donc coudée au niveau de chaque atome
Remarque : en réalité, ǯ entre la simple liaison et la double liaison vaut 111,4° car le
doublet non liant occupe beaucoup plus ǯ"... ǯ doublet liant.
Les deux atomes de fluor peuvent se trouver soit du même côté de la double liaison N=N, soit de part et ǯ-" :c. On vérifie avec un logiciel de représentation moléculaire que la molécule est bien plane,
Première configuration :
Deuxième configuration :
d. La liaison N=N est apolaire car reliant deux atomes identiques.Pour la liaison N-F, on calcule : ȟɖ = 3,98 Ȃ 3,04 = 0,94. Ainsi, 0,4 < ȟɖ < 1,7. La liaison N-
F est donc polaire. Le fluor est plus électronégatif que ǯ-ǡ donc chaque atome de
fluor porte une charge partielle Ɂ-, et chaque atome ǯ- porte une charge partielle Ɂ+.
Dans le cas où les deux atomes de fluor sont du même côté de la double liaison, lebarycentre des charges partielles positives se trouve entre les deux atomes ǯ-ǡ et le
barycentre des charges partielles négatives est équidistant des deux atomes de fluor, donc distinct du barycentre des charges partielles positives. Cette molécule est polaire.Dans le cas où les deux atomes de fluor sont de part et ǯ-" de la double liaison, les
barycentres des charges partielles positives et négatives sont confondus entre les deux atomes ǯ-ǡ donc la molécule est apolaire.quotesdbs_dbs47.pdfusesText_47[PDF] liaison dangereuse livre
[PDF] liaison dangereuse résumé
[PDF] liaison de van der waals exemple
[PDF] liaison de van der waals pdf
[PDF] Liaison entre Marjane Satrapi et l'Iran
[PDF] liaison et enchainement exercices
[PDF] liaison et enchainement phonétique
[PDF] liaison fatale
[PDF] liaison mécanique exercices corrigés
[PDF] liaison rs232 cours
[PDF] liaison série rs232
[PDF] liaison série rs232 pdf
[PDF] liaison série rs485
[PDF] Liaisons covalentes, doublets non liants, formule de Lewis
