 La polarité de la liaison covalente
La polarité de la liaison covalente
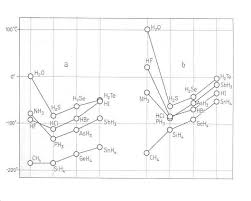
Liaisons polaires : Une liaison covalente est polaire si la différence des électronégativités des deux atomes formant la liaison n'est pas nulle . Exemples
 Liaisons chimiques
Liaisons chimiques
La liaison COVALENTE NORMALE POLARISÉE (05 < Δχ < 1
 La construction du concept de liaison covalente: une ingénierie
La construction du concept de liaison covalente: une ingénierie
11 oct. 2021 Une autre conception est décrite selon laquelle pour les élèves
 – Chapitre II – Les différents types de liaisons et leur influence sur
– Chapitre II – Les différents types de liaisons et leur influence sur
Ainsi la liaison covalente peut être vue comme le partage de deux électrons par les atomes liés
 la liaison covalente
la liaison covalente
une structure de Lewis est une représentation des liaisons covalentes par la notation de Lewis où les doublets liants sont illustrés.
 Les liaisons chimiques
Les liaisons chimiques
Une liaison covalente est une liaison dans laquelle deux électrons sont partagés par deux atomes. Les composés covalents sont des composés qui ne contiennent
 Chapitre III : La liaison chimique (première partie )
Chapitre III : La liaison chimique (première partie )
Il existe deux types de liaison covalente a-Liaison covalente simple : Une liaison dont deux atomes A et B partagent deux électrons de leur couche externe (
 La liaison chimique Propriétés mécaniques
La liaison chimique Propriétés mécaniques
Solide dont la cohésion est due à la liaison covalente = solide covalent. Exemple : Caractéristiques : - matériaux résistants température de fusion élevée.
 Corrélation entre la liaison chimique et la structure des états vitreux
Corrélation entre la liaison chimique et la structure des états vitreux
4 févr. 2008 forme d'un verre céramique. 1. Rigidité des liaisons covalentes et ioniques. -. L'énergie des liaisons ioniques est aussi importante.
 Pourquoi les glucides sont-ils solubles dans leau
Pourquoi les glucides sont-ils solubles dans leau
Liaison covalente et structure des molécules : eau alcanes et glucides entre autres. Savoir identifier la fonction chimique alcool. Solvant. Conseils de mise
 ch.ci.3: la liaison covalente localisee (theorie de lewis)
ch.ci.3: la liaison covalente localisee (theorie de lewis)
Ce chapitre a pour but de décrire un modèle des liaisons chimiques covalentes. La première interprétation de la notion de liaison chimique dans les composés
 La polarité de la liaison covalente
La polarité de la liaison covalente
Liaisons polaires : Une liaison covalente est polaire si la différence des électronégativités des deux atomes formant la liaison n'est pas nulle . Exemples
 Liaisons chimiques
Liaisons chimiques
Liaison covalente normale polarisée. Mise en commun non équilibrée d'électrons (charges partielles). ?? >19. Liaison ionique. Formations d'ions et liens.
 Chapitre 3 41 Azote et fluor 1. a. Latome dazote établit trois liaisons
Chapitre 3 41 Azote et fluor 1. a. Latome dazote établit trois liaisons
1. a. L'atome d'azote établit trois liaisons covalentes et comporte un doublet non liant. Dans l'ion azoture trois atomes d
 – Chapitre II – Les différents types de liaisons et leur influence sur
– Chapitre II – Les différents types de liaisons et leur influence sur
La liaison covalente est obtenue par le recouvrement d'orbitales atomiques associées aux électrons de valence1 des atomes liés. Le recouvrement donne lieu à des
 Liaison covalente et géométrie
Liaison covalente et géométrie
Il forme alors une ou plusieurs liaisons covalentes. I) Modèle de Lewis. Le modèle de LEWIS permet de représenter les électrons de la couche externe des atomes.
 Science des matériaux
Science des matériaux
Solides atomiques à liaisons covalentes et ioniques Solide dont la cohésion est due à la liaison covalente = solide covalent. Exemple :.
 Liaison covalente : Illustration : Conséquence importante
Liaison covalente : Illustration : Conséquence importante
DE L'ATOME AUX MOLÉCULES. COMPRENDRE LES RÈGLES DE BASE DE CONSTRUCTION DES MOLÉCULES. I. LES LIAISONS ENTRE ATOMES : LA LIAISON COVALENTE.
 La chimie des polymères
La chimie des polymères
monomères (ou motifs monomères) reliées par des liaisons covalentes. La liaison covalente fonctionnelle du monomère est elle aussi schématisée dans la ...
 Chapitre 4 :La liaison chimique
Chapitre 4 :La liaison chimique
I La liaison de covalence. A) Définition. Une liaison covalente c'est la mise en commun d'une ou plusieurs paires d'électrons par deux atomes.
Chimie
02 1) Liaison cavalente et géométrie
I) Liaison covalente
Chaque atome essaye de se stabiliser (avoir sa couche de valence pleine) en échangeant un ou plusieurs électrons. Il forme alors une ou plusieurs liaisons covalentes.I) Modèle de Lewis
Le modèle de LEWIS permet de représenter les électrons de la couche externe des atomes.I.1) Formule de LEWIS d'une molécule
a) A partir des formules de LEWIS des atomes On peut essayer de combiner les différentes formules en assemblant les atomes. Cette méthode peut IRQŃPLRQQHU SRXU OHV PROpŃXOHV VLPSOHV" PMLV SMV toujours. b) Méthode rigoureuse1) On compte le nombre total d'électrons sur les
couches externes des atomes2) On divise par 2, ce qui donne le nombre de liaisons
covalentes3) On respecte la règle de l'octet pour chaque atome en répartissant les liaisons
Exercice 1 :
Donner, en détaillant la méthode, les formules de LEWIS des molécules et ions suivants :H2 O2 Cl2 HCN H3O+
Dihydrogène H2 2x1 AE 2é AE 1 doublet
Dioxygène O2 2x6 AE 12é AE 6 doublets
Dichlore Cl2 2x7 AE 14é AE 7 doublets
Acide cyanhydrique HCN 1+4+5 AE 10é AE 5 doubletsIon oxonium H3O+ 3x1+6-1 AE 8é AE 4 doublets
I.2) Charge formelle
C'est la différence entre le nombre d'électrons que possède l'atome dans la molécule et le
nombre qu'il en a dans sa forme isolée (c'est-à-dire Z).Exercice 2 :
Donner, en détaillant la méthode, les formules de LEWIS des molécules et ions suivants :O3 CO NH4+ CO32-
Ozone O3 3x6 AE 18 é AE 9 doublets
Monoxyde de carbone CO 4+6 AE 10 é AE 5 doublets mais 2s1 2p3 plus stable que 2s2 2p2 GRQŃ"Ion ammoniac NH4+ 5+4x1-1 AE 8 é AE 4 doublets
Ions carbonate CO32- 4+3x6+2 AE 24 é AE 12 doubletsI.3) Quelques exceptions :
Chlorure
d'aluminium AlCl3 3+3x7 AE 26 é AE 12 doublets Une lacune, il sera très avide d'électrons AE acide de LewisPenta-chlorure
de phosphore PCl5 5+5x7 AE 40 é AE 20 doubletsLe phosphore a accès à la couche
3G"Dioxyde de
soufre SO2 6+2x6 AE 18 é AE 9 doublets Le soufre a accès à la couche 3d, il ne respecte pas l'octet !II) Géométrie des molécules
II.1) Théorie de Gillespie ou VSEPR
La VSEPR (Répulsion des Paires Electroniques de la Couche de Valence en anglais) prévoit la géométrie d'un édifice covalent à partir de sa représentation de Lewis. Principe : Un édifice polyatomique adopte la géométrie telle que les doublets électroniques qui entourent l'atome central soient les plus éloignés les uns des autres, ceci afin que les répulsions soient minimales (système plus stable). Selon le nombre de "voisins" (atome ou doublet non liant) la géométrie de l'atome central est donc connue. La notation permettant de connaitre le voisinage d'un atome sera alors :II.2) Exemples
Exercice 3 :
Donner, en détaillant la méthode, la géométrie des molécules et ions suivants :CO2 CO32- CH4 NH3 H2O PCl5
Nom Formule de
Lewis Type Géométrie Aspect
Dioxyde de carbone
(idem acide cyanhydrique) AX2 LinéaireIon carbonate
(idem SO2)AX3 Triangulaire
planeMéthane
AX4Tétraèdre
régulier109°
Ammoniaque
(idem ion oxonium)AX3E1 Tétraèdre
109°
Eau AX2E2 Molécule
coudéePenta-chlorure de
phosphoreAX5 Bipyramide
triangulairequotesdbs_dbs47.pdfusesText_47[PDF] liaison dangereuse livre
[PDF] liaison dangereuse résumé
[PDF] liaison de van der waals exemple
[PDF] liaison de van der waals pdf
[PDF] Liaison entre Marjane Satrapi et l'Iran
[PDF] liaison et enchainement exercices
[PDF] liaison et enchainement phonétique
[PDF] liaison fatale
[PDF] liaison mécanique exercices corrigés
[PDF] liaison rs232 cours
[PDF] liaison série rs232
[PDF] liaison série rs232 pdf
[PDF] liaison série rs485
[PDF] Liaisons covalentes, doublets non liants, formule de Lewis
