 La polarité de la liaison covalente
La polarité de la liaison covalente
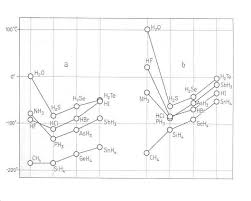
Liaisons polaires : Une liaison covalente est polaire si la différence des électronégativités des deux atomes formant la liaison n'est pas nulle . Exemples
 Liaisons chimiques
Liaisons chimiques
La liaison COVALENTE NORMALE POLARISÉE (05 < Δχ < 1
 La construction du concept de liaison covalente: une ingénierie
La construction du concept de liaison covalente: une ingénierie
11 oct. 2021 Une autre conception est décrite selon laquelle pour les élèves
 – Chapitre II – Les différents types de liaisons et leur influence sur
– Chapitre II – Les différents types de liaisons et leur influence sur
Ainsi la liaison covalente peut être vue comme le partage de deux électrons par les atomes liés
 la liaison covalente
la liaison covalente
une structure de Lewis est une représentation des liaisons covalentes par la notation de Lewis où les doublets liants sont illustrés.
 Les liaisons chimiques
Les liaisons chimiques
Une liaison covalente est une liaison dans laquelle deux électrons sont partagés par deux atomes. Les composés covalents sont des composés qui ne contiennent
 Chapitre III : La liaison chimique (première partie )
Chapitre III : La liaison chimique (première partie )
Il existe deux types de liaison covalente a-Liaison covalente simple : Une liaison dont deux atomes A et B partagent deux électrons de leur couche externe (
 La liaison chimique Propriétés mécaniques
La liaison chimique Propriétés mécaniques
Solide dont la cohésion est due à la liaison covalente = solide covalent. Exemple : Caractéristiques : - matériaux résistants température de fusion élevée.
 Corrélation entre la liaison chimique et la structure des états vitreux
Corrélation entre la liaison chimique et la structure des états vitreux
4 févr. 2008 forme d'un verre céramique. 1. Rigidité des liaisons covalentes et ioniques. -. L'énergie des liaisons ioniques est aussi importante.
 Pourquoi les glucides sont-ils solubles dans leau
Pourquoi les glucides sont-ils solubles dans leau
Liaison covalente et structure des molécules : eau alcanes et glucides entre autres. Savoir identifier la fonction chimique alcool. Solvant. Conseils de mise
 ch.ci.3: la liaison covalente localisee (theorie de lewis)
ch.ci.3: la liaison covalente localisee (theorie de lewis)
Ce chapitre a pour but de décrire un modèle des liaisons chimiques covalentes. La première interprétation de la notion de liaison chimique dans les composés
 La polarité de la liaison covalente
La polarité de la liaison covalente
Liaisons polaires : Une liaison covalente est polaire si la différence des électronégativités des deux atomes formant la liaison n'est pas nulle . Exemples
 Liaisons chimiques
Liaisons chimiques
Liaison covalente normale polarisée. Mise en commun non équilibrée d'électrons (charges partielles). ?? >19. Liaison ionique. Formations d'ions et liens.
 Chapitre 3 41 Azote et fluor 1. a. Latome dazote établit trois liaisons
Chapitre 3 41 Azote et fluor 1. a. Latome dazote établit trois liaisons
1. a. L'atome d'azote établit trois liaisons covalentes et comporte un doublet non liant. Dans l'ion azoture trois atomes d
 – Chapitre II – Les différents types de liaisons et leur influence sur
– Chapitre II – Les différents types de liaisons et leur influence sur
La liaison covalente est obtenue par le recouvrement d'orbitales atomiques associées aux électrons de valence1 des atomes liés. Le recouvrement donne lieu à des
 Liaison covalente et géométrie
Liaison covalente et géométrie
Il forme alors une ou plusieurs liaisons covalentes. I) Modèle de Lewis. Le modèle de LEWIS permet de représenter les électrons de la couche externe des atomes.
 Science des matériaux
Science des matériaux
Solides atomiques à liaisons covalentes et ioniques Solide dont la cohésion est due à la liaison covalente = solide covalent. Exemple :.
 Liaison covalente : Illustration : Conséquence importante
Liaison covalente : Illustration : Conséquence importante
DE L'ATOME AUX MOLÉCULES. COMPRENDRE LES RÈGLES DE BASE DE CONSTRUCTION DES MOLÉCULES. I. LES LIAISONS ENTRE ATOMES : LA LIAISON COVALENTE.
 La chimie des polymères
La chimie des polymères
monomères (ou motifs monomères) reliées par des liaisons covalentes. La liaison covalente fonctionnelle du monomère est elle aussi schématisée dans la ...
 Chapitre 4 :La liaison chimique
Chapitre 4 :La liaison chimique
I La liaison de covalence. A) Définition. Une liaison covalente c'est la mise en commun d'une ou plusieurs paires d'électrons par deux atomes.
DE L'ATOME AUX MOLÉCULES
COMPRENDRE LES RÈGLES DE BASE DE CONSTRUCTION DES MOLÉCULES I. LES LIAISONS ENTRE ATOMES : LA LIAISON COVALENTELiaison covalente :
Les atomes peuvent se lier les uns aux autres pour former des assemblages extrêmementvariés. Dans une molécule, les atomes sont reliés par une liaison appelée LIAISON COVALENTE.
Deux atomes forment une liaison covalente PAR LA MISE EN COMMUN DE DEUX ÉLECTRONS.Illustraition :
Ci-contre, deux atomes d'hydrogène séparés autour desquels on a fait figurer la couche occupée par leur unique électron. Les deux atomes d'hydrogène, liés pour former la molécule de dihydrogène H2. On a fait figurer la région occupée par les deux électrons mis en communs, ILS ORBITENTMAINTENANT AUTOUR DES DEUX NOYAUX.
Conséquence importante :
À chaque fois qu'un atome forme une liaison covalente, IL S'ENTOURE D'UNÉLECTRON SUPPLÉMENTAIRE.
Mulitiplicité des liaisons :
Les atomes peuvent former des liaisons covalentes, simples (mise en com- mun d'une paire d'électrons), doubles (mise en commun de deux paires d'électrons) ou triples (mise en commun de trois paires d'électrons).II. REPRÉSENTER UNE MOLÉCULE
Plusieurs types de formules ou de modèles peuvent être utilisés pour représenter une molécule. Chacun
d'entre eux donne plus ou moins de renseignements sur la structure ou la géométrie de la molécule. Le tableau
ci-dessous en regroupe quelques manières de représenter la même molécule.On prend l'exemple de L'ACIDE LACTIQUE.
Formule ou modèleReprésentationRenseignements apportésFORMULE BRUTEC3H6O3
FORMULE SEMI-DÉVELOPPÉE
ActiviteAtomeMolecules.odtModifié le 21/12/17Page 1 sur 4Deux atomes d'hydrogène séparés Molécule de dihydrogèneLiaison covalente simple entre deux atomes de carboneLiaison covalente double entre deux atomes de carboneLiaison covalente
doubleLiaison covalente simple Formule ou modèleReprésentationRenseignements apportésFORMULE DÉVELOPPÉE
MODÈLE MOLÉCULAIRE ÉCLATÉ
MODÈLE MOLÉCULAIRE COMPACT
III. PRÉVOIR L'AGENCEMENT DES ATOMES DANS UNE MOLÉCULE1. Analyse de l'agencement des atomes dans une molécule, noition de valence
1.On considère la molécule d'acide chloroéthanoïque dont on donne ci-dessous la formule semi-dévelop-
pée et le modèle moléculaire éclaté. a.Donner la formule brute de cette molécule. b.Dans cette molécule, combien de liaisons covalente forment : ✗Les atomes d'oxygène ? ✗Les atomes de carbone ? ✗Les atomes de chlore ? ✗Les atomes d'hydrogène ? c.Pour un atome donné, la réponse dépend-elle de sa position dans la molécule ?2.Répondre aux mêmes questions à partir de la molécule de dichlorométhoxyméthane.
3.Le nombre de liaisons que forme un atome dépend-il de la molécule dans laquelle il se trouve ?
ActiviteAtomeMolecules.odtModifié le 21/12/17Page 2 sur 44.Notion de valence
La VALENCE d'un élément chimique est LE NOMBRE DE LIAISONS COVALENTES que l'atome forme avec les atomes
voisins.En vous basant sur les deux molécules précédentes, donner la valence du carbone, de l'oxygène, du chlore
et de l'hydrogène.2. Règles de construcition de base
La règle de l'octet appliquée aux molécules :Nous avons vu qu'une structure électronique externe était une configuration particulièrement stable pour
les atomes ou pour les ions monoatomiques. Cette règle peut s'étendre à la formation des liaisons covalentes
dans les molécules.AINSI, UN ATOME A TENDANCE À FORMER AUTANT DE LIAISONS COVALENTES QUE NÉCESSAIRES AVEC SES VOISINS POUR S'ENTOURER
DE 8 ÉLECTRONS PÉRIPHÉRIQUES, DE FAÇON À ACQUÉRIR LA STRUCTURE ÉLECTRONIQUE DU GAZ RARE LE PLUS PROCHE DANS LA
CLASSIFICATION. ON RAPPELLE QUE CHAQUE LIAISON COVALENTE ENGAGÉE APPORTE UN ÉLECTRON SUPPLÉMENTAIRE À L'ATOME.
L'ÉLÉMENT HYDROGÈNE FAIT EXCEPTION, SA VALENCE EST TOUJOURS ÉGALE À 1.On peut donc connaître la valence v d'un atome dès lors qu'on connaît son nombre d'électrons périphé-
riques npériph. v=8-npériphVérifiez les réponses apportées au point 4 (Notion de valence) à l'aide de cette relation.
3. Applicaitions
1.Justifier l'assemblage des atomes et la répartition des liaisons covalentes dans la molécule de dioxyde
de soufre de formule SO2.2.Proposer une formule développée possible pour la molécule de formule brute CH2O (méthanal). On peut
commencer par rappeler la valence de chaque atome.3.Donner les formules semi-développées et brutes de molécules suivantes :
4.Isomères :
Des isomères sont des molécules différentes possédant la même formule brute. Parmi les molécules présentées ci-dessous, repérer les isomères.ActiviteAtomeMolecules.odtModifié le 21/12/17Page 3 sur 4Molécule 3 : Acide benzoïqueMolécule 1 : ChlorométhaneMolécule 2 : Propène
ActiviteAtomeMolecules.odtModifié le 21/12/17Page 4 sur 4quotesdbs_dbs47.pdfusesText_47[PDF] liaison dangereuse livre
[PDF] liaison dangereuse résumé
[PDF] liaison de van der waals exemple
[PDF] liaison de van der waals pdf
[PDF] Liaison entre Marjane Satrapi et l'Iran
[PDF] liaison et enchainement exercices
[PDF] liaison et enchainement phonétique
[PDF] liaison fatale
[PDF] liaison mécanique exercices corrigés
[PDF] liaison rs232 cours
[PDF] liaison série rs232
[PDF] liaison série rs232 pdf
[PDF] liaison série rs485
[PDF] Liaisons covalentes, doublets non liants, formule de Lewis
