 PROCEDURE DAUTORISATION DE LIEU DE RECHERCHES
PROCEDURE DAUTORISATION DE LIEU DE RECHERCHES
19 août 2020 La loi (Jardé) relative aux recherches impliquant la personne humaine (RIPH) précise qu'elles « ne peuvent être réalisées que dans un lieu ...
 RGPD et recherches impliquant la personne humaine : clarification
RGPD et recherches impliquant la personne humaine : clarification
9 sept. 2021 En France la compétence pour apprécier la conformité du traitement de données à caractère personnel au regard du RGPD et de la loi informatique ...
 Recherches impliquant la personne humaine mentionnées au 1° de
Recherches impliquant la personne humaine mentionnées au 1° de
31 mai 2021 Des arrêtés du ministre chargé de la santé et des décisions du Directeur général de l'ANSM complètent ce dispositif. Ainsi la loi RIPH modifiée ...
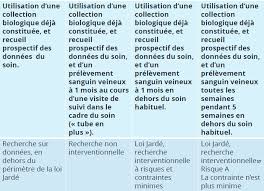 Recherches « Hors Loi Jardé »
Recherches « Hors Loi Jardé »
6 oct. 2021 ▷ Novembre 2016 : Loi Jardé – Segmentation de la recherche clinique en 2 grandes catégories : ▷ Recherche impliquant la personne humaine.
 Journal officiel de la République française - N° 267 du 17 novembre
Journal officiel de la République française - N° 267 du 17 novembre
17 nov. 2016 Vu la loi no 78-17 du 6 janvier 1978 modifiée ... « 1o Le protocole de la recherche impliquant la personne humaine mentionné à l'article R.
 Les limites de lapproche fondée sur le risque de la loi du 5 mars
Les limites de lapproche fondée sur le risque de la loi du 5 mars
5 mars 2012 condition intangible à la qualification de « recherche impliquant la personne humaine ». Seuls les participants aux recherches impliquant la ...
 Règlementation relative à la recherche impliquant la personne
Règlementation relative à la recherche impliquant la personne
25 mai 2021 Loi n° 2012-300 du 5 mars ... Chapitre II - Information de la personne qui se prête à une recherche impliquant la personne humaine et recueil de.
 Loi Jardé_Mise à jour oct 2018
Loi Jardé_Mise à jour oct 2018
17 oct. 2018 • La loi Jardé ou « La recherche impliquant la personne humaine ». • CPP → Comité de protection des personnes. • CNIL → Commission nationale ...
 la recherche clinique & la loi jardé
la recherche clinique & la loi jardé
16 nov. 2016 Loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la ... Recherche impliquant la personne humaine. (saisine préalable du CPP ...
 →Loi sur la recherche impliquant la personne humaine
→Loi sur la recherche impliquant la personne humaine
6 sept. 2017 3 catégories de recherches impliquant la personne humaine. 1. Recherches interventionnelles (qui comportent des risques et des contraintes.
 PROCEDURE DAUTORISATION DE LIEU DE RECHERCHES
PROCEDURE DAUTORISATION DE LIEU DE RECHERCHES
La loi (Jardé) relative aux recherches impliquant la personne humaine (RIPH) précise qu'elles « ne peuvent être réalisées que dans un lieu disposant des
 ?Loi sur la recherche impliquant la personne humaine
?Loi sur la recherche impliquant la personne humaine
6 sept. 2017 Les principaux apports de la loi Jardé: 1. un cadre juridique unique plus harmonisé pour les recherches impliquant la personne humaine ...
 Les recherches impliquant la personne humaine - loi Jardé 2012
Les recherches impliquant la personne humaine - loi Jardé 2012
remplacés par les mots : « recherche impliquant la personne humaine » La présente loi entre en vigueur dès la publication au Journal officiel des ...
 Guide de qualification des recherches en santé
Guide de qualification des recherches en santé
2 mai 2021 (CPP) institués par la loi comme aux Comités d'éthique de la recherche ... recherches impliquant la personne humaine » (RIPH) au sens des ...
 Avis aux promoteurs - Mise en place et conduite en France dessais
Avis aux promoteurs - Mise en place et conduite en France dessais
17 févr. 2021 appelée dans cet avis aux promoteurs loi RIPH)
 RGPD et recherches impliquant la personne humaine : clarification
RGPD et recherches impliquant la personne humaine : clarification
9 sept. 2021 RGPD et recherches impliquant la personne humaine : clarification sur ... personnel au regard du RGPD et de la loi informatique et libertés ...
 Loi relative aux recherches impliquant la personne humaine (loi
Loi relative aux recherches impliquant la personne humaine (loi
26 sept. 2017 Impliquant la Personne Humaine dite Loi Jardé entrée en application le 18 novembre 2016 ... Loi Jardé : typologie des projets de recherche.
 Recherches « Hors Loi Jardé »
Recherches « Hors Loi Jardé »
6 oct. 2021 Novembre 2016 : Loi Jardé – Segmentation de la recherche clinique en 2 grandes catégories : ? Recherche impliquant la personne humaine.
 Saisir ici le texte
Saisir ici le texte
recherches impliquant la personne humaine. Seul le cadre de la loi informatique et liberté s'applique. o Une méthodologie de référence MR004 existe pour ces
 Loi Jardé – Décret dapplication du 16/11/2016
Loi Jardé – Décret dapplication du 16/11/2016
16 nov. 2016 LA RECHERCHE CLINIQUE & LA. LOI JARDÉ. Loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine (dite loi ...
 [PDF] Principes généraux relatifs aux recherches impliquant la personne
[PDF] Principes généraux relatifs aux recherches impliquant la personne
Article L1122-1 Préalablement à la réalisation d'une recherche impliquant la personne humaine une information est délivrée à la personne qui y participe
 LOI n° 2012-300 du 5 mars 2012 relative aux recherches impliquant
LOI n° 2012-300 du 5 mars 2012 relative aux recherches impliquant
LOI n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine (1) NOR : SASX0901817L ELI : https://www legifrance gouv fr/eli/loi/2012/
 [PDF] Loi Jardé - GIRCI SOHO
[PDF] Loi Jardé - GIRCI SOHO
18 nov 2016 · Elargissement du champ de la recherche impliquant la personne humaine à des disciplines « non médicales » (recherche en sociologie psychologie
 [PDF] ?Loi sur la recherche impliquant la personne humaine
[PDF] ?Loi sur la recherche impliquant la personne humaine
6 sept 2017 · Les principaux apports de la loi Jardé: 1 un cadre juridique unique plus harmonisé pour les recherches impliquant la personne humaine
 Règlementation relative à la recherche impliquant la personne
Règlementation relative à la recherche impliquant la personne
5 mar 2021 · Loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine · Ordonnance n° 2016-800 du 16 juin 2016 relative aux
 [PDF] Les recherches impliquant la personne humaine - loi Jardé 2012
[PDF] Les recherches impliquant la personne humaine - loi Jardé 2012
? L'intérêt des personnes qui se prêtent à une recherche impliquant la personne humaine prime toujours les seuls intérêts de la science et de la société Page
 [PDF] la recherche clinique & la loi jardé - Infectiologie
[PDF] la recherche clinique & la loi jardé - Infectiologie
16 nov 2016 · Loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine (dite loi Jardé) modifiée par l'ordonnance n°2016-800
 [PDF] Recherches « Hors Loi Jardé » - Infectiologie
[PDF] Recherches « Hors Loi Jardé » - Infectiologie
6 oct 2021 · Novembre 2016 : Loi Jardé – Segmentation de la recherche clinique en 2 grandes catégories : ? Recherche impliquant la personne humaine
 [PDF] Recherches Impliquant la Personne Humaine (RIPH) - SFAR
[PDF] Recherches Impliquant la Personne Humaine (RIPH) - SFAR
Article R 1121-1-1 du csp : « Sont des recherches impliquant la personne humaine au sens du présent titre les recherches organisées et pratiquées sur des
C'est quoi la loi jarde ?
La loi Jardé a créé une commission nationale, la commission nationale pour les recherches impliquant la personne humaine (CNRIPH) qui a pour missions, entre autres, d'assurer la formation des membres des comités, de les réunir au moins une fois par an, d'homogénéiser leurs pratiques.Qu'est-ce qu'une recherche impliquant la personne humaine ?
Les recherches organisées et pratiquées sur l'être humain en vue du développement des connaissances biologiques ou médicales sont autorisées dans les conditions prévues au présent livre et sont désignées ci-après par les termes " recherche impliquant la personne humaine ".Comment faire une demande de CPP ?
Pour mener votre recherche, l'avis d'un CPP est OBLIGATOIRE. Quelles démarches devez-vous réaliser ? Vous devez enregistrer votre recherche sur le site dédié de l'ANSM pour obtenir un numéro d'identification unique : le n° ID RCB. Le n° ID RCB doit être conservé, il est indispensable pour la demande d'avis à un CPP.- Dans le cadre des études RIPH 1 et RIPH 2,
si le patient n'est pas en état de comprendre l'étude et de signer le consentement, le consentement doit être signé par un membre de la personne de confiance/famille.
AEC_DOC012 v02 1/70
AVIS AUX PROMOTEURS
DE RECHERCHES IMPLIQUANT LA PERSONNE
L. 1121-1 DU CODE DE LA SANTE PUBLIQUE
PORTANT SUR DES DISPOSITIFS MEDICAUX
OU SUR DES DISPOSITIFS MEDICAUX DE
DIAGNOSTIC IN VITRO
MISE EN PLACE ET CONDUITE DES INVESTIGATIONS CLINIQUES EN FRANCETome I
MODIFICATIONS, FIN ET RESULTATS DE LA RECHERCHE
Version 1 Juillet 2013
Version 2 1er Juin 2017
AEC_DOC012 v02 2/70
Tables des matières
INTRODUCTION ......................................................................................................................................................... 8
RAPPEL DU DISPOSITIF LEGISLATIF ET REGLEMENTAIRE ............................................................................................... 8
PORTEE ET OBJET DE CET AVIS AUX PROMOTEURS .............................................................................................................. 9
DEMANDE D'INFORMATIONS .............................................................................................................................................. 10
MISES A JOUR DE L'AVIS AUX PROMOTEURS ................................................................................................................... 10
I. DEMANDE D'AUTORISATION DE RECHERCHE AUPRES DE L'ANSM ....................................................................... 11
PREAMBULE .................................................................................................................................................................... 11
1.1. NumĠro d'enregistrement national (NΣIDRCB) ........................................................................................... 11
1.2. Demande d'autorisation de recherche ă l'ANSM ........................................................................................ 11
1.2.1. Principes généraux ............................................................................................................................................... 11
1.2.1.1. Langue ............................................................................................................................................................. 11
1.2.1.2. Justification de la non transmission d'informations ........................................................................................ 11
1.2.1.3. Cohérence des informations versées dans les documents transmis ............................................................... 12
1.2.2. Modalités de soumission du dossier de demande d'autorisation de recherche .................................................. 12
1.2.2.1. Qui dépose le dossier ? .................................................................................................................................... 12
1.2.2.2. Quand déposer le dossier ? ............................................................................................................................. 12
1.2.2.3. Comment déposer le dossier ? ........................................................................................................................ 12
1.2.3. Contenu du dossier de demande d'autorisation .................................................................................................. 12
1.2.3.1. Pièces non requises ......................................................................................................................................... 12
1.2.3.2. Pièces requises ................................................................................................................................................. 13
1.3. Instruction du dossier par l'ANSM ............................................................................................................... 23
1.3.1. Recevabilité de la demande / accusé de réception .............................................................................................. 23
1.3.1.1. Critères de recevabilité .................................................................................................................................... 23
1.3.1.2. DĠlai d'Ġǀaluation de la receǀabilitĠ ................................................................................................................ 23
1.3.1.3. Notification de la recevabilité du dossier / accusé de réception ..................................................................... 23
1.3.2. Eǀaluation par l'ANSM.......................................................................................................................................... 24
1.3.2.1. Objet de l'Ġǀaluation ....................................................................................................................................... 24
1.3.2.2. DĠlais d'Ġǀaluation........................................................................................................................................... 25
1.3.2.3. DurĠe de l'Ġǀaluation ........................................................................................................................................... 25
1.3.3. Communication entre l'ANSM et le demandeur au cours de l'instruction du dossier de demande dΖautorisation
de recherche .......................................................................................................................................................................... 25
1.3.3.1. Demandes formulĠes par l'ANSM courrier intermĠdiaireͬobjection (CI) ........................................................... 25
1.3.3.2. Réponse du demandeur au CI ............................................................................................................................... 26
1.3.3.3. Retrait de la demande d'autorisation par le demandeur................................................................................. 26
1.3.3.4. Nouvelle soumission d'une demande préalablement retirée (Re-soumission) ............................................... 27
1.3.3.5. Modifications apportées par le demandeur avant le commencement de la recherche .................................. 27
1.3.4. Décision de l'ANSM ...................................................................................................................................................... 28
1.3.4.1. Autorisation de recherche ............................................................................................................................... 28
1.3.4.2. Validité de l'autorisation de recherche ................................................................................................................. 29
1.3.4.3. PortĠe de l'autorisation ........................................................................................................................................ 30
1.4. Echanges d'informations entre l'ANSM et le CPP concernant la demande d'autorisation ou d'avis
concernant la recherche ......................................................................................................................................... 32
1.4.1. Au cours de la période d'évaluation de la demande ............................................................................................ 32
1.4.2. A l'issue de la période d'évaluation de la demande ............................................................................................. 32
1.5. ProcĠdures particuliğres de facilitation proposĠe par l'ANSM.................................................................... 32
1.5.2. Accompagnement de l'innoǀation ....................................................................................................................... 32
2. DEBUT DE LA RECHERCHE ................................................................................................................................ 33
2.1. Définition du début de la recherche ............................................................................................................ 33
2.2. Modalités de déclaration ............................................................................................................................ 33
3. MODIFICATIONS DE LA RECHERCHE ................................................................................................................ 34
PREAMBULE .................................................................................................................................................................... 34
3.1. Modifications substantielles ....................................................................................................................... 34
3.1.1. Définition .............................................................................................................................................................. 34
AEC_DOC012 v02 3/70
3.1.2. Demandes d'autorisation de modifications substantielles (AMS) ă lΖANSM ........................................................ 35
3.1.2.1. ModalitĠs de soumission du dossier de demande d'AMS ă lΖANSM ................................................................ 35
3.1.2.2. Contenu du dossier de demande d'AMS ......................................................................................................... 35
3.1.3. Modifications substantielles transmises pour information (MSI) ........................................................................ 37
3.1.4. Instruction par l'ANSM des dossiers de demande d'autorisation de modification substantielle ......................... 37
3.1.4.1. Yuand dĠbute l'instruction du dossier ͍ .......................................................................................................... 38
3.1.4.2. Recevabilité /Accusé de réception ................................................................................................................... 38
3.1.4.3. Evaluation des dossiers par l'ANSM ................................................................................................................. 38
3.1.4.4. Communication entre l'ANSM et le demandeur au cours de l'instruction de la demande d'AMS .................. 38
3.1.4.5. Retrait ͬ Resoumission de la demande d'AMS par le demandeur ................................................................... 39
3.1.4.6. Décision de l'ANSM .......................................................................................................................................... 39
3.1.5. Cas particuliers ..................................................................................................................................................... 40
3.1.5.1. Modifications substantielles faisant suite à des mesures urgentes de sécurité .............................................. 40
3.1.5.2. Arrêt temporaire / reprise de la recherche...................................................................................................... 41
3.2. Modifications autres que les modifications substantielles ......................................................................... 42
3.2.1. MODIFICATIONS A L'INITIATIVE DU PROMOTEUR ............................................................................................... 42
3.2.1.1. Modifications non substantielles ..................................................................................................................... 42
3.2.2. MODIFICATIONS INTRODUITES A LA DEMANDE DE L'ANSM................................................................................ 42
3.2.2.1. Pendant l'Ġǀaluation de la demande d'autorisation de recherche ou d'AMS par l'ANSM .............................. 42
3.2.2.2. Modifications aprğs dĠliǀrance de l'autorisation de recherche ....................................................................... 43
4. FIN DE LA RECHERCHE ..................................................................................................................................... 44
4.1. Définition de la fin de la recherche .................................................................................................................. 44
4.2. Quand déclarer la fin de la recherche ? ........................................................................................................... 44
4.2.1. Fin de la recherche à son terme prévu ......................................................................................................................... 44
4.2.2. Fin anticipée de la recherche ....................................................................................................................................... 44
4.3. Comment déclarer la fin de la recherche ? ....................................................................................................... 45
4.3.1. Contenu du dossier de déclaration de fin de la recherche........................................................................................... 45
4.3.2. Modalités de soumission du dossier de déclaration de fin de la recherche. ............................................................... 45
5. RESULTATS DE LA RECHERCHE ......................................................................................................................... 46
5.1. Rapport final ............................................................................................................................................... 46
5.2. Résumé du rapport final ............................................................................................................................. 46
AEC_DOC012 v02 4/70
Liste des annexes
Annexe 1 Références législatives et réglementaires nationales et européennesAnnexe 2 Définitions
DM ou DMDIV
Annexe 4 Liste récapitulative des pièces constitutives du dossier de demande Annexe 5 Recommandations concernant les recherches portant sur les DM et DM-DIV dont le protocole prévoit des explorations médicales ionisantes pour les seuls besoins de la recherche Annexe 6 Modèle de déclaration de conformité aux exigences essentielles de la recherche portant sur des DM ou DMDIV Annexe 9 Exemples de modifications substantielles et non substantielles pour Annexe 10 Exemples de tableau comparatif mettant en évidence les modifications substantielles et non substantielles apportées aux documents précédemment versésAEC_DOC012 v02 5/70
Liste des abréviations
AMS Autorisation de modification substantielle
ANSM Agence Nationale de Sécurité du Médicament et des produits de santéARS Agence régionale de santé
BI Brochure pour l'investigateur
CEB Collection d'échantillons biologiques
CPP Comité de protection des personnes
CSP Code de la santé publique
DM Dispositif médical
DMDIV Dispositif médical de diagnostic in vitroDMIA Dispositif médical implantable actif
IRS JO Information de référence sur la sécurité Journal officiel (de la République française) MNS MSModification non substantielle
Modification substantielle
MSA MSI OGMModification substantielle pour autorisation
Modification substantielle pour information
Organisme génétiquement modifié
QSU Qualité Sécurité Utilité
UE Union européenne
AEC_DOC012 v02 6/70
Adresses - Contacts utiles
Adresse
e-mail Boîte e-mail dédiée à la transmission des : - - demandes de pré-soumission ; technique) ; recherche ; - - demandes de modifications de la recherche déposées avant - - demandes de prorogation de validité des autorisations de recherche ; - - déclarations de début de recherche; - - déclarations de fin de recherche (prématurée ou prévue) ; - - résultats de la recherche (résumé du rapport final). - - transmission des avis des CPP sur les EC coordonnées du promoteur ou du demandeur par ex)EC.DM-COS@ansm.sante.fr
- - dossiers de demandes de modifications substantielles (MS) ; du dossier de demande de MS ou suite à son évaluation technique) ; - - arrêt temporaire de la recherche ; dajr@ansm.sante.fr Boîte e-mail à utiliser pour poser directement des questions concernant la réglementation relative aux essais cliniques de DM ou qualification du point de vue juridique de la recherche NB :Adresse
postale ANSMDMFR ± PGF 520
143/147, boulevard Anatole France
93285 SAINT-DENIS Cedex
NB : Veuillez apposer le code 520 sur les plis
(enveloppe et lettre).- Soit prendre rendez-vous avec la personne en charge du suivi de votre dossier, dont les coordonnées
AEC_DOC012 v02 7/70
EVALUATION ET AUTORISATION DES INVESTIGATIONS CLINIQUES DE DM ET DE DMDIV Direction des dispositifs médicaux de diagnostic et des plateaux techniques (DMDPT)Equipe DMDIV
DM de diagnostic in vitro
Tél. : + 33 (1) 55 87 33 03
Equipe DMRIAL
DM radiogènes, injection, aide patient et logicielsEquipe DMBLOC
DM de bloc opératoire et de soins intensifs
Direction des dispositifs médicaux thérapeutiques et des cosmétiques (DMTCOS)Equipe DMCARD
DM cardiovasculaires
Tél. : + 33 (1) 55 87 36 87
Equipe DMCHIR
DM orthopédie & autres chirurgies
Equipe DMCOSM
DM grand public & cosmétiques
REFERENT ESSAIS CLINIQUES
Tél. : + 33 (1) 55 87 30 00
INSPECTION DES ESSAIS CLINIQUES
Direction Inspection Pôle Inspection des essais et des vigilancesTél. : + 33 (1) 55 87 37 14
ou + 33 (1) 55 87 32 94REGLEMENTATION DES ESSAIS CLINIQUES
Direction des affaires juridiques et réglementaires Tél. : + 33 (1) 55 87 36 58E-mail : dajr@ansm.sante.fr
UTILES POUR LES RECHERCHES SUR DES DM ET DMDIV
ANSM http://www.ansm.sante.fr
Y Rubrique essais cliniques :
Textes applicables aux essais cliniques / Avis aux promoteurs /Formulaires à télécharger / Recommandations sur les essais cliniquesAEC_DOC012 v02 8/70
INTRODUCTION
RAPPEL DU DISPOSITIF LEGISLATIF ET REGLEMENTAIRE
La loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine (dite loi Jardé,
novembre 2016.Ce nouveau dispositif se substitue à celui issu de la loi n° 2004-806 du 9 août 2004 relative à la politique de
santé publique et de son décret d'application n° 2006-477 du 26 avril 2006 sur les recherches biomédicales.
Les nouvelles dispositions sont codifiées au titre II du livre Ier de la première partie du code de la santé
complètent ce dispositif.Ainsi, la loi RIPH modifiée encadre OM PLVH HQ °XYUH des recherches impliquant la personne humaine,
entendues selon la définition mentionnée au L.1121-1 et R. 1121-1 du CSP comme les recherches
de produits de santé tels que les dispositifs médicaux (DM) et les dispositifs médicaux de diagnostic in vitro
catégories :Ce sont les recherches qui comportent une intervention sur les personnes non dénuée de risques pour
celles-ci. Elles correspondent à ce qui était défini sous la législation précédente comme " recherches
biomédicales» ;Ce sont des recherches qui comportent des interventions à risques et contraintes minimes, dont la liste
leur marquage CE). Une partie de ces recherches correspond à ce qui était défini sous la précédente
législation comme " recherches visant à évaluer les soins courants » ; CSP:quotesdbs_dbs41.pdfusesText_41[PDF] rcpers
[PDF] loi jardé résumé
[PDF] loi jardé 2016
[PDF] architecte musée guggenheim new york
[PDF] associez ? la courbe de chaque fonction
[PDF] celle de sa dérivée
[PDF] musée guggenheim new york architecture
[PDF] fondation guggenheim
[PDF] exercice fonction dérivée terminale bac pro
[PDF] comment trouver des arguments dans un texte
[PDF] comment trouver des arguments pour une dissertation
[PDF] trouver un argument dans un texte
[PDF] cours de maths 1ere stmg
[PDF] trouver des arguments pour convaincre
