 les dosages oxydo-reductimetriques (redox) - la manganimetrie
les dosages oxydo-reductimetriques (redox) - la manganimetrie
La manganimétrie permet le dosage d'un grand nombre de réducteurs car MnO4. - 1-1) Potentiel d'oxydo-réduction : *La méthode iodométrique est basée sur la ...
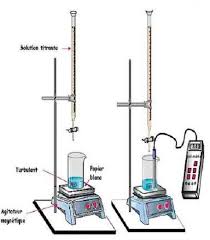 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
molaire. La concentration massique. NB ± ∆NB. CB ± ∆CB. C'B ± ∆C'B. Page 27. Page - 26 -. TP N° 2. DOSAGE D'OXYDOREDUCTION : Manganimétrie. Quel est le but
 TP Nº5 (Semestre 2) : Dosage doxydo-réduction
TP Nº5 (Semestre 2) : Dosage doxydo-réduction
La manganimétrie consiste à doser des solutions réductrices de normalité inconnue au moyen de l'agent oxydant (MnO4) en milieu acide. Page 2. 2. Dosage d'oxydo-
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
Dosage Oxydoréduction (manganimétrie). Page 30. Dosage Oxydoréduction (manganimétrie). I. Objectif. ✍ Il s'agit de déterminer le titre molaire d'une solution
 TP Nº5 (Semestre 2) : Dosage doxydo-réduction
TP Nº5 (Semestre 2) : Dosage doxydo-réduction
La manganimétrie consiste à doser des solutions réductrices de normalité inconnue au moyen de l'agent oxydant (MnO4) en milieu acide. Page 2. 2. Dosage d'oxydo-
 Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer ferreux La manganimétrie est une technique
TP n°3 OXYDOREDUCTION : MANGANIMETRIE. APPLICATION : Dosage du fer ferreux. La Pour l'étalonner on utilisera un réducteur. Utiliser une solution ...
 Manipulation N° III: Dosage par la méthode doxydo-réduction
Manipulation N° III: Dosage par la méthode doxydo-réduction
Manganimétrie : C'est une méthode basée sur les réactions d'oxydation par l'ion permanganate. L'oxydation peut être effectuée en milieu acide alcalin ou en
 Travaux Pratiques de Chimie Générale Manganimétrie
Travaux Pratiques de Chimie Générale Manganimétrie
• On appelle manganimétrie l'ensemble des dosages d'oxydo-réduction utilisant comme solution oxydante le permanganate de potassium KMnO4. • Les propriétés
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction (dosage en retour) => manganimétrie. • Milieu alcalin : −/ −. Exemple : ...
 dosage manganimetrie
dosage manganimetrie
- : ion permanganate oxydant puissant
 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
DOSAGE D'OXYDOREDUCTION : Manganimétrie. Généralités. Rappels. Selon les conceptions de la chimie électronique le processus d'oxydation ou de réduction se
 Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer ferreux La manganimétrie est une technique
TP n°3 OXYDOREDUCTION : MANGANIMETRIE Pour l'étalonner on utilisera un réducteur. ... 2- Application : Dosage du fer ferreux
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
METHODES D'ANALYSE TITRIMITRIQUE EN OXYDOREDUCTION. Manganimétrie : I- Introduction : Les dosages manganimétrique mettent en jeu le pouvoir oxydant de l'ion
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
Dosage Oxydoréduction (manganimétrie). I. Objectif. ? Il s'agit de déterminer le titre molaire d'une solution de sulfate ferreux et par.
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
TP IV : Dosage (Titrage) d'oxydo-réduction . à l'aide d'indicateurs colorés d'oxydoréduction. Le dosage ... sont à l'origine de la manganimétrie.
 Manipulation N°4 Dosage doxydo-réduction : 1- Introduction : 2- But
Manipulation N°4 Dosage doxydo-réduction : 1- Introduction : 2- But
Dosage (Titrage) d'oxydo-réduction Le dosage consiste à déterminer la normalité d'une solution réductrice ... Ce dosage est appelé manganimétrie.
 TP N° 02. DOSAGE DES IONS FER (Fe ) CONTENUS DANS LE
TP N° 02. DOSAGE DES IONS FER (Fe ) CONTENUS DANS LE
DOSAGE DES IONS FER (Fe. 2+. ) CONTENUS DANS LE SEL DE MOHR. PAR MANGANIMETRIE. 1. INTRODUCTION. Les réactions d'oxydoréduction ou réactions redox
 GÉNÉRALISATIO DE LOXYDO-RÉDUCTION EN SOLUTION
GÉNÉRALISATIO DE LOXYDO-RÉDUCTION EN SOLUTION
Peut-on doser une solution de chlorure de fer (II) par manganimétrie ? 23. Quelle est l'équation-bilan de la réaction de l'acide nitrique sur les ions fer (II).
 Les dosages doxydoréduction
Les dosages doxydoréduction
Les dosages d'oxydoréduction. Exercice 1 : Teneur en dioxyde de soufre dans un vin blanc. La teneur maximale en dioxyde de soufre d'un vin est imposée par
F. Latapie TP dosage manganimetrie.DOC
Page 1 sur 4
Dosage d"une solution aqueuse de peroxyde d"hydrogène par manganimétrie Source :Physique Chimie Terminale SMS Édition Nathan technique. Introduction : Un antiseptique : l"eau oxygénéeLe peroxyde d"hydrogène, de formule H
2O2, fut découvert par le chimiste français Thenard au
début du XIXème siècle.
Pur, c"est un liquide sirupeux bleu pâle. Il est commercialisé en solutions aqueuses de titres t
variés dites eaux oxygénées à t volumes.En général, les dénominations peroxyde d"hydrogène et eau oxygénée sont confondues.
Utilisations
Historiquement, le peroxyde d"hydrogène servait de source d"énergie de propulsion. Actuellement, il est surtout utilisé comme agent de blanchiment mais on l"emploie aussi pourdécolorer les huiles et les graisses, comme générateur de dioxygène et comme agent d"oxydation.
En pharmacie, on utilise l"eau oxygénée pour son action bactériostatique et pour sa faible action
sporicide. ( elle peut inactiver certains virus comme celui de la poliomyélite)Conservation
L"eau oxygénée ne doit pas être exposée aux rayons ultraviolets et doit être conservée à l"abri de
la chaleur afin d"éviter sa décomposition.Toxicité
Une solution d"eau oxygénée de concentration élevée peut provoquer des brûlures et l"irritation
des muqueuses et de la peau si les applications sont répétées. Couples rédox intervenant dans une eau oxygénéeLe peroxyde d"hydrogène est une espèce chimique oxydante :H2O2 est un oxydant. Son réducteur
conjugué est l"eau H 2O.Le couple rédox correspondant est H
2O2/H2O.
En milieu acide, la demi-équation électronique associée est : H2O2 + 2H+ + 2 e- ¬
® 2 H2O
Le peroxyde d"hydrogène est aussi une espèce chimique réductrice :H2O2 est un réducteur. Son
oxydant conjugué est le dioxygène O 2.Le couple rédox correspondant est O
2/H2O2.
En milieu acide, la demi-équation électronique associée est : H2O2 ¬
®O2 + 2H+ + 2 e-
Le peroxyde d"hydrogène étant oxydant et réducteur, il est auto-oxydé, il subit une dismutation
d"équation bilan : 2H2O2 ® O2 + 2H2O
F. Latapie TP dosage manganimetrie.DOC
Page 2 sur 4
Dosage d"une solution aqueuse de peroxyde d"hydrogène par manganimétrieObjectif : un dosage d"eau oxygéné est utilisé pour vérifier le titre en " volumes » de la
solution. Un dosage manganimétrique fait intervenir le couple " coloré » rédox : MnO4-/Mn2+.
MnO4- : ion permanganate, oxydant puissant, de teinte violette en solution aqueuse.
Mn2+:ion manganèse (II), réducteur, incolore en solution aqueuse.
Matériel :
- matériel nécessaire pour effectuer une dilution : deux pipettes, une de 10 mL et une de 25 mL deux fioles jaugées 100 mL - matériel nécessaire pour effectuer un dosage : burette et agitateur magnétique - solutions :· solution de permanganate de concentration c
0 = 2.10-2 mol. L-1.
· solution d"eau oxygénée à 110 volumes. · solution d"acide sulfurique de concentration c = 10 -1 mol. L-1.Mode opératoire :
1- Dilution de l"eau oxygénée
A l"aide de deux pipettes jaugées, diluer 20 fois l"eau oxygénée avec de l"eau distillée. (une dilution au dixième et une dilution par deux) On obtient une solution S dont on veut déterminer la concentration c S.2- Dosage de l"eau oxygénée
· Mettre dans le becher :
- 1 mL de solution S - 10 mL d"acide sulfurique - 10 mL d"eau distillée Le mélange est incolore. C"est la solution à titrer. · Mettre dans la burette une solution aqueuse violette de permanganate de potassium de concentration connue· Verser la solution titrante dans le mélange à titrer, pour obtenir précisément, à
la goutte près, le mélange équivalent, juste quand une légère teinte rose-violacé apparaît. · Lire sur la burette la valeur du volume équivalent : VE = 9,8 mL.
F. Latapie TP dosage manganimetrie.DOC
Page 3 sur 4
3- Réaction et équation bilan du dosage
La solution aqueuse de permanganate de potassium : K + + MnO4- contient l"espèce chimique oxydante. Par réaction avec le peroxyde d"hydrogène, les ions permanganates sont réduits, en milieu acide, selon la demi-réaction électronique associée au couple MnO4- / Mn2+ :
MnO4- + 8H+ + 5e- ® Mn2+ + 5 O2 + 8H2O
Par réaction avec les ions permanganate, le peroxyde d"hydrogène est oxydé, en milieu acide, selon la demi-réaction électronique associée au couple O2/H2O2.
H2O2 ®O2 + 2H+ + 2 e-
L"équation bilan de la réaction de dosage est donc : 2MnO4- + 5H2O2 +6H+ ® 2Mn2 + 5O2 + 8H2O.
Les ions permanganate violets ajoutés réagissent et se transforment en ions manganèse incolores. Le liquide du becher reste donc incolore tant qu"il contient des molécules de peroxyde d"hydrogène. Lorsque le liquide prend une teinte rose violacé, c"est qu"il ne reste plus de peroxyde d"hydrogène : les ions permanganate ne peuvent pas réagir. On a atteint l"équivalence.4- Détermination du titre de l"eau oxygénée
4.1. Concentration molaire de l"eau oxygénée dosée
On connaît :
- la concentration c0 = 2.10-2 mol. L-1 de la solution de permanganate
- le volume VE = 9,8 mL de la solution de permanganate
- le volume V S = 1 mL de la solution diluée d"eau oxygénée A l"équivalence, les nombre de moles d"ions permanganate et de peroxyde d"hydrogène mis en présence sont dans les proportions stoechiométriques de l"équation bilan de dosage. Donc : 5 n 2 nS0= ainsi cS = 4901
89102522
mol.L-1. Or, lors la solution d"eau oxygénée a été diluée 20 fois.Donc, c
H2O2 = 20´0,49 = 9,8 mol.L-1.
4.2. Détermination du titre de l"eau oxygénée initiale
Le peroxyde d"hydrogène subit une dismutation d"équation bilan : 2H2O2 ® O2 + 2H2O
2 moles de H
2O2 libèrent 24 litres (volume molaire) de O2, donc
9,8 moles de H
2O2 libèrent 12´9,8 = 117,8 litres de O2.
L"eau oxygénée initiale est à 117,8 " volumes ».F. Latapie TP dosage manganimetrie.DOC
Page 4 sur 4
Je suppose que le nombre de volumes est supérieur au titre annoncé sur la bouteille carle flacon était " neuf », donc la solution était fraîchement préparée et conservée dans
des conditions idéales ( hermétiquement fermé et à l"abri de la lumière). Les difficultés rencontrées pour réaliser ce dosage : Initialement, les solutions de permanganate de potassium et de peroxyde d"hydrogène n"étaient pas fiables : le mélange dans le becher devenait rose à la première goutte de permanganate versée. J"ai donc réalisé une solution de permanganate. J"ai utilisé un flacon neuf d"eau oxygénée. · il faut connaître précisément la concentration de permanganate de potassium qui s"oxyde rapidement à la lumière. Il faut donc utiliser une solution fraîchement préparée. · le dosage doit être réalisée avec une solution d"eau oxygénée neuve pour limiter l"oxydation du produit.quotesdbs_dbs5.pdfusesText_10[PDF] dosage oxydoreduction pdf
[PDF] dosage par titrage colorimétrique
[PDF] dosage par titrage conductimétrique
[PDF] dosage par titrage conductimétrique destop correction
[PDF] dosage par titrage protocole
[PDF] dosage permanganate de potassium par acide oxalique
[PDF] dosage permanganate de potassium par sel de mohr
[PDF] dosage ph métrique definition
[PDF] dosage ph métrique tp
[PDF] dosage potentiométrique d'une solution de sel de mohr
[PDF] dosage potentiometrique equivalence
[PDF] dosage sulfate ferreux par permanganate de potassium
[PDF] dose mais par hectare
[PDF] dose toxique aspirine
