 dosage manganimetrie
dosage manganimetrie
- : ion permanganate oxydant puissant
 les dosages oxydo-reductimetriques (redox) - la manganimetrie
les dosages oxydo-reductimetriques (redox) - la manganimetrie
La manganimétrie permet le dosage d'un grand nombre de réducteurs car MnO4. - 1-1) Potentiel d'oxydo-réduction : *La méthode iodométrique est basée sur la ...
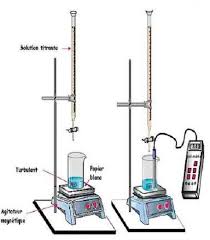 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
molaire. La concentration massique. NB ± ∆NB. CB ± ∆CB. C'B ± ∆C'B. Page 27. Page - 26 -. TP N° 2. DOSAGE D'OXYDOREDUCTION : Manganimétrie. Quel est le but
 TP Nº5 (Semestre 2) : Dosage doxydo-réduction
TP Nº5 (Semestre 2) : Dosage doxydo-réduction
La manganimétrie consiste à doser des solutions réductrices de normalité inconnue au moyen de l'agent oxydant (MnO4) en milieu acide. Page 2. 2. Dosage d'oxydo-
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
Dosage Oxydoréduction (manganimétrie). Page 30. Dosage Oxydoréduction (manganimétrie). I. Objectif. ✍ Il s'agit de déterminer le titre molaire d'une solution
 TP Nº5 (Semestre 2) : Dosage doxydo-réduction
TP Nº5 (Semestre 2) : Dosage doxydo-réduction
La manganimétrie consiste à doser des solutions réductrices de normalité inconnue au moyen de l'agent oxydant (MnO4) en milieu acide. Page 2. 2. Dosage d'oxydo-
 Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer ferreux La manganimétrie est une technique
TP n°3 OXYDOREDUCTION : MANGANIMETRIE. APPLICATION : Dosage du fer ferreux. La Pour l'étalonner on utilisera un réducteur. Utiliser une solution ...
 Manipulation N° III: Dosage par la méthode doxydo-réduction
Manipulation N° III: Dosage par la méthode doxydo-réduction
Manganimétrie : C'est une méthode basée sur les réactions d'oxydation par l'ion permanganate. L'oxydation peut être effectuée en milieu acide alcalin ou en
 Travaux Pratiques de Chimie Générale Manganimétrie
Travaux Pratiques de Chimie Générale Manganimétrie
• On appelle manganimétrie l'ensemble des dosages d'oxydo-réduction utilisant comme solution oxydante le permanganate de potassium KMnO4. • Les propriétés
 dosage manganimetrie
dosage manganimetrie
- : ion permanganate oxydant puissant
 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
DOSAGE D'OXYDOREDUCTION : Manganimétrie. Généralités. Rappels. Selon les conceptions de la chimie électronique le processus d'oxydation ou de réduction se
 Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer ferreux La manganimétrie est une technique
TP n°3 OXYDOREDUCTION : MANGANIMETRIE Pour l'étalonner on utilisera un réducteur. ... 2- Application : Dosage du fer ferreux
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
METHODES D'ANALYSE TITRIMITRIQUE EN OXYDOREDUCTION. Manganimétrie : I- Introduction : Les dosages manganimétrique mettent en jeu le pouvoir oxydant de l'ion
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
Dosage Oxydoréduction (manganimétrie). I. Objectif. ? Il s'agit de déterminer le titre molaire d'une solution de sulfate ferreux et par.
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
TP IV : Dosage (Titrage) d'oxydo-réduction . à l'aide d'indicateurs colorés d'oxydoréduction. Le dosage ... sont à l'origine de la manganimétrie.
 Manipulation N°4 Dosage doxydo-réduction : 1- Introduction : 2- But
Manipulation N°4 Dosage doxydo-réduction : 1- Introduction : 2- But
Dosage (Titrage) d'oxydo-réduction Le dosage consiste à déterminer la normalité d'une solution réductrice ... Ce dosage est appelé manganimétrie.
 TP N° 02. DOSAGE DES IONS FER (Fe ) CONTENUS DANS LE
TP N° 02. DOSAGE DES IONS FER (Fe ) CONTENUS DANS LE
DOSAGE DES IONS FER (Fe. 2+. ) CONTENUS DANS LE SEL DE MOHR. PAR MANGANIMETRIE. 1. INTRODUCTION. Les réactions d'oxydoréduction ou réactions redox
 GÉNÉRALISATIO DE LOXYDO-RÉDUCTION EN SOLUTION
GÉNÉRALISATIO DE LOXYDO-RÉDUCTION EN SOLUTION
Peut-on doser une solution de chlorure de fer (II) par manganimétrie ? 23. Quelle est l'équation-bilan de la réaction de l'acide nitrique sur les ions fer (II).
 Les dosages doxydoréduction
Les dosages doxydoréduction
Les dosages d'oxydoréduction. Exercice 1 : Teneur en dioxyde de soufre dans un vin blanc. La teneur maximale en dioxyde de soufre d'un vin est imposée par
LES REACTIONS D'OXYDOREDUCTION
1. Intérêts et définition
1.1. Introduction :
Liés aux équilibres acido-basiques, de précipitation et de complexation.électrochimiques, corrosion et protection contre la corrosion des métaux, antiseptiques et désinfectants,
sèche (sans eau). Dans ce chapitre, nous nous intéresserons essentiellement aux réactions en solution aqueuse.
Ex : réaction entre Fe et Cu2+ (aq)
Fe(s) + Cu2+ (aq) Fe2+ (aq) + Cu(s) m
réaction chimique. réaction chimique.Examples:
Al3+ (aq) + 3 eʹ їAl (s)
Fe3+ (aq) + eʹ їFe2+ (aq)
I2 (aq) + 2 eʹ ї2 Iʹ (aq)
Cl2 (g) + 2 eʹ ї2 Clʹ (aq)
S4O62ʹ(aq) + 2 eʹ ї 2 S2O32ʹ (aq)
2 H+ (aq) + 2 eʹ ї H2 (g)
Ces deux définitions sont complémentaires : à tout oxydant Ox correspond un réducteur Red selon le schéma
Ox + n eʹ = Red
2Définitions :
élément, que cet élément soit seul ou engagé dans un édifice moléculaire ou ionique.
Précisons les règles qui permettent de le déterminer.Première règle :
cette espèce.Exemples :
Deuxième règle :
Quand deux éléments sont unis par une liaison covalente, les électrons de la liaison sont attribués
Tableau 1 : Électronégativité de Pauling ʖP de quelques éléments. ʹ établir la représentation de Lewis de cet édifice ; - faire le bilan des charges.Ainsi :
eau oxygénée, comme dans tous les peroxydes, n.o. (O) = ʹ I 3 que lui, alors n.o. (H) = ʹ I.Troisième règle :
Dans un édifice polyatomique, la conservation de la charge impose que la somme algébrique des nombres
Exemples :
Dans CO : n.o.(C) + n.o.(O) = 0 avec n.o.(O) = ʹ II, n.o.(C) = II. Dans CO2 : n.o.(C) + 2 n.o.(O) = 0 avec n.o.(O) = ʹ II, n.o.(C) = IV. Dans C2O42ʹ : 2 n.o.(C) + 4 n.o.(O) = ʹ II avec n.o.(O) = ʹ II, n.o.(C) = III.Comme les réactions rédox ne font pas apparaître les électrons dans le bilan, elles sont plus complexes à
Exemple : de la réaction entre les ions permanganate et les ions fer (II) :1re étape : détermination des deux couples rédox mis en jeu : MnOо4 /Mn+2 et Fe+3/Fe+2.
ʹ le manganèse dans MnOо4: n.o. (Mn) = +VII.ʹ le manganèse dans Mn+2 : n.o. (Mn) = +II.
ʹ le fer dans Fe+3 : n.o. = + III.
ʹ le fer dans Fe+2: n.o. = + II.
ʹ pour Mn, ȴn.o. = 5 soit 5 électrons échangés. ʹ pour Fe, ȴn.o. = 1 soit 1 électron échangé.On peut donc écrire :
41.6. Dismutation et médiamutation :
Une dismutation est une réaction au cours de laquelle un même composé est à la fois oxydé et réduit (espèce
amphotère du point de vue rédox, appelé aussi ampholyte oxydoréduction)Dans le sens indirect, la réaction est une médiamutation ou rétrodismutation : il faut être deux pour faire une
médiamutation.1.7. La Rétrodismutation (amphotérisation) :
Réaction entre deux espèces chimiques dans lesquelles un atome ou groupe fonctionnel était initialement
pour cet élément.IO3- + 5I- + 6H+їϯ2 + 3H2O
V -I 0
1.8. Normalité, equivalent:
1.9. Lien avec le tableau périodique :
A droite du tableau, il y a les oxydants (du côté des non métaux), et de l'autre côté sont des réducteurs.
Les métaux en général sont susceptibles de perdre des électrons. Formation de cations métalliques.
ou centrale de la classification. Leurs atomes ont tendance à céder des électrons. Les atomes d ces éléments ont tendance à gagner des électrons.Vie pratique :
Antiseptiques => oxydants.
H2O2 (eau oxygénée)
I2 (teinture d'iode)
MnO4 о (dakin)
2.1. Introduction
électrochimique (association de deux demi-piles) et définir une demi-pile de référence. 52.2. Demi-pile électrochimique, électrode rédox :
appelé " demi-pile » ou électrode rédox. Remarque : le réducteur du couple peut jouer le rôle du conducteur métallique.f.e.m. de la pile est la différence de potentiel entre la demi-pile placée à droite (borne positive) et la demi-pile
placée à gauche (borne négative).2.4. Demi-pile ou électrode de référence
irréalisable expérimentalement. Cependant on se rapproche des conditions énoncées ci-dessus dans "
Définition :
normale à hydrogène (demi-pile de gauche) et où le couple redox, dont on veut définir le potentiel, constitue la
demi-pile de droite.constituants du couple sont pris dans leur état standard de référence à la température considérée.
2.7. Classification électrochimique des couples (redox) :
Pour chaque couple oxydant réducteur, les oxydants sont à gauche (les plus puissants en haut) et les
réducteurs sont à droite (les plus puissants en bas)2.8. Règle du " gamma נ
La classification électrochimique permet de prévoir la réaction entre 2 couples oxydant réducteurs en utilisant
la règle du Gamma 62.9. Equation de Nernst :
L'équation de Nernst permet de calculer le potentiel d'un couple rédoxEquation de Nernst : définition
Soit la demi-pile : aOx + ne- bRed
Avec :
E : le potentiel en Volt
E°: le potentiel standard en Volt
R : constante des gaz parfaits - R = 8,3145 J·mol-1·K-1T : la température en Kelvin (K)
F : la constante de Faraday = 96 485 C.mol-1
Rappel mathématique : fonction logarithme de base a : logax = lnx/lnaOn en déduit le terme (RT/F). ln10 = 0.059
Equation de Nernst dans la condition standard
A savoir :
Pour les corps purs solide, la concentration est remplacée par " 1 »Exemples :
Equation de Nernst pour un système rédox
aOx1 + bRed2 + ne- cRed1 + dOx2 72.10. Échelle des potentiels standards :
On place le couple de référence H+/H2 sur cette échelle de potentiel standard, sachant queE (H+/H2) = 0 V.
On peut ainsi classer les principaux couples rédox entre eux comme dans le tableau ci-dessous. et le réducteur le plus fort.1. Comparaison des potentiels standards :
produit naturellement.réaction spontanée, il faut que le potentiel E (Ox1/Red1) soit supérieur au potentiel E (Ox2/Red2).
Les différents couples d'oxydant/réducteur ont été classés au sein de table. Cette classification se base sur une
propriété mesurée de façon empirique. Il s'agit du potentiel standard de réduction.Par convention, le potentiel standard de réduction du couple H+/H2(g) a été fixé à 0 volt. Les autres couples sont
classés par-rapport à cette référence. Ces potentiels standards sont mesurés selon des conditions particulières
de pression : 1 bar, de concentration : 1 mol/l et de température : 25°C.Notation : Le potentiel standard se note : E0
2. Sens des réactions
Soient les deux couples :
Ox1 + n1e quotesdbs_dbs50.pdfusesText_50
[PDF] dosage oxydoreduction pdf
[PDF] dosage par titrage colorimétrique
[PDF] dosage par titrage conductimétrique
[PDF] dosage par titrage conductimétrique destop correction
[PDF] dosage par titrage protocole
[PDF] dosage permanganate de potassium par acide oxalique
[PDF] dosage permanganate de potassium par sel de mohr
[PDF] dosage ph métrique definition
[PDF] dosage ph métrique tp
[PDF] dosage potentiométrique d'une solution de sel de mohr
[PDF] dosage potentiometrique equivalence
[PDF] dosage sulfate ferreux par permanganate de potassium
[PDF] dose mais par hectare
[PDF] dose toxique aspirine
