 dosage manganimetrie
dosage manganimetrie
- : ion permanganate oxydant puissant
 les dosages oxydo-reductimetriques (redox) - la manganimetrie
les dosages oxydo-reductimetriques (redox) - la manganimetrie
La manganimétrie permet le dosage d'un grand nombre de réducteurs car MnO4. - 1-1) Potentiel d'oxydo-réduction : *La méthode iodométrique est basée sur la ...
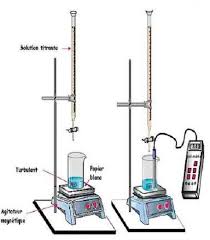 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
molaire. La concentration massique. NB ± ∆NB. CB ± ∆CB. C'B ± ∆C'B. Page 27. Page - 26 -. TP N° 2. DOSAGE D'OXYDOREDUCTION : Manganimétrie. Quel est le but
 TP Nº5 (Semestre 2) : Dosage doxydo-réduction
TP Nº5 (Semestre 2) : Dosage doxydo-réduction
La manganimétrie consiste à doser des solutions réductrices de normalité inconnue au moyen de l'agent oxydant (MnO4) en milieu acide. Page 2. 2. Dosage d'oxydo-
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
Dosage Oxydoréduction (manganimétrie). Page 30. Dosage Oxydoréduction (manganimétrie). I. Objectif. ✍ Il s'agit de déterminer le titre molaire d'une solution
 TP Nº5 (Semestre 2) : Dosage doxydo-réduction
TP Nº5 (Semestre 2) : Dosage doxydo-réduction
La manganimétrie consiste à doser des solutions réductrices de normalité inconnue au moyen de l'agent oxydant (MnO4) en milieu acide. Page 2. 2. Dosage d'oxydo-
 Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer ferreux La manganimétrie est une technique
TP n°3 OXYDOREDUCTION : MANGANIMETRIE. APPLICATION : Dosage du fer ferreux. La Pour l'étalonner on utilisera un réducteur. Utiliser une solution ...
 Manipulation N° III: Dosage par la méthode doxydo-réduction
Manipulation N° III: Dosage par la méthode doxydo-réduction
Manganimétrie : C'est une méthode basée sur les réactions d'oxydation par l'ion permanganate. L'oxydation peut être effectuée en milieu acide alcalin ou en
 Travaux Pratiques de Chimie Générale Manganimétrie
Travaux Pratiques de Chimie Générale Manganimétrie
• On appelle manganimétrie l'ensemble des dosages d'oxydo-réduction utilisant comme solution oxydante le permanganate de potassium KMnO4. • Les propriétés
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction (dosage en retour) => manganimétrie. • Milieu alcalin : −/ −. Exemple : ...
 dosage manganimetrie
dosage manganimetrie
- : ion permanganate oxydant puissant
 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
DOSAGE D'OXYDOREDUCTION : Manganimétrie. Généralités. Rappels. Selon les conceptions de la chimie électronique le processus d'oxydation ou de réduction se
 Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer ferreux La manganimétrie est une technique
TP n°3 OXYDOREDUCTION : MANGANIMETRIE Pour l'étalonner on utilisera un réducteur. ... 2- Application : Dosage du fer ferreux
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
METHODES D'ANALYSE TITRIMITRIQUE EN OXYDOREDUCTION. Manganimétrie : I- Introduction : Les dosages manganimétrique mettent en jeu le pouvoir oxydant de l'ion
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
Dosage Oxydoréduction (manganimétrie). I. Objectif. ? Il s'agit de déterminer le titre molaire d'une solution de sulfate ferreux et par.
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
TP IV : Dosage (Titrage) d'oxydo-réduction . à l'aide d'indicateurs colorés d'oxydoréduction. Le dosage ... sont à l'origine de la manganimétrie.
 Manipulation N°4 Dosage doxydo-réduction : 1- Introduction : 2- But
Manipulation N°4 Dosage doxydo-réduction : 1- Introduction : 2- But
Dosage (Titrage) d'oxydo-réduction Le dosage consiste à déterminer la normalité d'une solution réductrice ... Ce dosage est appelé manganimétrie.
 TP N° 02. DOSAGE DES IONS FER (Fe ) CONTENUS DANS LE
TP N° 02. DOSAGE DES IONS FER (Fe ) CONTENUS DANS LE
DOSAGE DES IONS FER (Fe. 2+. ) CONTENUS DANS LE SEL DE MOHR. PAR MANGANIMETRIE. 1. INTRODUCTION. Les réactions d'oxydoréduction ou réactions redox
 GÉNÉRALISATIO DE LOXYDO-RÉDUCTION EN SOLUTION
GÉNÉRALISATIO DE LOXYDO-RÉDUCTION EN SOLUTION
Peut-on doser une solution de chlorure de fer (II) par manganimétrie ? 23. Quelle est l'équation-bilan de la réaction de l'acide nitrique sur les ions fer (II).
 Les dosages doxydoréduction
Les dosages doxydoréduction
Les dosages d'oxydoréduction. Exercice 1 : Teneur en dioxyde de soufre dans un vin blanc. La teneur maximale en dioxyde de soufre d'un vin est imposée par
Page 1 sur 4
GÉNÉRALISATIO DE L'OXYDO-RÉDUCTION EN SOLUTION AQUEUSEExercice 1 : Faire le point
1. Classer les uns par rapport aux autres les couples : Cu
2+ /Cu, Fe 2+ /Fe et Fe 3+ /Fe. Indiquer les réactions naturelles auxquelles ils peuvent donner lieu.2. Définir le potentiel standard d'un couple redox. Préciser cette définition pour les couples Cl
2 (g)/Cl-, Cr 2 O 7 2- /Cr 3+ et Ag /Ag.3. Ecrire la demi-équation électronique du couple NO
3 /NO.4. Citer trois éléments de la famille des halogènes. Préciser leur structure électronique externe et la formule du
corps simple correspondant.5. Décrire la demi-pile correspondant au couple Fe
3+ /Fe.6. Comparer les propriétés oxydantes de l'acide nitrique et de l'acide chlorhydrique.
7. Comment peut-on mettre en évidence la présence de diiode dans une solution aqueuse ?
8. Justifier l'inexistence de l'iodure de fer (III).
9. Citer trois corps contenant l'élément manganèse, en précisant leur aspect.
10. Etablir la demi-équation électronique du couple MnO
4 /Mn 2+ et en déduire l'équation-bilan de la réaction des ions permanganate et les ions fer (II).11. Préciser l'influence du pH sur le déroulement de la réaction entre les ions permanganate et les ions Fe(II).
12. Expliquer pourquoi les solutions de permanganate ne sont jamais acidifiées par l'acide chlorhydrique.
13. Etablir la demi-équation électronique du couple Cr
2 O 7 2-/ Cr 3+ , puis celle du couple éthanal-éthanol. En déduire l'équation-bilan de la réaction naturelle entre ces couples.14. Prévoir quelle est la réaction naturelle entre les couples Cr
2 O 7 2- /C 3+ et Cl 2 /Cl . S'agit-il d'une réaction totale ?15. Donner la définition d'un dosage. Quelles sont les caractéristiques d'une réaction de dosage ?
16. Donner la définition du point d'équivalence d'un dosage.
17. Quelle est la demi-équation électronique du couple MnO
4 /Mn 2+ ? Comment les ions permanganate peuvent- ils être mis en évidence ?18. Comment savoir si une réaction d'oxydoréduction sera totale ? Comment savoir si elle sera spontanée ?
19. Pourquoi le milieu réactionnel doit-il être acide pour qu'on puisse effectuer une manganimétrie ?
20. Quelle est la définition électronique du point d'équivalence d'un dosage d'oxydoréduction ?
21. Comment repère-t-on le point d'équivalence par manganimétrie ? Quelle est la relation existante entre les
volumes et les concentrations, à l'équivalence, du dosage des ions fer (II) ?22. Peut-on doser une solution de chlorure de fer (II) par manganimétrie ?
23. Quelle est l'équation-bilan de la réaction de l'acide nitrique sur les ions fer (II).
24. Quelle est la demi-équation électronique du couple S
4 O 6 2- /S 2 O 3 2- ? Nommer S 4 O 6 2- et S 2 O 3 2-25. Quelle est l'équation-bilan de la réaction de dosage du diiode I
2 par l'ion S 2 O 3 2-26. Comment repère-t-on le point d'équivalence en iodométrie ?
Page 2 sur 4
27. Quelle est la relation existante entre les concentrations et les volumes au point d'équivalence du dosage du
diiode par les ions thiosulfate ?28. Pourquoi le milieu réactionnel ne doit-il pas être très acide dans le cas d'une iodométrie ?
29. Que devient le diiode en milieu basique ?
Exercice 2 : Force électromotrice d'une pile
1. La pile Zn/Zn
2+ //Fe 2+ /Fe a une fo rce électromotric e de 3,32 V. La pi le Fe/Fe 2+ //Cu 2+ /Cu a une fo rce électromotrice de 0,78 V. Calculer la force électromotrice de la pile Zn/Zn 2+ //Cu 2+ /Cu.2. Exprimer la force électromotrice en fonction des potentiels redox des couples mis en jeu. Montrer comment on
mesure un potentiel redox à partir de l'expression précédente.3. Lorsqu'on donne les potentiels redox de deux couples 1 et 2, quels faits expérimentaux peut-on prévoir ?
4. Définir le point d'équivalence dans le cas d'un dosage d'oxydoréduction.
Exercice 3 : Préparation de l'eau de javel
L'eau de Javel, d ésinfectan t d'usage courant, est fabr iquée par action du dichlore gazeux sur une solu tion
d'hydroxyde de sodium.1. Cette réaction d'oxydoréduction met en jeu les deux couples donnés ci-dessous: ClO(aq)/Cl
2 (g) et Cl 2 (g)/Cl (aq). Ecrire les deux demi-équations d'oxydoréduction correspondantes.2. A partir de ces deux demi-équations d'oxydoréduction, donner une équation chimique ayant pour seuls réactifs
Cl 2 (g) et H 2 O.3. Ecrire l'équation de la réaction acido-basique entre les ions oxonium et les ions hydroxyde.
4. En combinant les deux dernières équations, écrire l'équation chimique de synthèse de l'eau de Javel.
Exercice 4 : Oxydation de l'eau oxygénée
Une solution aqueuse de permanganate de potassium peut oxyder l'eau oxygénée en milieu acide.1. Ecrire l'équation de cette réaction d'oxydoréduction sachant que les couples mis en jeu sont : O
2 (ag)/H 2 O 2 et MnO 4 (aq)/Mn 2+ (aq)2. On utilise V
0 = 12 mL de solution de permanganate de potassium de concentration C 0 = 2.10 -2 mol.L -1 pour oxyder V = 20 mL d'eau oxygénée. Déterminer la concentration C de l'eau oxygénée.Exercice 5 : Oxydation de l'éthanol
L'éthanol peut s'oxyder en éthanal CH
3 CHO, et que l'éthanal peut s'oxyder en acide acétique CH 3 CO 2 H.1. Montrer que l'on peut définir deux couples redox CH
3CHO/CH
3 CH 2OH et CH
3 CO 2 H/CH 3 CHO.2. Ecrire les demi-équations relatives à ces deux couples redox.
3. Ecrire les réactions de l'ion MnO
4 , en milieu acide sur l'éthanol, puis sur l'éthanal.4. Situer les deux couples étudiés en 1-, par rapport au couple MnO
4 /Mn 2+Exercice 6 : Dosage en retour
Afin de doser une solution de dichromate de potassium K 2 Cr 2 O 7 , on fabrique une solution titrée de sulfate de ferII FeSO
4à 0,02 mol.L
-11. Ecrire les demi équations des couples Cr
2 O 7 2-/ Cr 3+ et Fe 3+ /Fe 2+ . Que peut-on dire de cette réaction.2. Il n'est pas possible de procéder à un dosage simple, car les ions Cr
2quotesdbs_dbs50.pdfusesText_50[PDF] dosage oxydoreduction pdf
[PDF] dosage par titrage colorimétrique
[PDF] dosage par titrage conductimétrique
[PDF] dosage par titrage conductimétrique destop correction
[PDF] dosage par titrage protocole
[PDF] dosage permanganate de potassium par acide oxalique
[PDF] dosage permanganate de potassium par sel de mohr
[PDF] dosage ph métrique definition
[PDF] dosage ph métrique tp
[PDF] dosage potentiométrique d'une solution de sel de mohr
[PDF] dosage potentiometrique equivalence
[PDF] dosage sulfate ferreux par permanganate de potassium
[PDF] dose mais par hectare
[PDF] dose toxique aspirine
