 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
Écrire l'équation de dissolution du sel de Mohr; préciser les esp`eces présentes dans la solution? Pourquoi doit-on acidifier la solution de permanganate de ...
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Pour éviter ce problème on utilisera le sel de Mohr
 Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en
solution de sel de Mohr connaissant la concentration d'une solution de permanganate de potassium acidifiée constituée d'ions permanganate MnO4. -. S Maret.
 Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions. ) par une solution de permanganate ( 0 ). La réaction de dosage est une réaction
 Dosage potentiométrique
Dosage potentiométrique
solution de permanganate de potassium à la concentration C1 = 20.10-2 mol.L-1. La solution d'ions fer II est préparée avec du sel de Mohr : Le sel de Mohr
 - est réduit en MnO2 insoluble de couleur brune qui empêche la
- est réduit en MnO2 insoluble de couleur brune qui empêche la
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR. I- PRÉPARATION de la • Préparer la burette la remplir de la solution de permanganate de potassium.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
– Ajouter la totalité de cette solution à celle de sel de Mohr et chauffer – réactif titrant dans une burette : solution de permanganate de potassium. KMnO4 ...
 TP Dosage volumétriques doxydoréduction 1. Préparation dune
TP Dosage volumétriques doxydoréduction 1. Préparation dune
Boucher agiter et compléter avec l'eau déminéralisée. 2. Dosage du sel deMohr avec la solution de permanganate de potassium. Placer dans la burette une
 Le dosage de léthanol dans un vin
Le dosage de léthanol dans un vin
Le reste de permanganate est ensuite dosé par une solution de sel de Mohr en milieu permanganate de potassium 025 M (KMnO4):. Il faut introduire dans le ...
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
(V ) = volume de solution de permanganate de potassium verséàl'équivalence. avancement. 8H+. + 5 Fe2+ + MnO4. -. ? 5 Fe.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Première partie : préparation d'une solution étalon de Fe2+ et dosage d'une Le permanganate de potassium KMnO4 sel soluble et totalement dissocié
 DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
On dose une solution de fer (II) de concentration (C2) par une solution de permanganate de potassium de concentration (C1 = 002 mol.L-1) en milieu acide. Le
 Détermination de la formule du sel de Mohr
Détermination de la formule du sel de Mohr
On réalise le dosage des ions Fe2+ d'une solution S1 obtenue par dilution de S0 par une solution de permanganate de potassium de concentration Co= 300.10-2 mol
 TRAVAUX PRATIQUES DE CHIMIE
TRAVAUX PRATIQUES DE CHIMIE
En milieu acide fort le permanganate de potassium (solution oxydante) peut être Mesure 2 : Doser 10mL de sel de Mohr par la solution de permanganate en.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol. réactif titrant dans une burette : solution de permanganate de potassium.
 Dosage de léthanol dans un vin blanc
Dosage de léthanol dans un vin blanc
acide éthanoïque par un excès de permanganate de potassium en milieu acide. Le permanganate en excès est dosé par une solution étalonnée de sel de Mohr.
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
Pour déterminer la concentration de la solution à doser cS on connaît : ETALONNAGE DU PERMANGANATE DE. POTASSIUM ... DE POTASSIUM PAR LE SEL DE MOHR.
 Le dosage de léthanol dans un vin
Le dosage de léthanol dans un vin
Le reste de permanganate est ensuite dosé par une solution de sel de Mohr en 50 ml préparer une solution A de permanganate de potassium 025 M (KMnO4):.
Étude d'une réactionÉtude d'une réaction : titrage des ions fer II par les ions permanganate: titrage des ions fer II par les ions permanganate
I - Généralités sur les titrages
1) Objectif d'un titrage
Il permet, à l'équivalence, de déterminer la concentration inconnue d'une solution à partir d'une
solution de concentration connue. Pour cela, il faut déterminer le volume équivalent, c'est-à-dire le
volume versé de solution titrante (en général mais parfois, c'est l'inverse) pour lequel les réactifs sont
dans les conditions stoechiométriques. La connaissance de ce volume permet de déterminer la valeur
de xéq.2) Comment repérer l'équivalence ?
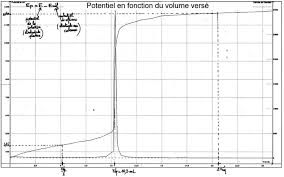
Il existe deux types de titrages étudiés cette année : - colorimétrique ; - conductimétrique.Dans un titrage colorimétrique, l'équivalence est repérée par un changement de coloration au sein du
mélange réactionnel (virage coloré). Le volume versé de solution titrante au moment du changement
de coloration, lue sur la burette, correspond au volume équivalent.Dans un titrage conductimétrique, la valeur de la conductance est relevée pour chaque mL du réactif
titrant versé, vous notez qu'elle diminue puis augmente. La courbe G = f(V) est tracée et l'équivalence
se situe à la cassure de la courbe et il est possible de déterminer le volume équivalent graphiquement.
3) Matériel utilisé
- une burette graduée contenant le réactif titrant ; - un agitateur magnétique (boîtier et aimant) - un bécher de garde ;- un bécher contenant la solution à titrer (prélevée par une pipette jaugée dans un bécher) ;
Il faut également une pissette d'eau distillée pour rincer le bécher entre les deux dosages.
Exemple :
Solution de permanganate de potassium
K+(aq) + MnO4-(aq)
Concentration [MnO4-]
Volume équivalent Véq à déterminer ?
Solution acidifiée de sel de Mohr
Concentration inconnue [Fe2+] ?
Volume V
II - Étude de la réaction chimique
1) Pourquoi un virage coloré à l'équivalence ?
Les ions permanganate MnO4-, violet, et les ions fer II Fe2+ réagissent ensemble pour donner des ions
manganèse Mn2+, incolores, et des ions fer III Fe3+, jaune pâle presque incolores.Tant qu'il reste des ions fer II dans le mélange réactionnel, les ions permanganate versés deviennent
des ions manganèse incolores et le mélange réactionnel reste incolore.Au moment où tous les ions fer II ont réagi, la première goutte versée contenant des ions
permanganate ne se décolore plus - les ions permanganate ne réagissent plus - et donne une teinte
rose au mélange réactionnel, c'est l'équivalence.2) Pourquoi acidifier le sel de Mohr ?
L'ion permanganate appartient à différents couples selon l'acidité du milieu. Pour que ce soit le couple
MnO4-(aq) / Mn2+(aq) qui interviennent, le mélange réactionnel doit être acide d'où l'ajout d'acide dans
la solution à titrer.3) Couples en présence et demi-équations de couple
MnO4-(aq) / Mn2+(aq)MnO4-(aq) + 8 H+ + 5 e - = Mn2+(aq) + 4 H2O(l) Fe3+(aq) / Fe2+(aq) Fe3+(aq) + e- = Fe2+(aq)4) Demi-équations de réaction et équation de réaction
MnO4-(aq) + 8 H+ + 5 e- → Mn2+(aq) + 4 H2O(l) ( Fe2+(aq) → Fe3+(aq) + e- )x 5 MnO4-(aq) + 8 H+ + 5 Fe2+(aq) → 5 Fe3+(aq) + Mn2+(aq) + 4 H2O(l)5) Bilan des grandeurs et quantités de matière accessibles
De quelles grandeurs disposons-nous ?
- de la concentration en ions MnO4- [MnO4-] ; - du volume de la solution contenant les ions fer II dans le bécher V ; - et du volume versé Véq, à l'équivalence, de la solution contenant les ions MnO4-. Nous recherchons la concentration en ions fer II [Fe2+]. Quantité de matière initiale d'ions fer II dans le bécher ni(Fe2+) = [Fe2+] x V Quantité de matière d'ions permanganate versée à l'équivalence nv(MnO4-) = [MnO4-] x Véq6) Relation entre les quantités de matière à l'équivalence
Les ions fer II ont réagi avec la totalité des ions permanganate versés. Leurs quantités à l'équivalence
sont nulles, xéq représente l'avancement à l'équivalence lorsque les conditions sont stoechiométriques.
néq(Fe2+) = ni(Fe2+) - 5 xéq= 0xéq = ni(Fe2+) / 5 néq(MnO4-) = nv(MnO4-) - xéq= 0xéq = nv(MnO4-) Vous en déduisez la relation suivante : xéq = ni(Fe2+) / 5 = nv(MnO4-) qui peut s'écrire encore : [Fe2+] x V / 5 = [MnO4-] x VéqIl reste à exprimer la concentration en ion fer II: [Fe2+] = 5 [MnO4-] x Véq / V
Toutes les grandeurs sont connues (concentration en ions permanganate, volume équivalent, volume de la solution contenant les ions fer II), la concentration en ions fer II est donc déterminable.quotesdbs_dbs6.pdfusesText_12[PDF] dosage ph métrique tp
[PDF] dosage potentiométrique d'une solution de sel de mohr
[PDF] dosage potentiometrique equivalence
[PDF] dosage sulfate ferreux par permanganate de potassium
[PDF] dose mais par hectare
[PDF] dose toxique aspirine
[PDF] dossier a fournir campus france guinee
[PDF] dossier a fournir pour le crem
[PDF] dossier a fournir visa france en cote d'ivoire
[PDF] dossier art appliqué bac pro commerce
[PDF] dossier art appliqué bac pro exemple 2012
[PDF] dossier art appliqué bac pro exemple coca cola
[PDF] dossier art appliqué bac pro pdf
[PDF] dossier art appliqué bac pro terminal 2015
