 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
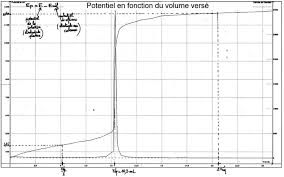 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
Écrire l'équation de dissolution du sel de Mohr; préciser les esp`eces présentes dans la solution? Pourquoi doit-on acidifier la solution de permanganate de ...
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Pour éviter ce problème on utilisera le sel de Mohr
 Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en
solution de sel de Mohr connaissant la concentration d'une solution de permanganate de potassium acidifiée constituée d'ions permanganate MnO4. -. S Maret.
 Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions. ) par une solution de permanganate ( 0 ). La réaction de dosage est une réaction
 Dosage potentiométrique
Dosage potentiométrique
solution de permanganate de potassium à la concentration C1 = 20.10-2 mol.L-1. La solution d'ions fer II est préparée avec du sel de Mohr : Le sel de Mohr
 - est réduit en MnO2 insoluble de couleur brune qui empêche la
- est réduit en MnO2 insoluble de couleur brune qui empêche la
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR. I- PRÉPARATION de la • Préparer la burette la remplir de la solution de permanganate de potassium.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
– Ajouter la totalité de cette solution à celle de sel de Mohr et chauffer – réactif titrant dans une burette : solution de permanganate de potassium. KMnO4 ...
 TP Dosage volumétriques doxydoréduction 1. Préparation dune
TP Dosage volumétriques doxydoréduction 1. Préparation dune
Boucher agiter et compléter avec l'eau déminéralisée. 2. Dosage du sel deMohr avec la solution de permanganate de potassium. Placer dans la burette une
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
(V ) = volume de solution de permanganate de potassium verséàl'équivalence. avancement. 8H+. + 5 Fe2+ + MnO4. -. ? 5 Fe.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Première partie : préparation d'une solution étalon de Fe2+ et dosage d'une Le permanganate de potassium KMnO4 sel soluble et totalement dissocié
 DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
On dose une solution de fer (II) de concentration (C2) par une solution de permanganate de potassium de concentration (C1 = 002 mol.L-1) en milieu acide. Le
 Détermination de la formule du sel de Mohr
Détermination de la formule du sel de Mohr
On réalise le dosage des ions Fe2+ d'une solution S1 obtenue par dilution de S0 par une solution de permanganate de potassium de concentration Co= 300.10-2 mol
 TRAVAUX PRATIQUES DE CHIMIE
TRAVAUX PRATIQUES DE CHIMIE
En milieu acide fort le permanganate de potassium (solution oxydante) peut être Mesure 2 : Doser 10mL de sel de Mohr par la solution de permanganate en.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol. réactif titrant dans une burette : solution de permanganate de potassium.
 Dosage de léthanol dans un vin blanc
Dosage de léthanol dans un vin blanc
acide éthanoïque par un excès de permanganate de potassium en milieu acide. Le permanganate en excès est dosé par une solution étalonnée de sel de Mohr.
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
Pour déterminer la concentration de la solution à doser cS on connaît : ETALONNAGE DU PERMANGANATE DE. POTASSIUM ... DE POTASSIUM PAR LE SEL DE MOHR.
 Le dosage de léthanol dans un vin
Le dosage de léthanol dans un vin
Le reste de permanganate est ensuite dosé par une solution de sel de Mohr en 50 ml préparer une solution A de permanganate de potassium 025 M (KMnO4):.
Le dosage de l'éthanol
AdM 1
Le dosage de l'éthanol dans un vin
Principe:
On fait réagir l'éthanol complètement avec un nombre de moles de permanganate bien connu et en excès. Le reste de permanganate est ensuite dosé par une solution de sel de Mohr en milieu acide. Le calcul fournit le nombre de moles d'éthanol qui a réagi.Mode opératoire:
a) A 20 ml de vin V, on a ajouté 60 ml d'eau et ce mélange a été distillé. On a recueilli dans un
jaugé exactement 60 ml d'un mélange M comportant tout l'éthanol qui se trouvait dans les 20 ml
de vin et de l'eau.La concentration de l'éthanol dans le mélange M est donc ......... fois plus petite que dans le
vin V b) Dans un jaugé de 50 ml préparer une solution A de permanganate de potassium 0,25 M (KMnO4 Il faut introduire dans le jaugé ........................ = ............ mol de permanganate = ........................ = ............. g de permanganate et remplir au trait de jauge tout en dissolvant le permanganatec) Dans un erlenmeyer de 500 ml, on mélangera dans cet ordre : 1) 20 ml d'eau distillée 2) 20 ml
d'acide sulfurique concentré (danger !!) 3) 30 ml de la solution A de permanganate 4) 10 ml de la solution M d'éthanol. Boucher l'erlen et laisser agir cette solution S à 40 oC pendant 20 minutes.
Vous savez que l'éthanol est oxydé en éthanoïque. .............. mol de permanganate oxydent ............... mol d'éthanol (voir cours)d) Pendant ces 20 minutes : Dans un jaugé de 50 ml préparer une solution B de sel de Mohr 0,25 M
( (NH4 2 Fe(SO 4 2 .6H 2 O Il faut introduire dans le jaugé ........................ = ............ mol de sel de Mohr = ........................ = ............. g de sel de Mohr et remplir au trait de jauge tout en dissolvant le sele) Remplir une burette de la solution B et titrer le reste de permanganate (qui n'a pas réagi avec
l'éthanol, donc qui était en excès) par le sel de Mohr. Calculer le nombre de mol de permanganate
initial dans S, le nombre de mol de permanganate en excès, le nombre de mol de permanganate qui a réagi, le nombre de mol d'éthanol initial dans S, puis dans M, puis dans V, sachant que Une mole de sel de Mohr renferme ......... mol de Fe 2+ ....... mol de Fe 2+ réagissent avec ......... mol de MnO 4 (Équilibrer le système rédox Fe 2+/ Fe3+ || MnO 4 - /Mn 2+ --- les calculs sont à faire au verso de cette feuille -----quotesdbs_dbs50.pdfusesText_50[PDF] dosage ph métrique tp
[PDF] dosage potentiométrique d'une solution de sel de mohr
[PDF] dosage potentiometrique equivalence
[PDF] dosage sulfate ferreux par permanganate de potassium
[PDF] dose mais par hectare
[PDF] dose toxique aspirine
[PDF] dossier a fournir campus france guinee
[PDF] dossier a fournir pour le crem
[PDF] dossier a fournir visa france en cote d'ivoire
[PDF] dossier art appliqué bac pro commerce
[PDF] dossier art appliqué bac pro exemple 2012
[PDF] dossier art appliqué bac pro exemple coca cola
[PDF] dossier art appliqué bac pro pdf
[PDF] dossier art appliqué bac pro terminal 2015
