 Théorie et pratique des mesures de la pression osmotique par
Théorie et pratique des mesures de la pression osmotique par
posent à propos du calcul de la pression osmotique dont l'importance en biologie pression osmotique en solution. A nouveau cette loi n'est vérifiable que ...
 osmolarite.pdf
osmolarite.pdf
exemple : calcul de la pression osmotique due à une solution de. 10 mM de NaCl à 20°C. n/V = 10 mM. NaCl en solution : se dissocie en Na+ et Cl-. → i = 2.
 osmose_cryometrie_starling [Mode de compatibilité]
osmose_cryometrie_starling [Mode de compatibilité]
La pression osmotique est égale à la différence des pressions osmotiques de chacune des deux solutions opposées à travers la même membrane
 Travaux pratiques de physiologie végétale
Travaux pratiques de physiologie végétale
de solutions de concentration croissante celle qui en équilibre osmotique - Calculer la pression osmotique du suc vacuolaire en fonction des résultats ...
 Chapitre 2
Chapitre 2
Calcul de la pression osmotique en unités internationale : Pascal (Pa) ✓ La grandeur π = ρgh est appelée la pression osmotique de la solution c'est-à-dire ...
 POLYCOPIE DES TRAVAUX DIRIGES DE PHYSIOLOGIE VEGETALE
POLYCOPIE DES TRAVAUX DIRIGES DE PHYSIOLOGIE VEGETALE
Quelles sont ces deux pressions ? 2. Calculer la pression osmotique exercée à -20°C par une solution de saccharose à. 171g/l. 3.
 Biologie cellulaire. Exercices et méthodes
Biologie cellulaire. Exercices et méthodes
b. La pression osmotique de la solution aqueuse 20 % sera plus grande. □ c. L'eau va passer au travers de la membrane
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Isotonie : solutions qui ont la même pression osmotique (= concentration en ions dissous). Hypotonie : solution avec une concentration en ions.
 Production de la matière organique et flux dénergie
Production de la matière organique et flux dénergie
1- Calculer la concentration molaire et la concentration massique et la concentration en pourcentage (C%) ? 2- Calculer la pression osmotique de la solution ?
 Osmose inverse.pdf
Osmose inverse.pdf
Si on applique une pression sur la solution concentrée la quantité d'eau calculer la pression osmotique théorique de l'eau salée utilisée. • tracer ...
 osmolarite.pdf
osmolarite.pdf
exemple : calcul de la pression osmotique due à une solution de. 10 mM de saccharose à 20°C. n/V = 10 mM saccharose en solution : ne se dissocie pas.
 Untitled
Untitled
exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 M de saccharose et d'une solution B contenant 10 M de NaCl.
 Théorie et pratique des mesures de la pression osmotique par
Théorie et pratique des mesures de la pression osmotique par
n'échappe pas à cette étape analytique et la connaissance des solutions posent à propos du calcul de la pression osmotique dont l'importance en.
 Biologie cellulaire. Exercices et méthodes
Biologie cellulaire. Exercices et méthodes
À 0 ºC la pression osmotique d'une solution benzénique de 7
 TD eau et régulation osmotique
TD eau et régulation osmotique
Calculer la molarité d'une solution aqueuse contenant 585 mg de NaCl par litre différence de pression osmotique entre les deux compartiments.
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Reconstitution de solutions à partir d'une poudre. Calculs de doses choix de solvants Isotonie : solutions qui ont la même pression osmotique (=.
 Chapitre 2
Chapitre 2
En comparant le solvant pur avec la solution présente : Exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de.
 a) Donner la définition de la molarité dune solution. b) Calculer la
a) Donner la définition de la molarité dune solution. b) Calculer la
Calculer la pression oncotique « vraie » à partir de l'équation de van't Hoff. réponse : Concentration molaire en albumine = 45/69 000 = 0652 mM
 (Démonstration cours )
(Démonstration cours )
Le compartiment A renferme une solution d'urée à 174 mg/l et l'autre une pure à la température T=37°C. Calculer la pression osmotique.
 VI-Application de la Pression osmotique:
VI-Application de la Pression osmotique:
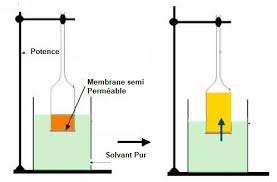
Soit une membrane perméable au solvant (l'eau) et séparant deux compartiments dont l'un contient de l'eau pure et l'autre un soluté en solution aqueuse.
 [PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
[PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
posent à propos du calcul de la pression osmotique dont l'importance en 1 Enoncé L'abaissement du point de congélation d'une solution étendue et non
 Propriétés des solutions aqueuses et pression osmotique
Propriétés des solutions aqueuses et pression osmotique
Calculer la pression osmotique d'une solution de saccharose de concentration 06 mole par litre à la température de 20°C On a c = 06 mol l-1 ; T = 29315 K
 [PDF] osmolaritepdf - e-fisio
[PDF] osmolaritepdf - e-fisio
exemple : calcul de l'osmolarité et de la pression osmotique d'une solution contenant 10 mM d'urée physique de l'osmolarité osmolarité : 10 x 1 x 1 = 10
 [PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
[PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
c) Quelle est la pression osmotique si ce travail est développé en 02 s Corrigé 1 l = 10-3 m3 12 h = 43200 s Pour calculer la pression osmotique
 [PDF] Osmose Pression osmotique
[PDF] Osmose Pression osmotique
Osmose Pression osmotique 1 Situation expérimentale Calcul des flux • Membrane imperméable au soluté T = 0 (mais perméable au solvant)
 [PDF] Chapitre 2 - opsuniv-batna2dz
[PDF] Chapitre 2 - opsuniv-batna2dz
La pression osmotique est par définition la pression qu'il faudrait exercer sur une solution pour l'amener à un état d'équilibre (= absence de flux net) avec
 [PDF] Biologie cellulaire Exercices et méthodes - Dunod
[PDF] Biologie cellulaire Exercices et méthodes - Dunod
1) Quelle solution possède la plus grande pression osmotique ? 2) Quelle solution se dilue au passage de l'eau au travers de la membrane ?
 [PDF] Chapitre 3 : Losmose
[PDF] Chapitre 3 : Losmose
*Étudier la Pression oncotique et équilibre de Sterling ainsi que Énergie Pré-requis : L'étudiant est capable de calculer : *La pression osmotique *La
 [PDF] TD eau et régulation osmotique
[PDF] TD eau et régulation osmotique
La membrane séparant A et B est perméable a l'eau mais pas aux ions (membrane semi- perméable) Calculer la pression osmotique de cette solution en kPa (T° =
Comment calculer la pression osmotique de la solution ?
Pour calculer une pression osmotique, la formule de calcul est basée sur : Posmotique = nRT/V, où Posmotique = kPa = atmosphères. La pression osmotique d'une solution diluée obéit à une relation de même forme que la loi des gaz parfaits.Comment calculer la pression osmotique d'une solution de NaCl ?
Pression, tension osmotique. Pression qui détermine le phénomène d'osmose et qui correspond à la différence des pressions exercées de part et d'autre d'une membrane semi-perméable par deux liquides de concentration différente.C'est quoi la pression osmotique en SVT ?
La pression osmotique naît de la séparation par une membrane* semi-perméable de deux compartiments de concentrations différente. L'eau migre du compartiment le moins concentré vers le plus concentré afin d'« équilibrer » le système pour avoir la même force ionique dans les deux compartiments.
ÉÉtiennetienneRouxRouxAdaptation cardiovasculaire Adaptation cardiovasculaire ààll''ischischéémiemieINSERM U INSERM U 10341034
UFR des Sciences de la Vie Universit
UFR des Sciences de la Vie UniversitééBordeaux SegalenBordeaux Segalen contact: contact: etienne.rouxetienne.roux@u@u--bordeaux2.frbordeaux2.fr support de cours : support de cours : plateforme p plateforme péédagogiquedagogiquell''UFR des sciences de la UFR des sciences de la VieVie e e--fisio.netfisio.net plan du cours (format pdf) diaporama du cours (format ppt) rappel de calcul de base (format ppt) ll''osmolaritosmolaritéé planI .mise en évidence de la pression osmotique
II. caractéristiques physiques de l'osmolarité III. osmolarité et volume cellulaire : les cellules dans l'organismeIV. pression oncotique : les compartiments de
l'organisme I. mise en I. mise en éévidence devidence dela pression osmotiquela pression osmotique observation expérimentale définitions pression osmotique osmose osmolarité osmolarité - osmolalité mise en mise en éévidence devidence dela pression osmotiquela pression osmotique expériences eau10 mM saccharose
membrane semi-perméable = perméable à l'eau imperméable aux solutés saccharose eau10 mM saccharose
membrane semi-perméable = perméable à l'eau imperméable aux solutéspression sur le piston saccharose244 hPa
mise en mise en éévidence devidence dela pression osmotiquela pression osmotique expériences eau10 mM NaCl
membrane semi-perméable = perméable à l'eau imperméable aux solutés saccharose NaCl mise en mise en éévidence devidence dela pression osmotiquela pression osmotique expériences eau10 mM NaCl
membrane semi-perméable = perméable à l'eau imperméable aux solutéspression sur le piston NaCl saccharose453 hPa
mise en mise en éévidence devidence dela pression osmotiquela pression osmotique expériences mise en mise en éévidence devidence dela pression osmotiquela pression osmotique définition pression osmotique La pression osmotique est la pression exercée par les particules en solution, et responsable de l'osmose. osmose mouvement d'eau à travers une membrane semi-perméable, du compartiment le moins concentré en particules en solution vers le compartiment le plus en particules en solution. osmolarité L'osmolarité d'une solution est le nombre de moles de particules en solution dans 1 litre de solution.1 osmole (osm) correspond à une mole de particules.
mise en mise en éévidence devidence dela pression osmotiquela pression osmotique définition molarité et molalité La molarité est la concentration exprimée en moles par litre de solution. Une solution qui contient une mole par litre est une solution molaire. La molalité est la concentration exprimée en moles par kg d'eau. Une solution qui contient une mole par kg d'eau est une solution molale. osmolarité et osmolalité L'osmolarité d'une solution est le nombre de moles de particules en solution dans 1 litre de solution. L'osmolalité est le nombre de moles de particules en solution dans 1 kg d'eau. II. physique de lII. physique de l''osmolaritosmolaritéé osmolarité d'une solution ; coefficient osmotique exemples de calculs coefficient osmotique la loi de van't Hoff définition unités exemples osmolarité d'un mélange de solutés osmolarité efficace solutés imperméants solutés perméants dynamique de l'osmose physique dephysique dell''osmolaritosmolaritéé osmolarité L'osmolarité d'une solution est le nombre de moles de particules en solution dans 1 litre de solution.1 osmole (osm) correspond à une mole de particules.
exemple : calcul de l'osmolarité d'une solution de 10 mM de saccharose10 mM = 0,001 mol/L = 10
-3 mol/ L = 10 mol/m 3 saccharose = soluble dans l'eau en solution : ne se dissocie pas1 molécule de sacharose en solution = 1 particule en solution
10 millimoles de saccharose 10 milliosmoles de saccharose
osmolarité L'osmolarité d'une solution est le nombre de moles de particules en solution dans 1 litre de solution.1 osmole (osm) correspond à une mole de particules.
exemple : calcul de l'osmolaritéd'une solution de 10 mM de NaCl10 mM = 0,001 mol/L = 10
-3 mol/ L = 10 mol/m 3NaCl = soluble dans l'eau
en solution : se dissocie en Na et Cl1 molécule de NaCl en solution 2 particules en solution*
(*tout le NaCl ne de dissocie pas en Na et Cl10 millimoles de NaCl 20 milliosmoles de NaCl
physique dephysique dell''osmolaritosmolaritéé osmolarité l'osmolarité dépend de : concentration en soluté nombre de particules effectivement formées par la dissociation du soluté: nombre de particules formées par la dissociation d'une molécule de soluté facteur de correction : toutes les molécules de soluté ne se dissocient pas en solution coefficient osmotique physique dephysique dell''osmolaritosmolaritéé osmolarité osmolarité = (n/V).i. nnombre de moles de solutéV: volume
n/V = molarité de la solution i : nombre de particules formées par dissociation du soluté (phi) : coefficient osmotique = facteur de correction (NB: n'est pas le pourcentage de dissociation) coefficient osmotique 1 exemples : MgCl 2 : = 0, = 3NaCl : = 0, = 2
= 1 dans 2 cas i>1 (le soluté se dissocie en solution) = 1 si 100% de dissociation i=1 (le soluté ne se dissocie pas en solution) = 1 (pas de correction) physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff La pression osmotique d'une solution est donnée par la loi de van't Hoff, dérivée de la loi sur les gaz parfaits. = R.T.(n/V).i.R : constante des gaz parfaits
T : température
nnombre de moles de soluté V: volume (!!! l'unité internationale de volume est le m 3 , et non le litre) i : nombre de particules formées par dissociation du soluté (phi) : coefficient osmotique = facteur de correction définition physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff calcul de la pression osmotique en unités internationale : Pascal (Pa) = R.T.(n/V).i.1 atm = 101,3 kPa = 760 mmHg
R = 8,314 (UI)
T : en Kelvin (0 K = -273,15°C ; 1 K = 1°C)
nsans unité i : sans unité: sans unité V: !!! l'unité internationale de volume est le m 3 , et non le litre unités Pa osmolarité : en osm/m 3 en mosm/L physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff calcul de la pression osmotique en unités internationale : Pascal (Pa) = R.T.(n/V).i.1 atm = 101,3 kPa = 760 mmHg
R = 8,314 (UI)
T : en Kelvin (0 K = -273,15°C ; 1 K = 1°C)
nsans unité i : sans unité: sans unité V: !!! l'unité internationale de volume est le m 3 , et non le litre unités kPa osmolarité : en osm/L (M) physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff = R.T.(n/V).i. exemple : calcul de la pression osmotique due à une solution de10 mM de saccharose, à 20°C.
n/V = 10 mM saccharose en solution : ne se dissocie pas i = 1 = 1 = 8,314 x (20+273,15) x 10 x 1 x 1 = 24372 Pa 244 hPa exemples physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff = R.T.(n/V).i. exemple : calcul de la pression osmotique due à une solution de10 mM de NaCl, à 20°C.
n/V = 10 mMNaCl en solution : se dissocie en Na
et Cl i = 2 = 0,93 = 8,314 x (20+273,15) x 10 x 2 x 0,93 = 45333 Pa 453 hPa exemples physique dephysique dell''osmolaritosmolaritéé physique dephysique dell''osmolaritosmolaritéé osmolarité d'un mélange exemple : calcul de l'osmolarité d'une solution contenant 10 mM de sacharose et 10 mM de NaCl osmolaritémolarité x(i. osmolarité d'un soluté osmolarité d'un mélange de solutés osmolarité totale osmolarité de chaque soluté osmolarité du saccharose : 10 x 1 x 1 = 10 mosm. L -1 osmolarité du NaCl : 20 x 2 x 0,93 = 18,6 mosm. L -1 osmolarité totale = 28,6 mosm. L -1 osmolarité efficace solutés imperméantsexemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de saccharose et d'une solution B contenant 10 mM de NaCl physique dephysique dell''osmolaritosmolaritééABsaccharose
NaCl = R.T.(n/V).i. = R. T. osmolarité B = 8,314 x293,15x 18,3
= 453 hPa A = 8,314 x293,15 x 10
= 244 hPa A B = 244 - 453 = -209 hPa la différence de pression osmotique crée un mouvement d'eau de A vers B osmolarité efficace solutés imperméants physique dephysique dell''osmolaritosmolaritéé saccharoseNaCl AB A final > A initial (concentration due à la perte d'eau) le mouvement d'eau de A vers B crée, par la différence de hauteur, une pression hydrostatique qui s'oppose à l'osmose. B final < B initial (dilution due au gain en eau) h A -h B à l'équilibre, la différence de pression osmotique est égale à la différence de pression hydrostatique qui s'exerce en sens opposé osmolarité efficace solutés perméantscertains solutés traversent la membrane semi-perméable exemple : calcul de l'osmolarité et de la pression osmotique d'une solution contenant 10 mM d'urée physique dephysique dell''osmolaritosmolaritéé osmolarité : 10 x 1 x 1 = 10 mosm.L -1 osmolaritémolarité x(i. = R.T.(n/V).i.= R. T. osmolarité urée = 8,314 x 293,15 x 10 = 244 hPa osmolarité efficace exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de saccharose et d'une solution B contenant 10 mM d'urée physique dephysique dell''osmolaritosmolaritééABsaccharose
urée = R.T.(n/V).i. = R. T. osmolarité B = 8,314 x293,15x 10
= 244 hPa A = 8,314 x293,15 x 10
= 244 hPa A B = 244 - 244 = 0 hPa si la membrane est imperméable à l'urée, il n'y a aucun mouvement d'eau solutés perméants osmolarité efficace exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de saccharose et d'une solution B contenant 10 mM d'urée physique dephysique dell''osmolaritosmolaritééABsaccharose
urée = R.T.(n/V).i. = R. T. osmolarité B = 8,314 x293,15 x 5
= 122 hPa A = 8,314 x293,15 x (10 + 5)
= 244 + 122 = 366 hPa A Bquotesdbs_dbs12.pdfusesText_18[PDF] calcul pression osmotique nacl
[PDF] osmose pomme de terre
[PDF] structure en coque architecture
[PDF] structure ? ossature
[PDF] construction de maison ? ossature de bois livre
[PDF] construction de maison ? ossature de bois
[PDF] maison ossature bois canada
[PDF] portée des solives de plancher
[PDF] coupe de mur maison ossature bois
[PDF] assemblage ossature bois
[PDF] ostinato mélodique exemple
[PDF] chanson connue avec ostinato
[PDF] ostinato musique classique
[PDF] culture en placard pdf
